lncRNA EMS 将c-Myc和细胞周期调控以及肿瘤发生联系在一起
导语:
c-Myc的表达失调是癌症的重要分子标志。 c-Myc的致癌功能很大程度上归因于其作为主要转录因子的内在本质。 在这里,将报告一种长链非编码RNA(lncRNA)E2F1信使RNA(mRNA)稳定因子(EMS)作为c-Myc的直接转录目标。 EMS通过促进G1 / S细胞周期进程而充当致癌分子。 从机理上讲,EMS与RNA结合蛋白RALY协同作用来稳定E2F1 mRNA,从而增加E2F1的表达。此外,EMS能够通过调节E2F1 mRNA的稳定性将c-Myc连接到细胞周期控制和肿瘤发生。 总而言之,这些发现揭示了一种未发现的机制,即c-Myc诱导E2F1表达的机制,也暗示EMS是调节c-Myc功能的重要参与者。
技术路线:
1、使用癌症基因组图谱(TCGA)数据库分析找出具有致癌功能的c-Myc反应性lncRNA
2、通过实时RT-PCR或Western印迹分析验证了成功的慢病毒介导的敲低和过表达。
3、ASO的转染,实时RT-PCR,5′ RACE and 3′ RACE. 5
4、RNA原位杂交确定EMS,RNA在细胞中的分布
5、合成EMS及其反义RNA进行体外转录
6、生物素下拉检查EMS和RALY裂解物之间的相互作用
7、ChIP分析、异种移植小鼠模型、
研究结果:1.EMS通过促进G / S细胞周期进程而充当致癌lncRNA使用TCGA数据库分析, ENCODE c-Myc染色质免疫沉淀测序(ChIP-seq)数据集的分析表明EMS为分子大小为1,098 nt的RNA转录本,主要位于细胞质中。数据表明EMS促进细胞增殖。确定了EMS促进细胞增殖并评估了EMS对细胞周期分布的影响。后面证明了EMS通过加速G1 / S细胞周期进程来促进细胞增殖。再进行了软琼脂菌落形成试验、异种移植小鼠模型,显示出EMS基因敲低可强烈抑制A549细胞的体内异种移植肿瘤生长。TCGA数据库的分析,LUAD,LUSC,COAD和乳腺浸润性癌(BRCA)中的EMS表达水平升高。此外,肿瘤细胞系A549,PC9和H1299具有更高的EMS拷贝数。
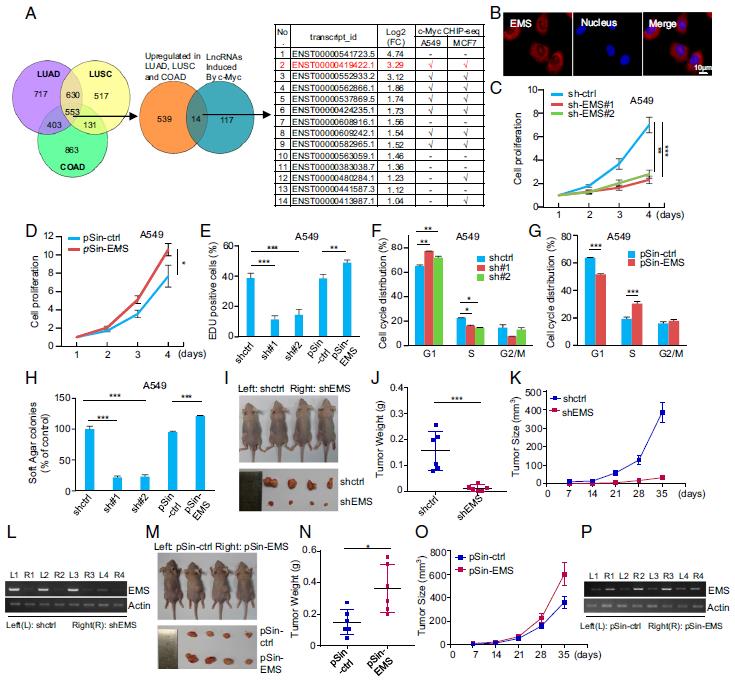
2 .EMS是c-Myc的直接转录目标
通过RNA测序分析,EMS被鉴定为c-Myc反应性lncRNA。证明c-Myc的诱导增加,而c-Myc的敲低减少,A549,PC9,H1299,HCT116和MCF7细胞中的EMS表达,表明c-Myc对EMS表达的特异性作用。根据c-Myc和EMS细胞表达之间的关系,对TCGA数据库的分析表明,c-Myc和EMS的表达水平在LUAD,LUSC,COAD和BRCA中呈正相关。接下来,使用JASPAR数据库检查EMS基因的上游和内含子区域(43)。确定了三个推定的c-Myc结合位点(D1,D2和D3。此外,对ENCODE ChIP-seq数据集的分析表明,在EMS的转录起始位点周围存在c-Myc和活性组蛋白标记H3K4me3。 ChIP分析验证了c-Myc与包含D2位点的染色质片段的相互作用。使用了基于pGL3的荧光素酶报告基因构建表明EMS受c-Myc转录调控。
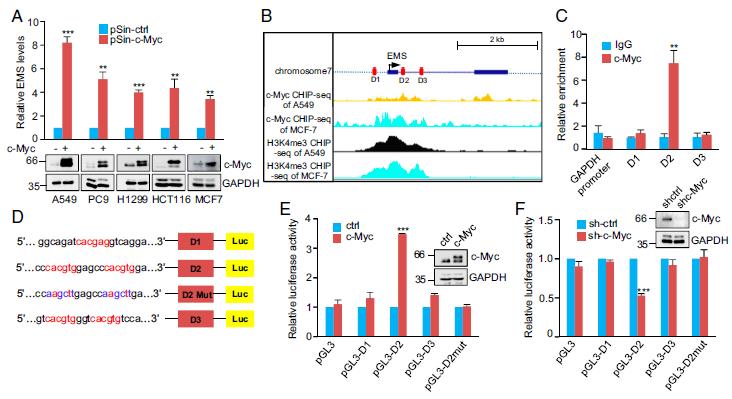
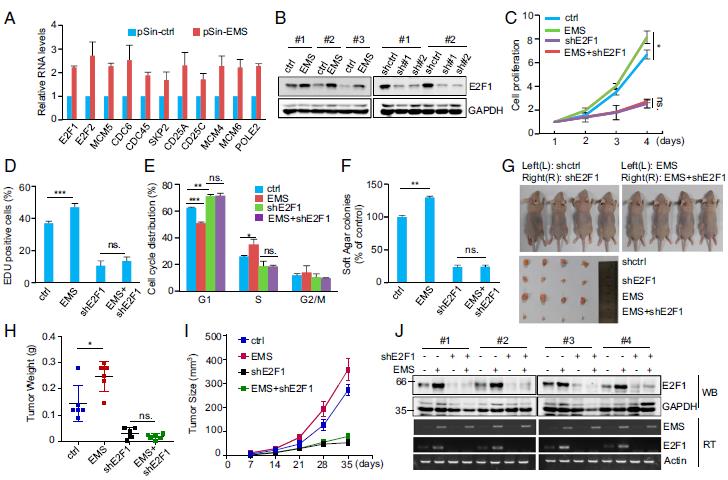
3.MS通过增加E2F1表达发挥其致癌作用
EMS的敲低或过表达均未显示影响IFT22和lncPRESS1的表达水平。基因表达谱分析。敲出EMS导致987个基因的差异表达。基因集富集分析表明, E2F目标显着富集。EMS对E2F1通路产生积极影响,对EMS过表达和敲低细胞中E2F1及其靶基因mRNA表达的积极影响。另外,EMS的异位表达增加,而EMS的敲低降低了E2F1的蛋白质水平。TCGA数据库分析表明,EMS和E2F1的表达水平在LUAD,LUSC,COAD和BRCA中呈正相关。这些数据表明,EMS能够积极调节E2F1表达。EMS加速了G1 / S细胞周期的进展。通过使用异种移植小鼠模型,发现EMS促进了裸鼠的异种移植肿瘤生长。通过E2F1诱导可以极大地恢复EMS抑制性抑制异种移植瘤的生长。综上所述,这些发现表明EMS通过增加E2F1表达发挥其致癌作用。
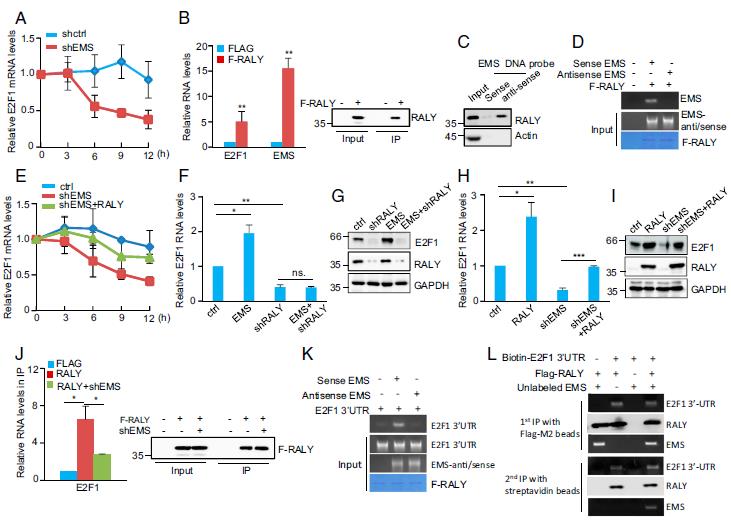
4.EMS与RALY合作提高E2F1 mRNA的稳定性
用actinomycinD处理具有击倒或EMS过度表达的A549细胞不同时间,以测量E2F1 mRNA的衰减。击倒EMS会导致E2F1 mRNA的半衰期减少,而EMS的过表达会延长E2F1 mRNA的半衰期,表明EMS可以稳定E2F1 mRNA。lncRNA H19确实存在于Ago2免疫沉淀物中。与H19不同,EMS没有富含Ago2免疫沉淀物。对EMS序列的分析表明,EMS包含具有22个尿苷的聚U区段,表明RALY也可能与EMS相互作用。进RNA免疫沉淀实验,EMS确实富集了Flag-RALY免疫沉淀。通过生物素下拉测定法也验证了RALY-EMS的相互作用。此外,体外结合试验表明,RALY与EMS直接相互作用,但不与它的反义RNA相互作用。证明RALY是EMS的交互合作伙伴,RALY-EMS的相互作用,RALY与EMS直接相互作用,但不与它的反义RNA相互作用。与野生型EMS相比,缺失22个尿苷的突变EMS(EMS-ΔpolyU)显示出与RALY的结合减少,证明RALY是EMS的交互合作伙伴。综上所述,这些数据表明EMS与RALY合作以促进E2F1 mRNA的稳定性。
5. EMS通过RALY调节肿瘤细胞的生长
评估EMS是否通过RALY调节肿瘤细胞的生长。RALY的敲除作用大大降低,而RALY的过表达则显着增加,细胞增殖,Edu阳性细胞数量和锚定依赖性细胞生长。EMS通过RALY促进了肿瘤细胞的生长。EMS敲除对细胞增殖的抑制作用包括:异位表达的RALY可以大大逆转Edu阳性细胞的数量,以及与锚定无关的细胞的生长。接下来,证明 EMS的异位表达显示可加速G1 / S细胞周期的敲低细胞。此外,EMS敲低抑制的G1 / S细胞周期进程被RALY过表达显着逆转。这些数据表明EMS通过RALY调节肿瘤细胞的生长。
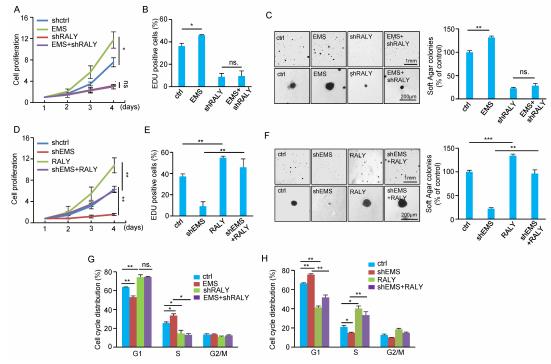
6. EMS将c-Myc连接到细胞周期控制和肿瘤发生
通过实验数据表明c-Myc 通过促进EMS介导的E2F1 mRNA稳定来调节E2F1表达。c-Myc的异位表达增强了细胞增殖,并增加了对照细胞中的正向阳性细胞的数量。细胞周期分布的分析表明,c-Myc加速的G1 / S细胞周期进程可以通过同时进行的EMS抑制来逆转。这些数据表明,c-Myc可通过促进EMS介导的G1 / S细胞周期进程来增加肿瘤细胞的生长。通过进行软琼脂菌落形成试验,显示c-Myc的异位表达仅能促进对照细胞中锚定非依赖性细胞的生长,而不能促进EMS抑制细胞的生长。通过使用异种移植小鼠模型,A549细胞中异位表达的c-Myc有望显着提高异种移植肿瘤的生长。表明c-Myc可能通过EMS促进了肿瘤的生长。通过EMS抑制可将c-Myc对异种移植瘤生长的促进作用最小化。综上所述,这些数据表明,EMS通过调节E2F1 mRNA的稳定性将c-Myc连接到细胞周期控制和肿瘤发生。
总结 :
作为最重要的癌基因之一,c-Myc在一半以上的人类癌症中被激活。 c-Myc的致癌功能很大程度上归因于其作为主要转录因子的内在本质。长非编码RNA(lncRNA)的失调与多种人类疾病有关,包括癌症。 然而,lncRNA在调节c-Myc致癌活性中的功能中具有重要作用。作者发现作为c-Myc的转录靶标,lncRNA E2F1信使RNA(mRNA)稳定因子通过调节E2F1 mRNA的稳定性来调节c-Myc功能。这项研究提供了有关c-Myc促进肿瘤发生机制的见解。






