m6A甲基化与肥胖治疗
m6A在脂肪发生过程中起着重要作用。然而,其机制在很大程度上仍不清楚。在这里,小编与大家分享一篇近期发表于AUTOPHAGY的文章“m6A mRNA methylation controls autophagy and adipogenesis by targeting Atg5 and Atg7”。我们证明了m6A通过靶向Atg5和Atg7在调控自噬和脂肪生成方面发挥着关键作用。机制上,众所周知的m6A去甲基酶FTO的下调降低了ATG5和ATG7的表达,导致自噬体形成的衰减,从而抑制了自噬和脂肪生成。

结果:
1.FTO促进自噬,进一步促进脂肪生成
为了探索FTO在自噬中的作用,我们首先对3T3-L1细胞进行了功能缺失的研究。western blot实验表明,与对照细胞相比,FTO沉默显著降低了LC3-II:I比值,增加了SQSTM1水平,表明自噬体形成缺乏稳态(图1A)。相反,HA标记的FTO过表达显著提高了LC3-II:I比值,减少了SQSTM1表达,表明FTO与自噬呈正相关。此外,免疫荧光检测显示,HA-FTO过表达后形成较多的LC3小点(图1B,C)。我们用透射电镜分析了脂肪形成过程中自噬体的形成。发现FTO的沉默降低了自噬体的数量,表明自噬的激活程度降低。相反,FTO的过表达增加了细胞内自噬体的数量(图1D,E)。为了确定自噬是否受FTO过表达的影响,对照组和过表达的细胞分别使用或不使用其他自噬抑制剂治疗。这进一步证实FTO促进自噬激活(图1F,G)。
为了探讨FTO是否通过自噬途径影响脂肪生成,在脂肪生成过程中,对照组和FTO过表达的3T3-L1和猪前脂肪细胞分别使用或不使用自噬抑制剂。我们观察到3-MA和 Baf A1治疗可以逆转增强的自噬,脂肪形成和FTO过表达细胞的甘油三酯积累(图1H-J)。与表型一致,脂肪细胞标记的mRNA和蛋白水平包括Pparg,Fabp4和Cebpa在FTO过表达细胞明显升高,通过3-MA或Baf A1处理可将FTO下调至正常水平(图1K,L)。这些结果表明FTO通过促进自噬促进脂肪细胞分化。
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\C~E}$Z6IVFPHB]HN~XB9]_G.png](https://img1.dxycdn.com/2019/1218/729/3385790418905225844-14.jpg)
2.FTO的下调降低了ATG5和ATG7的表达,但没有降低ULK1的表达
为了确定自噬中FTO的潜在靶基因,我们首先利用qPCR分析比较FTO敲低后自噬相关基因的mRNA表达情况。结果显示,在FTO敲除后,Atg5和Atg7的mRNA水平显著降低,而Ulk1没有变化(图2A)。另外,FTO的下调显著下调了ATG5和ATG7蛋白水平。相反,我们发现ULK1和其他自噬相关蛋白,如ATG12和ATG16L1,并没有发生显著的变化(图2B)。此外,我们检测了ATG5和ATG7在脂肪细胞分化过程中的表达谱,发现他们两个都在早期增加,然后下降(图2C)。这些数据表明,Atg5和Atg7可能是FTO的靶基因。
为了检测ATG5和ATG7对自噬和脂肪生成的影响,我们分别用ATG5和ATG7 siRNA处理3T3-L1前脂肪细胞,并使用western blot检测其敲除效率。结果表明,LC3II:I的比值在ATG5和ATG7基因敲除后下降,FTO蛋白表达未发生变化(图2D,E),这与FTO与ATG5、ATG7的上游下游关系一致。此外,我们发现,与对照组相比,FTO、ATG5和ATG7的缺失均显著抑制脂肪生成和甘油三酯积累(图2F-H)。而且FTO、ATG5或ATG7敲低均下调了脂肪细胞标记基因的表达水平(图2I,J)。这些结果表明ATG5和ATG7对3T3-L1前脂肪细胞的自噬和脂肪生成具有重要的功能。因此,我们将重点放在这两个FTO的潜在目标Atg5和Atg7上进行进一步的研究。
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\3ZVT_I]PXVIA~EN`213MYY8.png](https://img1.dxycdn.com/2019/1218/698/3385790446822779240-14.jpg)
3.FTO通过靶向ATG5和ATG7影响自噬和脂肪生成
为了证实FTO是否通过影响ATG5和ATG7的表达而影响自噬和脂肪生成,我们首先验证了FTO的过表达显著提高了ATG5和ATG7的mRNA水平(图3A)。接下来,我们进行了抢救实验,观察到沉默ATG5可以逆转FTO过表达3T3-L1细胞中上调的LC3-II:I比值(图3B)。与ATG5相似,ATG7缺失也恢复了扩增的LC3-II:I比值(图3C),表明FTO通过调控ATG5和ATG7表达影响自噬。已有研究报道,ATG5和ATG7在前脂肪细胞中的下调通过抑制PPARG和CEBPA的表达,抑制自噬,降低CEBPB的水平,阻碍脂肪分化计划的启动。这增加了FTO通过Atg5和Atg7-Cebpb信号调控脂肪生成的可能性。如我们所料,我们发现FTO的强制表达促进了CEBPB蛋白的表达,而ATG5和ATG7的缺失则逆转了CEBPB的表达(图3D)。此外,敲低ATG5 和ATG7可恢复FTO过表达促进的3T3-L1细胞的脂肪生成和甘油三酯积累(图3 E-G)。FTO过表达细胞中Pparg、Fabp4和Cebpa 的表达水平的升高也被逆转(图3H,I)。总的来说,FTO通过介导Atg5和Atg7-Cebpb信号轴促进脂肪生成。
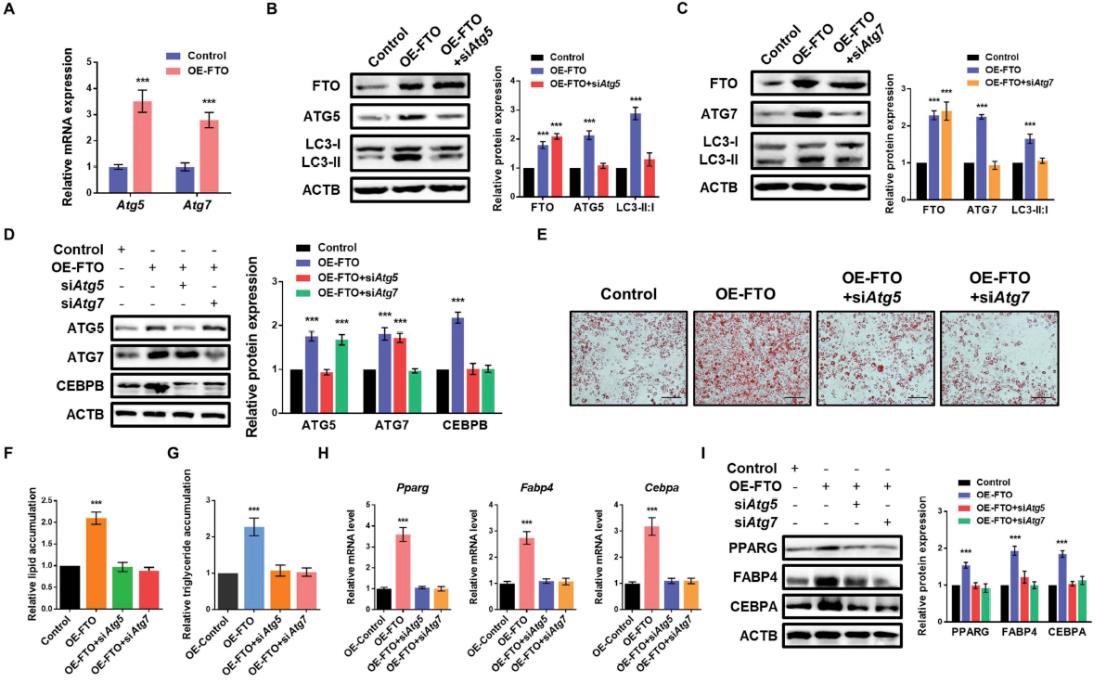
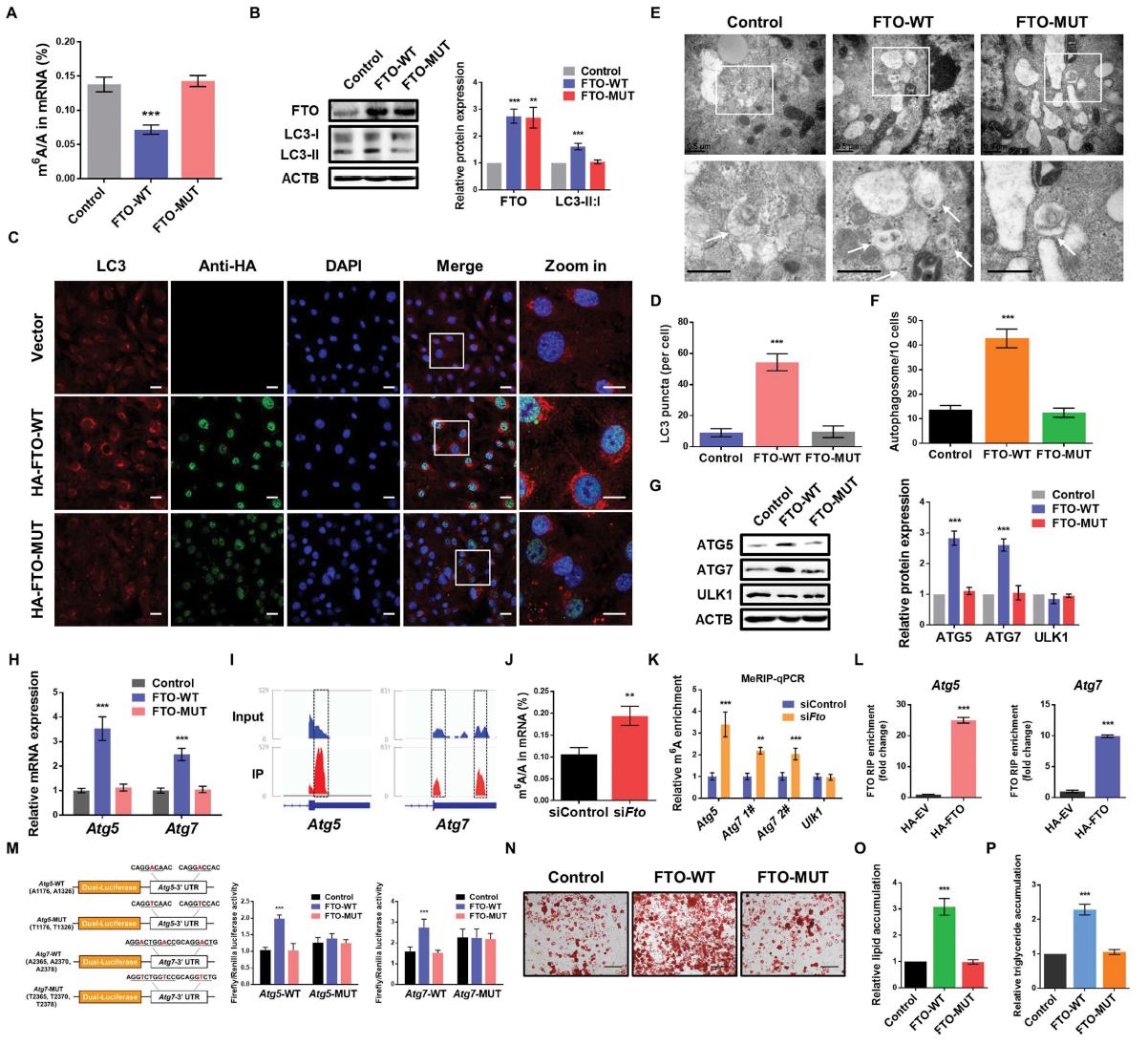
4.FTO以m6A依赖的方式调控ATG5和ATG7表达
为了进一步阐明FTO在自噬调控中的潜在分子机制,我们构建了野生型(FTO- wt)和催化突变体FTOR96Q (FTO- mut)质粒,以确定是否需要FTO的去甲基酶活性。液相色谱串联质谱证实FTO-WT或FTO-MUT异位表达对细胞m6A水平的影响(图4A)。体外表达的FTO-WT显著增加了3T3-L1和猪脂肪细胞的LC3-II:I比值(图4B),这意味着FTO以去甲基化酶活性依赖的方式调节自噬。一致的是,表达FTO-WT的细胞在免疫荧光检测中显示LC3斑点显著增强(图4C,D)。此外,与FTO-MUT或空载体相比,FTO-WT的异位表达增加了自噬体的数量(图4E,F)。这些结果表明,FTO的去甲基化活性是前脂肪细胞自噬所必需的。接下来,我们研究了FTO是否通过去甲基化影响ATG5和ATG7的表达。与FTO-MUT或空载体相比,体外表达的FTO-WT增加了ATG5和ATG7的蛋白和mRNA水平(图4G)。另外,在Atg5和Atg7的3’UTR处发现m6A修饰(图4I)。我们发现,通过敲低FTO可以增加3T3-L1和猪前脂肪细胞的m6A水平(图4J)。此外,MeRIP-qPCR检测显示,FTO敲除显著提高了Atg5和Atg7 mRNA转录本的m6A水平(图4K)。我们用RIP-qPCR,观察到Atg5和Atg7分别与3T3-L1中HA标记的FTO和猪前脂肪细胞中FLAG标记的FTO相互作用,提示Atg5和Atg7是FTO的直接靶点(图4L)。更重要的是,为了评估m6A对靶标mRNA的修饰是否对FTO介导的基因调控是必要的,我们对3T3-L1细胞进行了双荧光素酶报告基因和诱变实验。FTO-WT的强制表达显著促进了Atg5和Atg7的野生型3’UTR片段的活性(图4M)。当m6A位点发生突变时,这种增加被消除,说明FTO通过m6A依赖方式调控ATG5和ATG7的表达。此外,染色分析显示,FTO- WT促进脂肪细胞分化和甘油三酯积累(图4N,P),证实FTO的去甲基化活性是脂肪生成所必需的。
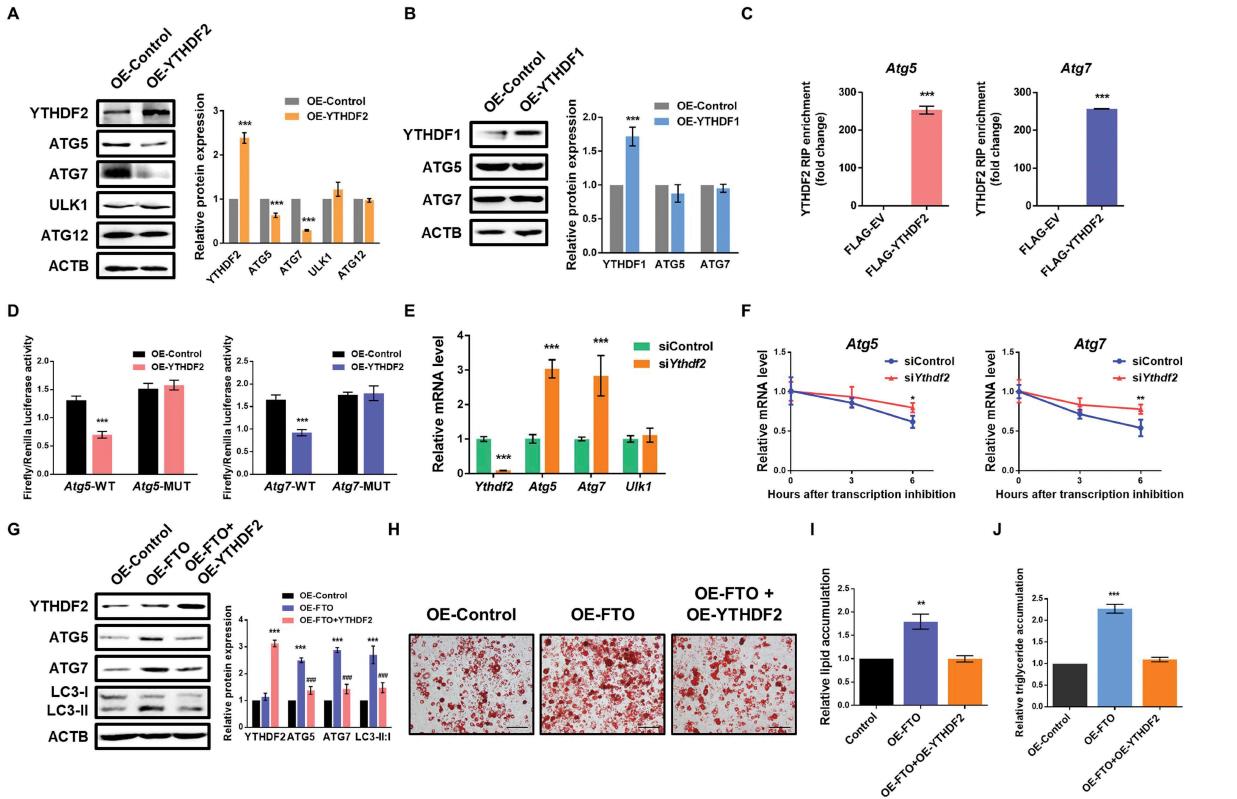
5.YTHDF2通过m6A依赖机制介导ATG5和ATG7的稳定性和表达
为了进一步解释m6A甲基化与FTO靶基因蛋白丰度之间的负相关关系,我们首先研究了ATG5和ATG7的表达是否受到YTHDF2或YTHDF1的影响。与对照组相比,YTHDF2的过表达显著降低了ATG5和ATG7蛋白水平(图5A)。而YTHDF1的强制表达对ATG5和ATG7的表达无影响(图5B),说明ATG5和ATG7是YTHDF2的靶点。另外,通过RIP-qPCR检测,我们进一步证实了Atg5和Atg7在3T3-L1和猪前脂肪细胞中都与标记为FLAG的YTHDF2相互作用(图5C)。接下来,我们测试了Atg5和Atg7 mRNA上的m6A修饰是否对YTHDF2介导的基因调控至关重要。双荧光素酶检测显示异位YTHDF2显著下调携带野生型Atg5和Atg7片段的荧光素酶活性(图5D)。为了研究YTHDF2是否通过介导mRNA的衰减来控制Atg5和Atg7的表达,我们对3T3-L1细胞进行了功能缺失研究。与对照细胞相比,YTHDF2的敲低提高了Atg5和Atg7的mRNA水平(图5E)。mRNA稳定性分析显示,YTHDF2的缺失延长了Atg5和Atg7 mRNA转录本的半衰期(图5F)。此外,通过强制表达YTHDF2,可以部分逆转FTO过表达3T3-L1时ATG5和ATG7蛋白水平的升高(图5G)。YTHDF2过表达也部分逆转了FTO过表达细胞中LC3-II:I比值的升高。此外,异位表达YTHDF2可以逆转FTO过表达导致的脂肪生成和甘油三酯积累(图5H-J)。
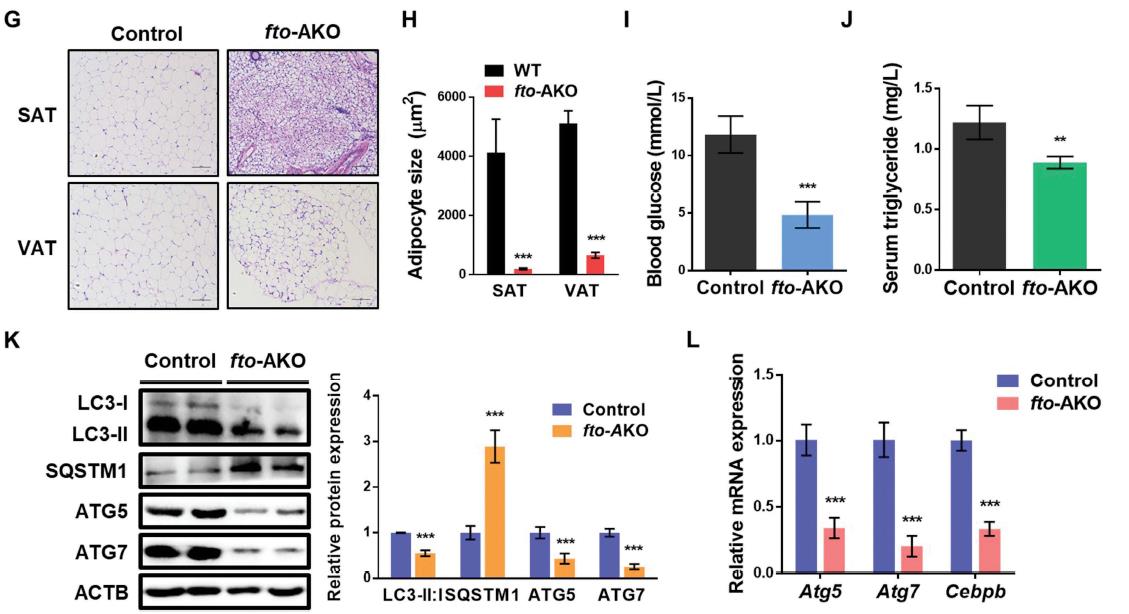
6.FTO可降低小鼠白色脂肪量,抑制ATG5和ATG7依赖的自噬
为了研究FTO在体内脂肪组织中的作用,我们将Ftoflox/flox小鼠与Fabp4-Cre小鼠杂交,建立了脂肪选择性FTO敲除小鼠(FTO-ako)模型。FTO-ako小鼠的白色脂肪组织中FTO的表达被有效地删除(图6A)。与胎鼠对照小鼠相比,fto-AKO小鼠不受普通饲料或高脂饮食(HFD)诱导的体重增加的影响,而两组之间的食物摄入量没有显著差异(图6B,C)。与对照组小鼠相比,fto-AKO小鼠取食普通食物和高脂饮食上都明显变瘦(图6D)。另外,fto-AKO小鼠的腹股沟脂肪和性腺脂肪垫的质量分别显著低于对照组小鼠(图6E,F)。haematine和伊红染色显示,取食HFD的小鼠脂肪细胞具有典型的结构,几乎整个细胞被一个大的脂滴所占据(图6G,H)。相反,FTO缺乏会导致多腔和较小的脂肪细胞。此外,喂食HFD的fto-AKO小鼠的血糖水平和血清甘油三酯水平明显低于对照组小鼠(图6I,J)。为了研究FTO是否影响体内自噬,我们首先检测了对照组和FTO-ako小鼠WAT中LC3-II:I和SQSTM1的表达水平。有趣的是,脂肪选择性缺失的Fto显著减弱了LC3-II:I比值,增加SQSTM1蛋白丰度(图6K)。与体外研究一致,FTO缺乏减少ATG5和ATG7的蛋白和基因表达(图6K,L)。综上所述,这些结果表明,脂肪细胞选择性敲除fto可以降低WAT的量,并抑制ATG5和ATG7依赖的小鼠自噬。
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\1G$O`}K8INK]44UD}}}EA0P.png](https://img1.dxycdn.com/2019/1218/215/3385790642243794769-14.jpg)
总结:
我们的研究表明,FTO在m6A-YTHDF2依赖机制中,在促进自噬和脂肪生成方面发挥着重要作用。我们的研究强调了m6A甲基化机制在自噬中的功能的重要性。这些发现为FTO和m6A修饰调节自噬和脂肪生成的分子机制,以及预防和治疗肥胖的治疗策略的发展提供了深入的了解。






