外泌体和MYC在急性髓性白血病治疗抵抗中的作用
导语:
急性髓细胞性白血病(AML)是由白细胞,红细胞或血小板的异常产生引起的。白血病细胞通过直径为30-100 nm的纳米囊泡外泌体与其微环境进行通讯。外泌体通过充当肿瘤细胞和微环境之间的信使以及诱导致癌因子(例如c-Myc)来支持白血病的生长。GSK-3是一种丝氨酸/苏氨酸蛋白激酶,PP2A激活药物(PADs)可有效拮抗白血病的发生。作者总结了外泌体,激酶抑制剂和磷酸酶激活剂的发现为白血病患者提供了新的希望。
技术路线:
研究结果:
1 AML中的耐药机制。
外泌体是直径为30–100nm的纳米囊泡。外泌体运输各种各样的成分,包括信使RNA,微小RNA(miRNA),长非编码RNA,蛋白质,分子伴侣,胆固醇,鞘磷脂,神经酰胺,磷脂酰丝氨酸,四跨膜蛋白和Fas配体。通过使用多种标记物(例如ALIX,CD63,CD81,CD9,syndecan-1,肿瘤易感性基因101(TSG 101),主要组织相容性复合物(MHC)分子和热休克蛋白70( HSP 70)。AML衍生的外泌体在患者来源的异种移植小鼠模型中介导的免疫抑制。已知白血病来源的外泌体可诱导调节性T细胞(Tregs)和巨噬细胞极化。还已知外泌体会干扰免疫细胞的细胞分化。外泌体可以抑制DC从前体细胞分化。外泌体也可以触发产生TGFβ的MSC的发展。Fas阳性外泌体可通过与Fas-配体结合而触发T细胞死亡。
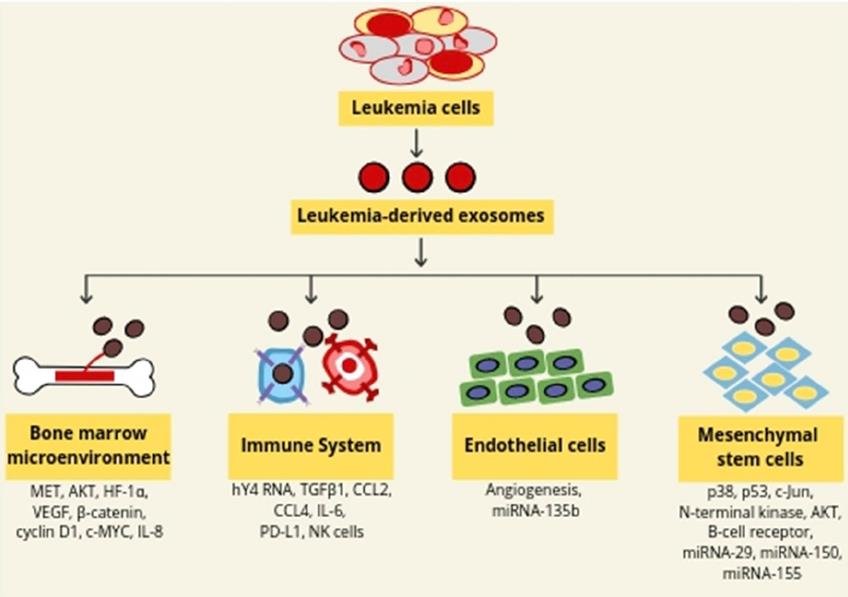
2.外泌体和白血病进展。
癌症来源的外泌体维持肿瘤微环境并介导与肿瘤细胞的侵袭性和耐药性相关的几种信号转导途径。外泌体的改变可能导致人类白血病恶变。AML细胞的外泌体运输改变了共培养的基质和造血祖细胞系的增殖,迁移和血管生成反应。外泌体还可以通过调节CXCR4–CXCL12信号传导来促进白血病的生长。癌症外泌体可以像肿瘤发生模型一样改变骨髓微环境。 MET是肝细胞生长因子受体或酪氨酸激酶受体,外泌体介导的MET从肿瘤细胞转运至骨髓祖细胞,黑色素瘤来源的外泌体在制造肿瘤中至关重要。源自外泌体的B细胞慢性淋巴细胞性白血病(B-CLL)患者可以激活CLL-BMSCs中的AKT / m-TOR / p70S6K /HIF-1α轴。外泌体还调节β-catenin途径并增强骨髓间充质干细胞(BMSC)中c-MYC和cyclin D1的表达。CLL外泌体可以使骨髓微环境重塑为恶性进展。CML细胞分泌的外泌体可以刺激人BMSC产生IL-8,从而提高白血病细胞的生长和存活率,维持恶性表型需要CML-BMSC串扰。外泌体可以通过将遗传信息从恶性细胞转移到正常的造血细胞来诱导恶性表型。
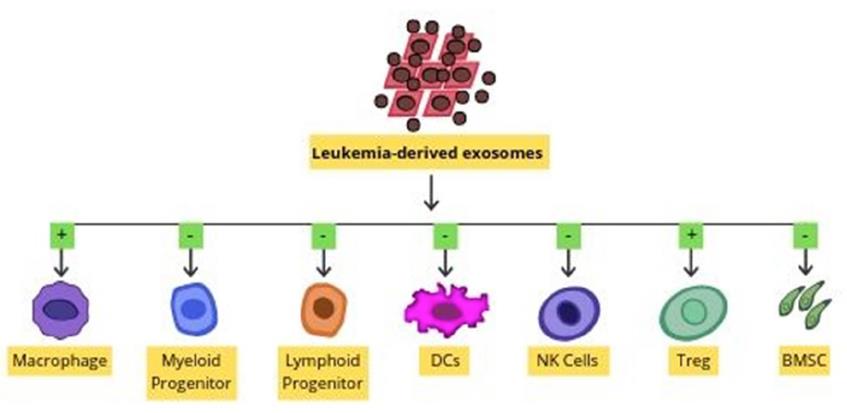
多发性骨髓瘤骨髓间充质基质细胞(MM BM-MSC)衍生的外泌体可以转移至MM细胞。这导致体内肿瘤的调节增长。MM BM-MSC的外泌体增强了肿瘤的生长,而正常BM-MSC的外泌体则抑制了肿瘤的生长。还报道了外泌体与AML发病机制有关。提供了关于转移的RNA的规范功能的证据。 AML外泌体也可调节骨髓功能,AML外泌体通过基质成分直接或间接诱导白血病的骨髓侵袭。 AML衍生的外泌体可以抑制造血干细胞和祖细胞(HSPC)的功能。这是通过利基保留因子的基质重编程介导的。 AML外泌体定向的miRNA转运至HSPC也可能导致造血功能的系统性丧失。AML衍生的外泌体通过调节多个分子(例如Rab27a,DKK1,CXCL12,KITL和IGF1)将骨髓小生境转变为白血病允许的环境。 AML衍生的循环外泌体也可以将免疫抑制货物递送至受体细胞,从而抑制抗肿瘤活性。

3.白血病来源的外泌体可以改变内皮细胞的功能。
白血病细胞通过将外泌体miRNA转移到内皮细胞中来促进血管生成。将K562细胞与人脐静脉内皮细胞(HUVEC)共培养。miR-17-92的水平在K562细胞中较高,而在HUVEC中则显着较低, K562细胞通过外泌体将miRNA转移到HUVEC中。还观察到miR-92a K562细胞转移到HUVEC中。用Cy3标记的pre-miR-92a转染后,在HUVEC细胞中未观察到Cy3-miR-92a信号。此外,GW4869通过抑制神经酰胺的生物合成抑制了外泌体miRNA的分泌。此外,在内皮细胞中,miRNA135b标记的外泌体与抑制缺氧诱导因子1(FIH-1)的因子相互作用。在缺氧条件下基质细胞被CLL衍生的外泌体促进了增殖和炎性细胞因子的分泌,增强了内皮细胞中的血管生成特性。总之,白血病来源的外泌体将miRNA转移到内皮细胞和基质细胞中,导致血管生成增加。LAMA 84 CML细胞衍生的外泌体修饰了HUVECs中的肾小管分化,β-catenin和E-cadherin的丢失,增加细胞运动。 CML外泌体诱导的鼠内皮细胞生长和Matrigel栓塞血管形成与HUVEC中的src活化有关。酪氨酸激酶抑制剂消除了白血病的外泌体作用。强调白血病细胞衍生的外泌体直接影响内皮细胞并调节新血管形成。
4.外泌体和耐药性。
BMSC外泌体可防止药物介导的细胞凋亡,并诱导对硼替佐米的耐药。BMSC衍生的外泌体显着调节MM细胞中的c-Jun,p53,p38,AKT和N端激酶。源自BMSC的外泌体可以调节肿瘤的生长,血管生成,并抑制抗肿瘤NK细胞免疫的诱导。来自CLL血浆的外泌体包含与疾病结果降低相关的miRNA。外泌体miRNA150和miRNA155可以随着B细胞受体(BCR)的激活而增加。依鲁替尼使BCR失活大大降低了CLL患者血浆中的外泌体水平。可以得出结论,白血病来源的外泌体是耐药性的重要组成部分,并且是疾病负担的指标。
5.外泌体可以用作AML诊断的生物标志物。
负责运输的内体分选复合体(ESCRT)在调节生物学过程(例如细胞脱落,MVB生物发生和病毒出芽)中起着主导作用。在将囊泡内容物运输至溶酶体以进行降解中也需要它。可溶性NSF附着蛋白受体(SNARE)是靶细胞中外泌体释放过程中必需的分子成分。在合成的各个阶段中,存在于不同内体上的特定膜轮廓分子类似于其亲本细胞特征。因此,外泌体可用作推定的非侵入性生物标记。因为外泌体是从体液中提取的,所以它们的分子可以预测一个人的病理生理状态。
6.微环境不仅在白血病的发作中而且在白血病的进展中都是必不可少的。
移植研究表明该疾病起源于微环境。 Dicer1缺陷的小鼠骨祖细胞发展为骨髓增生异常,最终发展为AML。小鼠成骨细胞中的β-catenin活化突变可导致白血病。此外,成骨细胞中活化的β-连环蛋白刺激Notch配体锯齿状1表达。已经报道造血干细胞(HSCs)生态位的改变支持疾病的进展。 白血病干细胞(LSC)限于具有长期造血干细胞(LTHSC)表型的细胞。骨髓增生性肿瘤(MPN)逐步重塑了白血病小环境,有利于骨髓纤维化和白血病干细胞功能。肿瘤微环境的变化可能有助于白血病细胞抵抗抗白血病药物。生态位的基质细胞可为AML,ALL和CLL提供保护环境。基质细胞可通过释放抗凋亡因子减轻白血病细胞的凋亡。白血病细胞的存活取决于抗原与骨髓微环境的直接接触。内皮细胞的微环境也支持白血病细胞的增殖和存活。靶向白血病细胞和内皮细胞微环境之间的通讯或抑制微环境的改变对于白血病治疗可能是一种有吸引力的方法。外泌体与白血病微环境的相互作用有助于白血病细胞入侵免疫系统。
7.cMyc及其调节剂在耐药中的作用。
原癌基因c-Myc可维持增殖,分化,凋亡和细胞周期。 c-Myc调节对于维持健康细胞的细胞增殖至关重要。 c-Myc的表达降低在白血病中起重要作用。在大多数人类造血恶性肿瘤中观察到c-Myc的过度表达。 c-Myc在AML细胞的白血病发生诱导中起重要作用。 c-Myc在许多人类造血恶性肿瘤中的表达与不良预后相关。癌基因如PLZF-RARA,PML-RARA和AML1-ETO促进了髓样白血病的发生。
8.糖原合酶激酶3(GSK-3)是自然界普遍存在的丝氨酸/苏氨酸激酶。
有两种亚型存在,即GSK-3α和GSK-3β。该激酶调节多种细胞过程,例如信号转导和基因表达,并可以决定细胞命运。 GSK-3在多种人类疾病(包括神经系统疾病,2型糖尿病,中风和肿瘤)中起着至关重要的作用。 GSK-3与几乎40种与癌症发病相关的底物发生反应。 GSK-3β是重要的肿瘤抑制因子,可将磷酸基团引入促癌分子。肿瘤促进途径激活β-连环蛋白并稳定c-Myc蛋白以促进肿瘤发生。GSK-3的药理抑制作用可降低白血病细胞的细胞周期进程,增殖并增加其髓系分化,后者转化为嵌合MLL癌蛋白。在正常的造血过程中,HOX基因在造血干细胞和祖细胞中持续表达。 MLL融合蛋白会显着影响HOX的异常表达,而MEIS1会枚举HOX的异常表达以维持白血病细胞的转化。
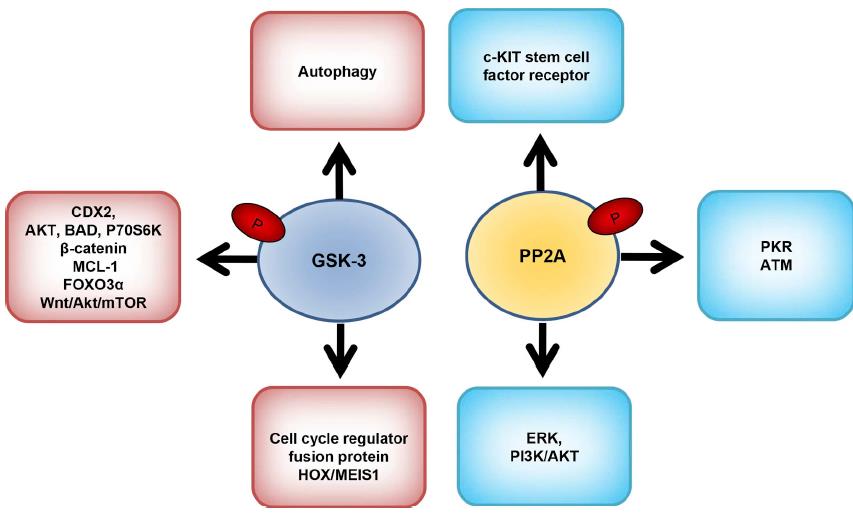
9.蛋白磷酸酶2A(PP2A)是一种以二聚体和三聚体形式存在的Ser / Thr磷酸酶。
它起着抑癌作用,并逆转大多数激酶驱动的细胞内信号转导。在固体和血液系统恶性肿瘤中,这种磷酸酶的活性被显着抑制。PP2A活性的降低通常与存活率的提高和凋亡的抑制有关。 PP2A-Aα和PP2A-Aβ亚基的结构突变导致B和C亚基的结合受损。这会抑制PP2A活性并促进细胞转化。在大多数AML患者中,通常会观察到Aβ亚基的下调。 c-KIT是干细胞因子受体或酪氨酸激酶的一种,存在于与干细胞因子结合的细胞表面。 c-KIT中的突变导致AML患者的支架蛋白表达改变和调节亚基改变。 c-KIT促进分化,存活和增殖。致癌性c-KIT中的突变通过降低PR55α,PR61α,PR61γ,PR61δ和PR65α的蛋白质水平来抑制PP2A活性。可以通过恢复c-KIT + AML患者的PP2A活性来逆转耐药性。促进PR55α和AKT失活的策略可能是AML治疗的潜在途径。
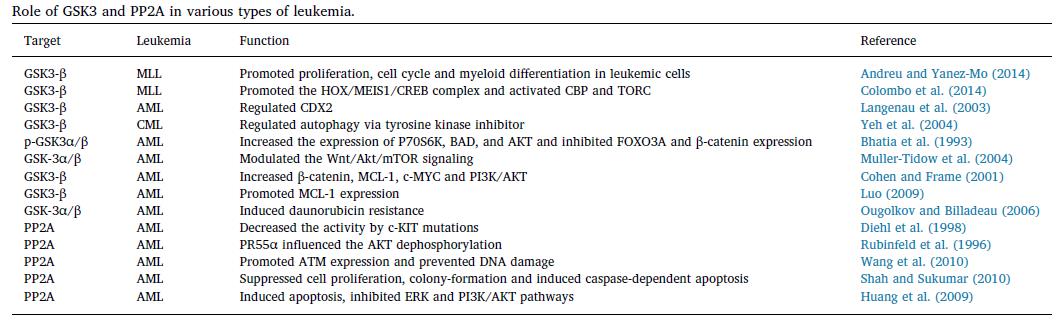
10. 基于GSK3和PP2A的药物可用于白血病细胞的化学增敏。
但许多免疫学障碍阻碍了白血病的治疗。GSK3抑制剂调节可能影响白血病发生的多种途径,例如存活率,化疗耐药性,白血病干细胞生长和CML细胞自噬。GSK-3β还可作为HSCs分子标记缺失后疾病进展和MDS患者生存的预后标志物。GSK-3α和GSK-3β相关途径可帮助转化为MDS和随后的AML。这为潜在的治疗靶标。FGF / Ras / ERK和Wnt通路参与了AML患者对AC220的耐药性发展。MCL-1是AML细胞中GSK的关键靶标。 GSK-3的药理抑制或基因敲低可以防止MCL-1减少。临床前研究还证明了AML,ALL和CML中GSK3抑制剂的前景。在体外和体内白血病模型中,6-溴二氮卓比30肟(BIO)已显示出疗效。 GS-87是GSK3的特异性抑制剂,可在AML细胞中诱导分化。AML患者中GSK3抑制剂LY2090314的功效。在患者中观察到GSK-3抑制。因此,与其他药物联合使用时,该药物可能会产生潜在的益处。
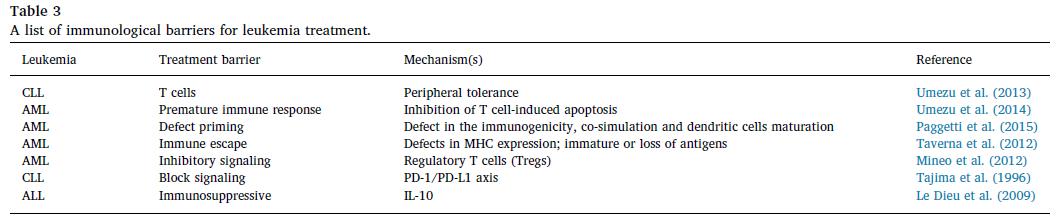
总结:
外泌体对白血病相关的恶性肿瘤的治疗潜力已通过许多研究证明。 MSC衍生的外泌体可以强迫患者的外周血单核细胞,促炎性细胞因子反应和改善的临床移植物抗宿主病症状得到缓解。外泌体能有效地将药物,miRNA和抗原递送到靶细胞中血液系统恶性肿瘤。含有siRNA的外泌体也可以穿过血脑屏障。外泌体的这一特性可用于治疗对化学疗法反应较差的中枢神经系统相关的白血病。正在开发一些方法,以选择性地沉默外泌体传递的信息,从而促进癌症的发展。从以上内容可知,白血病骨髓和外泌体介导的信号传导有助于白血病的进展。外泌体是调节受体细胞中白血病发展的重要信使。恶性白血病细胞还可以通过外泌体的介导发展抗药性机制。另一方面,正常造血或组织细胞分泌的外泌体介导抗肿瘤反应。外泌体已成为血液恶性肿瘤的敏感,特异和非侵入性生物标志物。由GSK-3抑制剂的脱靶活性引起的不良反应是通过与ATP竞争性结合位点结合的药物获得的。 PP2A抑癌活性的药理学恢复可有效拮抗白血病的发生。更多研究应在临床上检查基于GSK-3和PP2A的药物的疗效。需要新的方法来降低GSK-3和PP2A抑制剂对AML患者的不利影响。






