外泌体PD-L1在肿瘤发展和免疫治疗中的作用
程序性死亡配体1(PD-L1)是一种I型跨膜蛋白,与其受体PD-1结合,抑制T细胞的活化,从而维持免疫稳态。而肿瘤细胞高表达PD-L1与活化的T细胞上表达的PD-1受体结合则导致免疫逃逸。抗PD-1/PD-L1免疫检查点疗法阻断PD-1/PD-L1的结合以使衰竭的T细胞恢复活力,从而抑制肿瘤生长。外泌体是一种具有生物活性的脂质双层纳米微囊,由不同类型的细胞分泌,介导细胞间的信号传递。大量研究表明,肿瘤细胞能够通过释放外泌体促进肿瘤上皮-间质转化、血管生成和免疫逃逸。最近的研究表明,肿瘤来源的外泌体可以在与细胞表面相同的膜拓扑中携带PD-L1,从而抵抗免疫检查点治疗。
近期,一篇名为“The role of exosomal PD-L1 in tumor progression and immunotherapy”的综述在Molecular Cancer上发表,总结了至今为止对外泌体PD-L1的相关研究成果。
![说明: C:\Users\y505\Desktop\The role of exosomal PD-L1 in tumor progression and immunotherapy\M`G3U)XYB]0]@7~9VT)T6[R.png](https://img1.dxycdn.com/2019/1231/531/3388201808966473085-14.jpg)
在这篇综述中,主要讨论了外泌体在肿瘤进展调控中的作用以及通过外泌体PD-L1进行免疫治疗的潜在耐药机制,并且认为外泌体PD-L1可能有潜力成为克服抗PD-1/PD-L1抗体治疗耐药性的靶点。
一、外泌体在肿瘤进程中的调节作用
1. 外泌体抑制肿瘤进展
在肿瘤微环境中,外泌体可能介导细胞内通讯和免疫调节。肿瘤衍生外泌体(TEXs)和免疫细胞衍生外泌体(IEXs)通过将抗原转移到抗原呈递细胞(APCs),从而激活CD4+T细胞和CD8+T细胞,增强抗肿瘤反应而抑制肿瘤进展,从而激活免疫应答。此外,还描述了另一种涉及诱导肿瘤细胞凋亡的替代作用模式。最新的研究发现,TEXs和IEXs可以作为肿瘤治疗的监测标志物,取代检测T淋巴细胞和进行肿瘤活检。
表一 肿瘤细胞衍生的外泌体在肿瘤进展中的调节作用

表二 免疫细胞衍生的外泌体在肿瘤进展中的调节作用
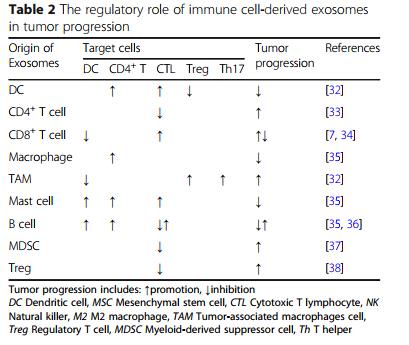
来自间充质干细胞(mesenchymal stem cells,MSCs)的外泌体同样也拥有抑制肿瘤发展的作用。MSC衍生的外泌体对涉及不同免疫细胞(如T细胞和B细胞)的免疫反应具有强大的调节作用。已经证明人脂肪MSC衍生的外泌体通过诱导BAX和CASP3/9的表达,同时降低BCL2的水平,抑制A2780和SKOV-3人卵巢癌细胞的增殖和菌落形成能力;从人脐带MSC衍生的细胞外小泡(EVS)中获得了类似的结果。
2.外泌体促进肿瘤进展
肿瘤的生长与多种生长因子受体和信号传导途径有关。这些受体通过激活或磷酸化细胞内激酶结构域,通过Akt、PKC/PKB和ERK激酶途径触发下游信号通路,从而导致肿瘤细胞的增殖和迁移。
IEXs表达的分子,如FasL和pMHCⅡ,与T细胞相互作用,触发共抑制信号,促进细胞凋亡。TEXs具有与IEXs类似的作用。TEXs中的内容物具有上调髓系细胞PD-L1表达的能力,通过PD-1/PD-L1信号通路抑制T细胞的功能。外泌体MHC I可通过诱导T细胞的第一信号激活来促进这种抑制功能。最近的研究表明,外泌体可以携带PD-L1在其表面,并已被证明在肿瘤的发展中起关键作用。
二、PD-L1表达上调诱导免疫逃逸促进肿瘤发展
1.细胞表达的PD-L1在抑制抗肿瘤免疫反应中的作用
PD-L1在不同类型的癌症和非癌症细胞中表达上调,如巨噬细胞、单核细胞和肿瘤细胞。其受体PD-1主要表达于活化的CD4+和CD8+T细胞、B细胞、单核细胞和MDSCs。肿瘤免疫逃逸的重要机制之一是肿瘤细胞表面表达的PD-L1与T细胞上的PD-1结合,导致免疫检查点反应。在正常情况下,活化的抗原特异性细胞毒性T淋巴细胞可以识别肿瘤细胞并对其产生直接反应。而PD-L1过表达的肿瘤细胞具有特殊的生存能力,逃脱免疫系统的监视,然后侵入邻近组织。最近的研究发现,肿瘤细胞有可能控制PD-L1溶酶体降解的分子机制(HIP1R的耗竭),导致其在细胞内蓄积并诱导免疫耐受。
同时有研究表明,肿瘤微环境中免疫细胞的浸润可能与PD-L1在其表面的呈现有关。在肿瘤缺氧微环境中,MDSCs表面PD-L1表达增加,PD-L1水平的变化可用于评价高氧治疗的疗效。此外,在细胞表面过度表达PD-L1的TAMs可能抑制细胞毒性T淋巴细胞的功能。另一种假设表明,TAM受体Tyro3,AX1和MerTK可以上调乳腺癌细胞系PDL1的表达。此外,干扰素-γ可以促进黑色素瘤细胞释放的外生体上表达的PD-L1水平。
2.外泌体PD-L1参与诱导免疫逃逸以促进肿瘤进展
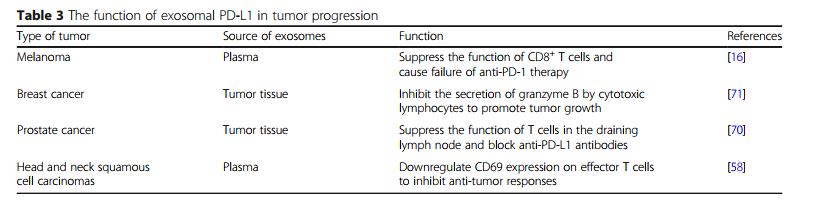
先前的研究证实PD-L1存在于人尿或血浆的外泌体中。流式细胞术和免疫荧光结果表明PD-L1不仅存在于囊泡表面,而且存在于囊泡样结构中。PD-L1可以在Rab27a和nSMase2的帮助下特异性包装成外泌体。敲除肿瘤细胞中的Rab27a和nSMase2会导致分泌部分中PD-L1的丢失。研究人员使用酶联免疫吸附试验发现外源体PD-L1与细胞表面PD-L1具有相同的膜拓扑结构。最近的报道可视地指出,外源体PD-L1可以在体外和体内以剂量依赖的方式转移到有或没有PD-L1表达的其他细胞。尽管髓系细胞上PD-L1的表达在诱导免疫抑制中起关键作用,但目前还没有关于髓系细胞来源的外体型PD-L1的研究报道。
表三 外泌体PD-L1在肿瘤进展中的作用
3.外泌体PD-L1通过直接与抗PD-L1抗体结合介导免疫治疗抗性
肿瘤的免疫治疗大致可以分为两种不同的类型:体细胞免疫治疗和免疫检查点抑制剂治疗。免疫检查点抑制治疗包括抗CTLA-4 mAb、抗PD-1 mAb和抗PD-L1 mAb。一项研究表明,抗PD-1/PD-L1的单克隆抗体在不同类型的癌症患者中显示出显著的疗效,例如非小细胞肺癌(NSCLC)、HNSCC、黑色素瘤、结直肠癌和乳腺癌。然而,一些实体肿瘤,如前列腺癌,已被证明对抗PD-L1疗法具有抗药性。PD-1/PD-L1阻断可以激活T细胞,诸多研究结果证明外泌体PD-L1在抗PD-L1/PD-1治疗中起重要作用。不止外泌体PD-L1, PD-L1剪接变异体也在肿瘤的进展中起着重要的作用。分泌PD-L1剪接变异体患者的细胞能够竞争性地与PD-L1抗体结合,从而导致治疗耐药性。最近的数据表明,肿瘤和调节性T细胞(Treg)衍生的在其表面携带CTLA-4的外泌体可能干扰ipilimumab的免疫治疗。这些结果表明,外泌体上携带的分子可能是患者产生治疗耐药性的一种新机制,并可能成为肿瘤诊断的潜在生物标志物。
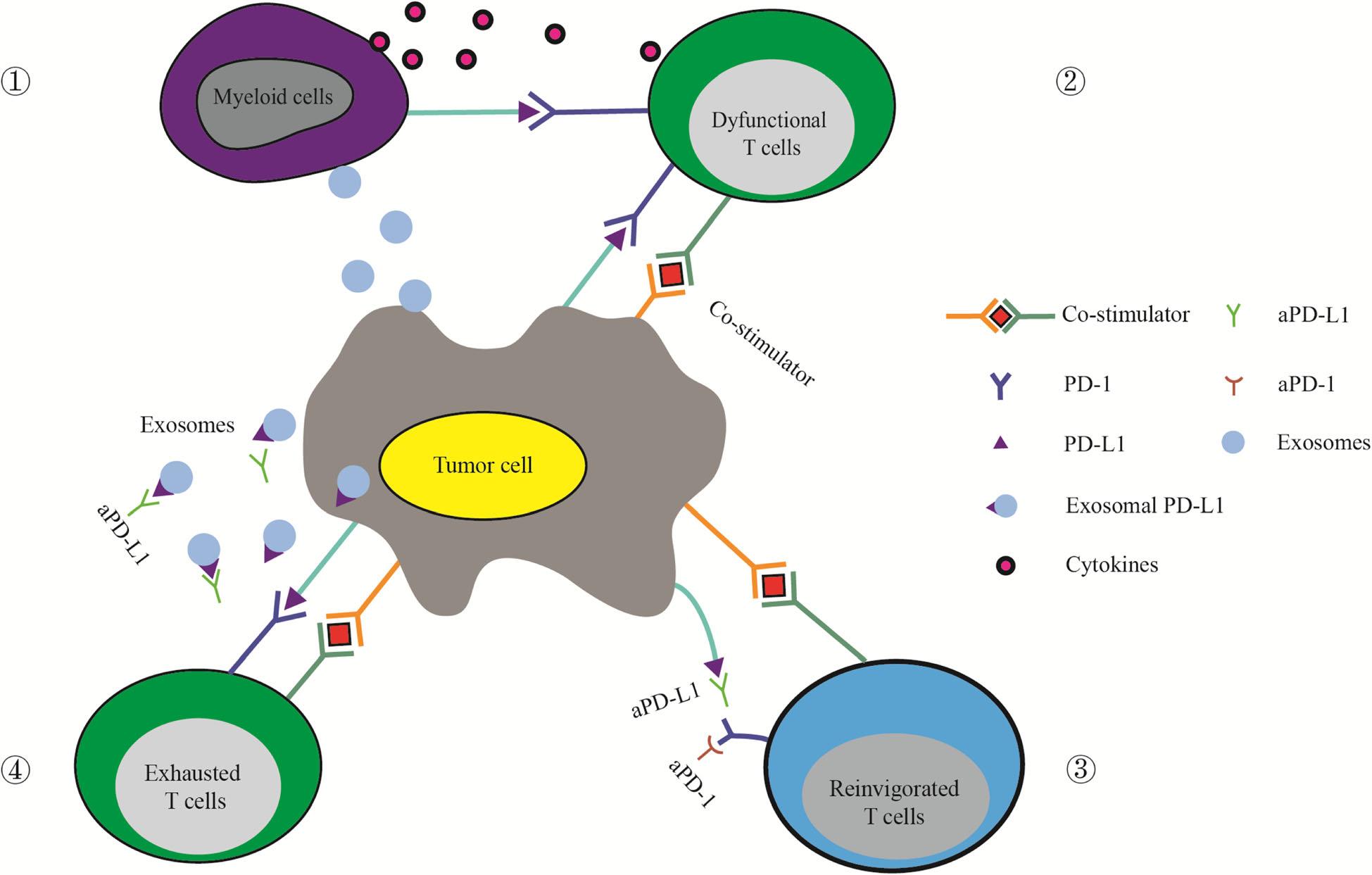
图一 外泌体PD-L1有助于抵抗免疫检查点治疗。(1)肿瘤来源的外泌体上调髓样细胞PD-L1的表达和细胞因子的产生,从而抑制T细胞的功能。(2)肿瘤表面表达的PD-L1直接与T细胞上的PD-1结合,诱导免疫检查点反应。检查点反应可以抑制T细胞的活化,使T细胞功能失调,从而抑制抗肿瘤免疫。(3)免疫检查点治疗可以释放被检查点阻断所限制的T细胞,使免疫应答恢复活力。(4)外体PD-L1在细胞表面具有与PD-L1相同的膜拓扑结构,可抑制T细胞功能,导致免疫检查点治疗失败。
4.外泌体PD-L1可作为肿瘤生物标志物
对外泌体的研究逐渐从将外泌体用作靶向肿瘤细胞的基因工程疫苗转向用作肿瘤诊断标记。在过去的几十年中,许多研究人员致力于在外泌体中寻找生物标记物,以特异性地检测或预测疾病。外泌体可以表达在亲本细胞膜上检测到的各种功能相关分子。头颈癌症或黑色素瘤患者的预后随外泌体PD-L1水平的不同而不同。在接受治疗之前,对抗PD-1抗体有反应的患者外泌体PD-L1水平高于无反应者。在接受治疗后,有反应者的外体PD-L1的倍数变化比无反应者更显着。因此,外体PD-L1可能是临床免疫治疗的生物标志物,用于在治疗前检测患者血液中的PD-L1水平。另一项研究表明,血清中PD-L1+外显体的检测与胰腺导管腺癌患者的不良预后相关。进一步的研究表明,PD-L1+外泌体中包含的miR-21有可能成为区分非小细胞肺癌患者和健康对照之间差异的生物标志物。今后,在抗PD-1/PD-L1免疫检查点治疗的过程中,不仅要考虑细胞表面的PD-L1,还要考虑外泌体的PD-L1。
总结:
总之,肿瘤来源的外泌体和免疫细胞来源的外泌体在肿瘤进展中起着双重作用。外泌体可以抑制肿瘤的生长,但尚不能利用其完全根除肿瘤。将外体PD-L1应用于非侵入性“液体活检”作为癌症生物标志物的研究正在进行。






