高分文章告诉你-外泌体如何促进肿瘤转移
卵巢癌是最常见的妇科恶性肿瘤之一。 初步诊断时,大多数患者在腹膜腔内存在广泛的转移性生长,分阶段发生在宏观肿瘤细胞侵袭之前形成转移前的微环境。转移前微环境的形成支持随后的转移性病变。卵巢癌衍生的外泌体通过免疫抑制,血管生成,基质细胞重塑和致癌重编程诱导转移前的微环境。该文(IF=10.679)强调了卵巢癌外泌体作为转移前微环境形成的协调者,适合液体活检的生物标志物和化疗靶点的新兴作用。

一、外泌体生物发生
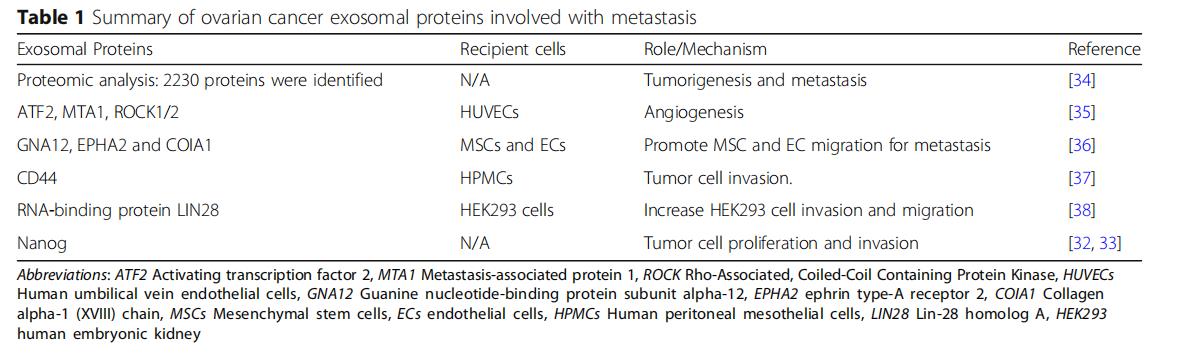
外泌体的性质和丰度由其来源的供体细胞决定,无论是健康组织还是肿瘤。外泌体生物发生涉及一系列细胞事件,最终致癌或生理亚型。供体细胞首先内化细胞外配体和产物以形成早期内体,然后新生外泌体作为腔内囊泡(ILV)出现,最终通过选择性包含蛋白质,核酸和脂质而成熟为多囊泡内体(MVE)。一些MVE在溶酶体内融合并降解以提供细胞形成所需的能量和材料,而其他MVE通过高尔基体再循环或直接细胞分泌释放到细胞外环境中。
二、卵巢癌 - 外泌体
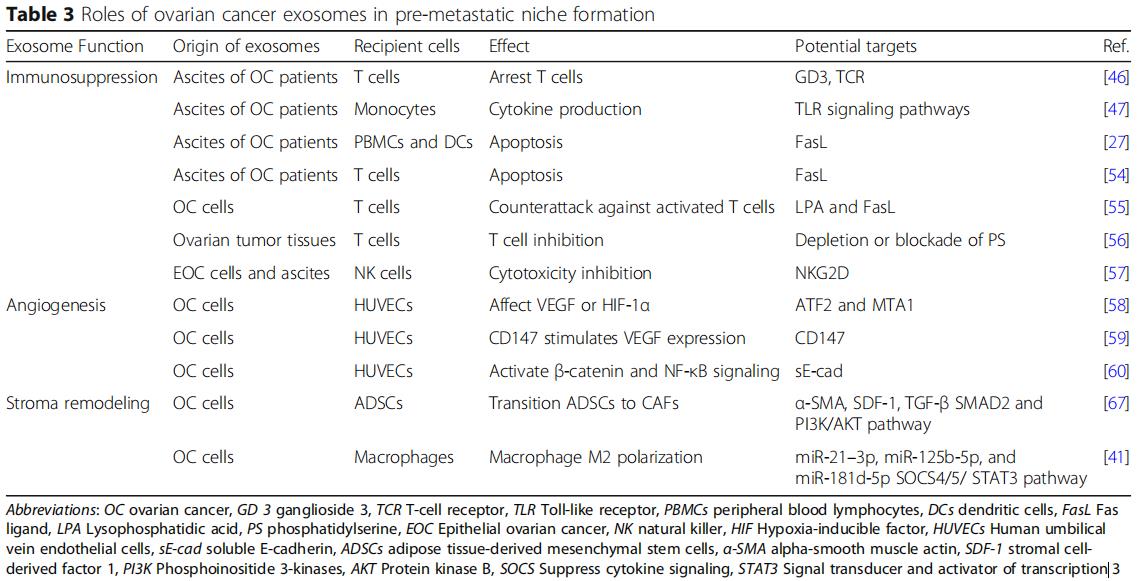
卵巢癌与其他人类肿瘤的区别在于其通过腹水侵入腹腔,使其特别适合于在隔室内涉及各种内脏。从早期开始,腹水包含分离的肿瘤细胞,各种免疫细胞,间皮细胞和肿瘤相关的外泌体。这些外泌体可以从卵巢癌患者的腹水和血清中分离,而且含有独特的卵巢癌特异性蛋白质信号(图1b)。除了揭示潜在的恶性肿瘤外,外泌体蛋白质载体还起到增强卵巢肿瘤转移进展的作用(表1)。例如,Nanog是一种参与肿瘤细胞增殖和癌症干细胞自我更新的转录调节因子。与良性腹膜液相比,从高级别浆液性卵巢癌的腹水中取样的外显子中Nanog表达显着增加,Nanog敲除研究显示卵巢癌细胞的迁移和侵袭减少。
还在外泌体中鉴定了致瘤微小RNA(miRNA),其中它们被包封并保护免受核酸酶降解。在功能上,这些内体外miRNA在局部和全身调节靶细胞的基因表达。一旦脱落,卵巢癌衍生的外泌体将其miRNA水平转运至肿瘤相关巨噬细胞(TAM),间皮细胞和肿瘤细胞本身。它们提供了恶性肿瘤初期转移前微环境形成和转移的说明(表2)。
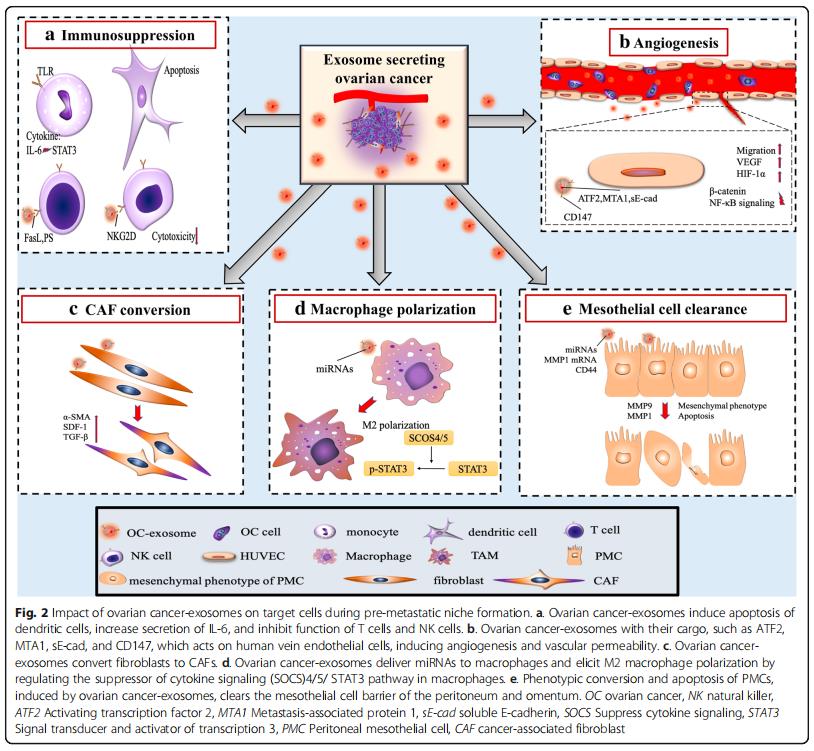
三、外泌体在转移前的微环境内引起免疫抑制
免疫系统是转移的重要障碍,预转移细胞在进入转移部位时保护转移细胞免于凋亡是非常重要的。从卵巢癌腹水中分离的外泌体可以诱导快速和可逆的T细胞停滞。最近的一项研究发现GD3是一种神经节苷脂,一种从腹水分离的外泌体在表面表达,通过作用于T细胞受体(TCR)来阻止T细胞。卵巢癌相关的外泌体还可以通过Toll样受体(TLR)激活诱导单核细胞内IL-6的产生。然后IL-6激活免疫细胞,基质细胞和肿瘤细胞中的信号转导和转录激活因子3(STAT3)途径,其支持癌细胞的整体免疫逃逸(图2a)。
为了揭示外泌体对免疫细胞的直接影响,研究发现卵巢癌患者腹水的外泌体,其具有树突细胞,造血干细胞和外周血淋巴细胞,通过诱导造血干细胞、树突细胞和外周血淋巴细胞的凋亡而引起免疫抑制(图2a),将正常外周血淋巴细胞与来自卵巢癌腹水的外泌体或患有良性卵巢囊肿的患者的腹膜洗液共培养,同时对淋巴细胞进行低基因表达分析。与良性卵巢囊肿组相比,恶性腹水共培养组中26种免疫抑制基因过表达,说明外泌体通过与白细胞的直接相互作用来抑制外周免疫的作用,从而允许未减轻的肿瘤侵袭。天然杀伤(NK)细胞和巨噬细胞的先天免疫细胞是抵抗肿瘤侵袭的有效生理防御,会强烈地募集到转移部位。源自卵巢癌细胞的外泌体可以使肿瘤微环境中的这些免疫细胞沉默,并且在转移前的微环境形成中至关重要。卵巢癌细胞还释放携带外显子的Fas配体(FasL),下调表面T细胞受体/ CD3-zeta(ζ)的表达并促进T细胞凋亡。在细胞水平,溶血磷脂酸提高卵巢癌细胞表面FasL的表达,从而促进FasL携带外泌体的释放。此外,卵巢癌外泌体携带磷脂酰丝氨酸,通过阻断细胞内信号级联来抑制T细胞活化。NK细胞是一种重要的天然免疫效应细胞,能直接识别和杀伤肿瘤细胞。NKG2D受体配体是NK细胞重要的细胞毒受体,也是卵母细胞的靶点。
四、外泌体促进转移前的微环境中的血管生成
卵巢癌外泌体,因促进血管生成而变得非常不成熟(图2b)。在分子水平上,蛋白质组学揭示了激活转录因子2(ATF2)和转移相关蛋白1(MTA1),其存在于卵巢癌外泌体中以上调血管生成。机制上,sE-cad阳性外显子与内皮细胞上的VE-钙粘蛋白结合,促使信号级联最终激活β-连环蛋白和NF-κB;这刺激了内皮细胞迁移和整体血管通透性。尽管它们体积小,但越来越多的研究正在支持卵巢癌衍生的外泌体在培养广泛的腹膜转移的血管生成肿瘤微环境中的作用。
五、基质重塑中的外泌体
从原发性肿瘤转移到次要部位的癌细胞的存活取决于基质微环境,肿瘤衍生的外泌体通过重塑转移部位中的基质细胞来支持肿瘤细胞活力和转移性传播。在功能上,它们重塑转移前细胞中的基质细胞,与转移性微环境中的肿瘤相关巨噬细胞(TAM)相互作用,这些巨噬细胞负责肿瘤生长,侵袭,血管生成和整体转移。
六、外泌体将成纤维细胞转化为CAF
CAF是独特的重编程的基质细胞,在癌症起始细胞外基质重塑、进展、转移前的微环境形成和转移中起作用。单独的卵巢癌衍生的外泌体,足以诱导正常基质成纤维细胞中的表型和功能,改变为致病性CAF(图2c)。外泌体在将正常基质转变为CAF中的作用。卵巢癌过度表达α-平滑肌肌动蛋白(α-SMA),SDF-1和TGF-β将脂肪来源的间充质干细胞转变为CAF,将正常基质重编程为癌基质可以通过在继发性转移生长之前来自外泌体的细胞因子信号传导来介导。
七、外泌体诱导巨噬细胞极化
巨噬细胞是多功能抗原呈递细胞,经典地分为两种极化表型:促炎(M1)和抗炎(M2)。肿瘤相关巨噬细胞(TAM)属于M2亚型并且渗透恶性组织。在肿瘤微环境中,TAMs分泌IL-4,IL-5和IL-6,促进血管生成,基质重塑和免疫系统抑制。它们还通过STAT3信号级联分泌TGF-β,SDF-1和VEGF,从而促进转移前的微环境。在卵巢癌中,缺氧诱导因子(HIF)诱导富含各种miRNA的外泌体的释放,当这些外泌体被未分化的巨噬细胞吞噬时,它们通过细胞因子信号传导抑制因子(SOCS)4/5/STAT3途径进行M2极化(图2d)。与巨噬细胞共培养的卵巢癌细胞只能通过外泌体将其致癌的miR-1246转移到M2巨噬细胞而不能转移到M1巨噬细胞,miR-1246抑制剂和化疗方案联合应用可显着降低体内肿瘤负荷。这些新兴的工作支持了M2亚型在肿瘤发生和转移前微环境形成的多个阶段的作用。
八、在转移前的微环境中,外泌体培养的细胞促进转移
卵巢癌外泌体直接促进循环肿瘤细胞归巢,定植和在转移前微环境内的生长,同时抑制宿主抗肿瘤免疫应答。通过促进宿主细胞转化为TAM和CAF表型来促进肿瘤细胞增殖和侵袭(表3)。由于TAM的细胞因子谱而发生的,由此它们分泌大量的EGF,其激活外周卵巢癌细胞中的EGFR。该EGF / EGFR信号级联上调血管内皮生长因子-C,诱导卵巢癌细胞的增殖,迁移,粘附,球状体形成和腹膜植入(图3b)。在转移前的微环境中,肿瘤衍生的外泌体将局部成纤维细胞转化为CAF,通过其自身的外泌体支持肿瘤发生。
九、外泌体突破了转移前微环境内肿瘤侵袭的障碍
肿瘤细胞的巢包括腹膜、网膜、肠系膜、横膈膜和腹壁内脏的表面(图3a)。转移的这些病症是由腹水内的转运引起的,也会发生血管转移到网膜的病例(图3a)。在组织学上,网膜和腹膜都是松散的胶原网络、具有血管化的结缔组织、分散的成纤维细胞、脂肪细胞和巨噬细胞,它们被一层富含微绒毛的间皮细胞和薄的基底膜所覆盖(图3b)。在血源性途径中,肿瘤细胞穿透表面内皮,并且在腹水途径中,它们渗入间皮(图3c)。
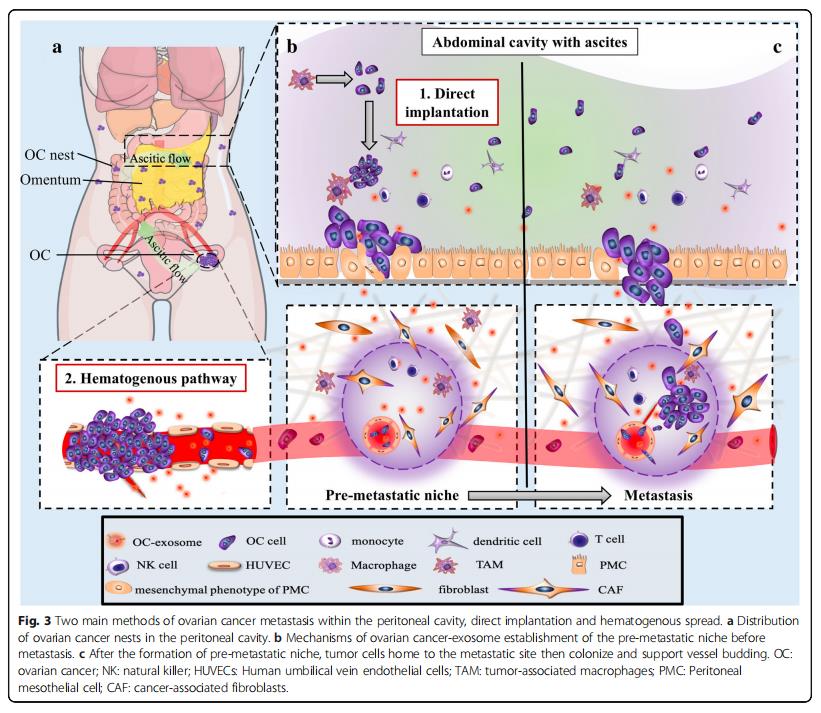
卵巢癌外泌体通过诱导血管内皮细胞迁移促进血管生成,促进肿瘤细胞归巢到转移前的微环境。在腹膜内脏中显着缺乏间皮细胞表明这些细胞在肿瘤发生期间被清除,并且可能在大规模转移性侵袭之前被清除。从机制上讲,卵巢癌细胞将具有特异性miRNA的外泌体释放到腹水中,从而重塑间皮细胞层以增强腹膜通透性(图2e)。
十、外泌体作为转移前的微环境标志物和治疗应用
早期检测转移前的微环境是妇科肿瘤学领域的一个重要目标,除了具有转移微环境特征的细胞外基质谱改变的区域之外,新技术已经寻求检测高渗透性,缺氧性和炎症区域。外泌体作为转移前微环境形成的生物标志物具有稳定、丰富且具有肿瘤特异性等独特优势。液体活检是一种可以从体液中分析循环肿瘤细胞的肿瘤衍生外泌体的技术。该技术通过高度特异性的靶选择,生物抗原传感和信号转导技术检测癌症来源的外泌体。通过将卵巢癌外泌体嵌入工程化生物材料中,并植入小鼠模型的腹腔内来产生转移前的微环境模拟物。这种人工转移前的微环境有效地从腹水中募集和捕获游离的卵巢癌细胞,从而防止这些细胞向正常的骨盆内脏转移。当制备转移前的微环境时,肿瘤衍生的外泌体经历归巢至优选的器官和细胞特异性位点。肿瘤特异性生物标志物和治疗策略可能具有可接受的特异性。此外,鉴于卵巢癌外泌体内的转移前生物标志物谱及其在转移前微环境形成中的作用,液体活检的最新进展诊断使外泌体成为早期筛查和检测的一个有前途的新领域(表3)。
结论:
卵巢癌外泌体通过免疫抑制,血管生成,基质细胞重塑和致癌重编程促进转移前的微环境形成。因其对形成肿瘤微环境的实质性影响,细胞脱落外泌体的作用而受到重视。 在迄今为止的临床前工作中,动物研究中的外泌体已在体外分离和纯化。液体活检等新兴技术可能会进一步表征其在体内的致瘤作用,并可能有助于充分揭示这些促转移因子在卵巢癌中的临床意义。






