CAFs分泌的外泌体通过增强的细胞干性和上皮-间质转化来促进结肠癌转移和化疗耐药
导语:
相关的成纤维细胞(CAFs):是一种处于持续活化状态的基质细胞,在肿瘤进展中具有关键作用。结直肠癌 ((CRC):指结肠或直肠内的细胞异常生长所形成的癌症,是全球第三大最常见的恶性肿瘤。癌相关的成纤维细胞(CAFs)是在肿瘤进展中起主要作用的关键基质细胞。但是,CAFs衍生分子调控大肠癌(CRC)转移和化学耐药性的分子决定因素尚未完全表征。
技术路线:
1.从结肠癌(CRC)和邻近的正常组织中获得CAFs和NFs。
2.使用超速离心法和外泌体快速沉淀试剂盒从培养基和血清中分离外泌体,并通过透射电子显微镜,纳米跟踪分析和免疫印迹进行表征观察。
3.MicroRNA微阵列用于鉴定CAFs或 (NFs)分泌的外泌体中差异表达的miRNA。
4.外泌体的内化并通过免疫荧光观察miR-92a-3p的转移
5.使用博伊登(Boyden)室验证迁移和侵袭性,细胞计数试剂盒-8,流式细胞术,平板集落形成,球形成实验,尾静脉注射等来以探讨CAFs和NFs对原发性结肠癌肝转移的作用,以及他们分泌的外泌体对结肠癌中上皮-间质转化,干细胞特性,转移和化疗耐药性的影响。
6.运用荧光素酶报告检测,实时定量PCR,免疫印迹,免疫荧光和免疫组织化学染色来探讨miR-92a-3p,FBXW7和MOAP1对CRC转移和化疗耐药的调节作用。
研究结果:
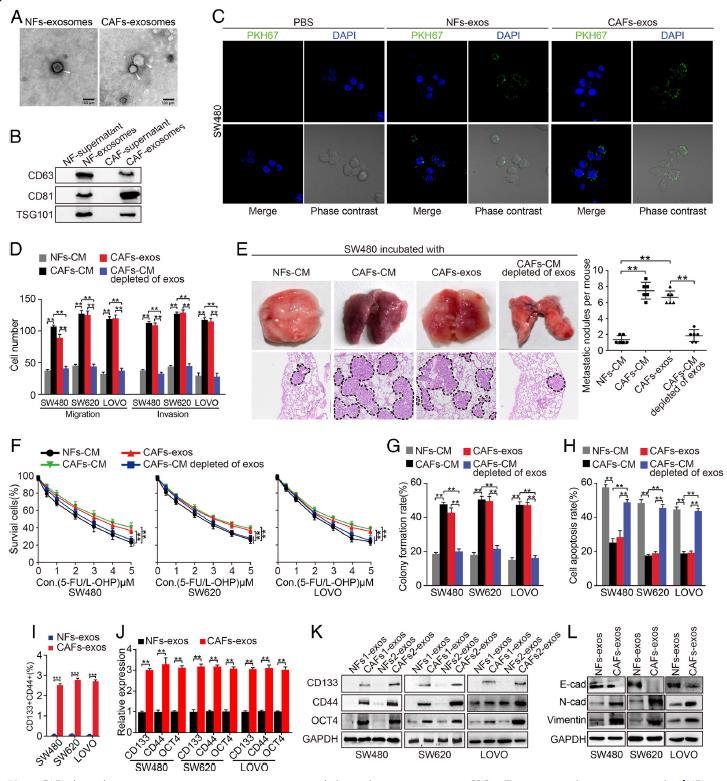
1.CAFs分泌的外泌体促进CRC细胞的转移和抵抗5-FU / L-OHP。从结直肠癌组织和相应的正常结直肠粘膜中获得了CAFs和NFs。与用NFs-CM处理的细胞相比,用CAFs-CM处理过的结肠癌细胞显示出更高的迁移和侵袭能力,用CAFs-CM处理的CRC细胞显示出增强的5-FU / L-OHP治疗抗性。通过透射电子显微镜(TEM)揭示了杯状结构外泌体,并测定了外泌体标记物CD63,CD81和TSG101蛋白在这些囊泡中阳性表达。通过激光扫描共聚焦显微镜(LSCM)观察到PKH67标记的外泌体被CRC细胞内化。在小鼠模型中,CAFs-CM中外泌体的消耗抑制了肺转移结节的形成。去除了外泌体的CAFs-CM处理CRC细胞时,CRC细胞的迁移和侵袭能力显着降低。经5-FU / L-OHP治疗, CAFs-CM处理的CRC细胞具有更高的存活和集落形成能力以及更低的细胞凋亡。用CAFs-exos处理的CRC细胞形成了较大的球体、癌干细胞性标记物CD133、间充质标记物等明显增加,上皮标记物降低,CAFs-exos诱导CRC细胞上皮向间质转化。以上结果表明,CAFs分泌的外泌体可能通过增强CRC中的干细胞特性和EMT来促进转移和5-FU / L-OHP抵抗。
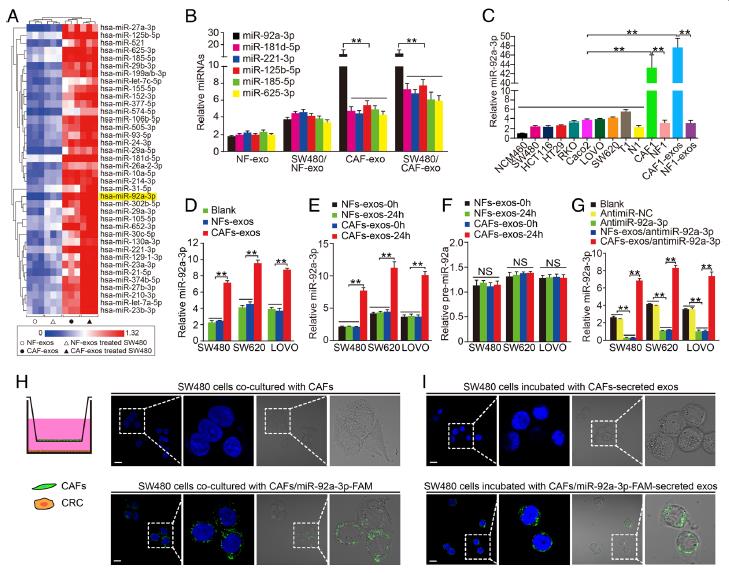
2.miR-92a-3p从CAFs直接转移到CRC细胞。使用miRNA芯片测序,实时PCR验证了在差异表达的miRNA中,CAF-exos和SW480CAFs-exos细胞中miR-92a-3p,miR-181d,miR-221,miR-125b,miR-185和miR-625的水平显着增加。miR-92a-3p在CAFs和CAFs-exos的表达水平明显增高,在SW480CAFs-exos,SW620CAFs-exos和LOVOCAFs-exos细胞中,MiR-92a-3p水平也显着增加。说明CAFs-exos与CRC细胞中miR-92a-3p的增加有关。转染miR-92a-3p sponge 或者miR-NC,转染MiR-92a-3p的细胞中,MiR-92a-3p明显下降。然而,同NFs-exos相比,与CAFs-exos孵育后,图中三种CRC细胞中miR-92a-3p水平明显升高。说明CRC细胞中miR-92a-3p的增加不是miRNA内源性合成的结果,而是CAFs-exos直接转移的结果。使用Transwell实验的结果也说明了miR-92a-3p通过外泌体直接从CAFs转移到CRC细胞。
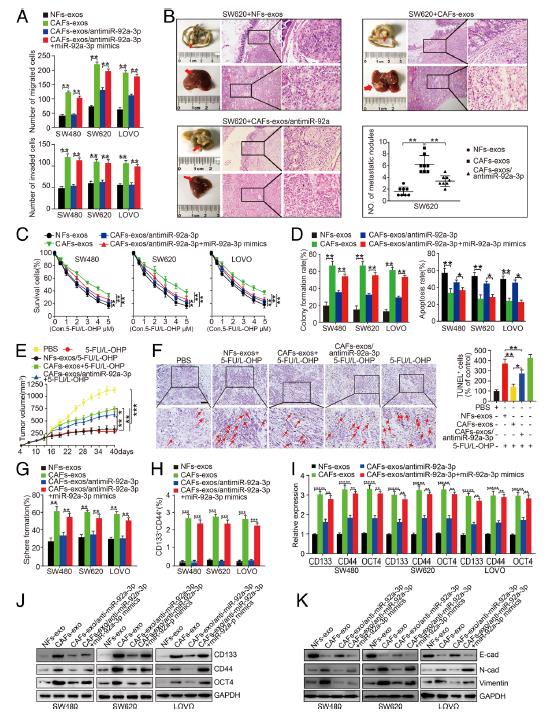
3.CAFs分泌的miR-92a-3p可增强CRC的干细胞特性,EMT,转移和5-FU / L-OHP抵抗力。将miR-92a-3p-sponge转染到CAFs-exos中可以大大减少了SW480CAFs-exos,SW620CAFs-exos和LOVOCAFs-exos细胞的迁移和侵袭。将miR-92a-3p模拟物重新引入CRC细胞可以逆转miR-92a-3p海绵介导的细胞迁移和侵袭抑制作用。将SW620细胞注射到小鼠的腹侧面,形成皮下肿瘤。 注射SW620CAFs-exos细胞的小鼠的肝转移数量要多于注射SW620NFs-exos细胞的小鼠,而与对照组相比,用miR-92a-3p海绵转染的CAFs-exos处理的SW620细胞的注射可以减少肝转移。在体外和体内测定了CAFs-外泌体miR-92a-3p对CRC细胞对5-FU / L-OHP治疗效果的影响。在CRC细胞中重新导入miR-92a-3p可以大大增强CRC细胞中的N-钙粘蛋白和波形蛋白,并抑制E-钙粘蛋白的表达。综上实验数据表明:CAFs通过将外泌体miR-92a-3p转移至CRC细胞,促进了CRC的转移和5-FU / L-OHP耐药性并增强了干细胞特性和EMT。
4.FBXW7和MOAP1是miR-92a-3p的下游靶点。在表达miR-92a-3p的HEK293A,SW480,SW620和LOVO细胞中,具有野生型的FBXW7或MOAP1的酶活性被显着抑制。相反,突变的FBXW7或MOAP1的荧光素酶活性没有改变。此外,与Mock细胞相比,在表达miR-92a-3p的CRC细胞中FBXW7和MOAP1显着降低(图4d,e)。另外,与对照组相比,SW480CAFs-exos,SW620CAFs-exos和LOVOCAFs-exos细胞中的FBXW7和MOAP1蛋白均受到抑制,然而在CRC细胞中重新导入FBXW7和MOAP1则增加miR-92a-3p的水平。这些结果表明FBXW7和MOAP1是CRC细胞中miR-92a-3p的下游靶标。
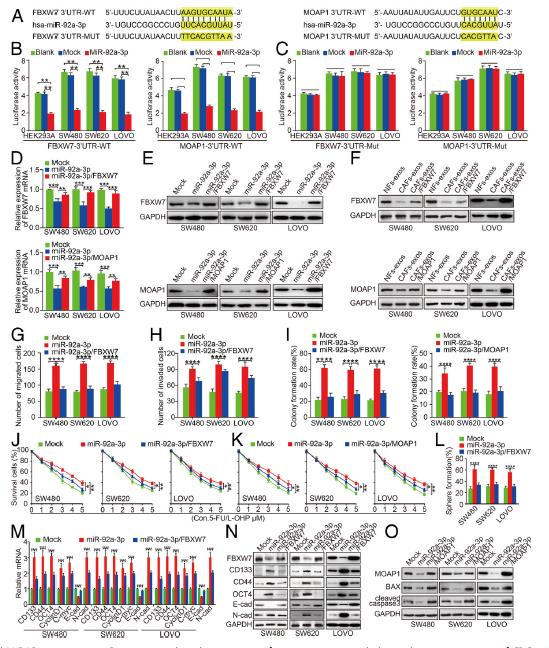
5.FBXW7和MOAP1在体内和体外减弱miR-92a-3p介导的CRC的干细胞特性,转移和5-FU / L-OHP抗性。分别用FBXW7和MOAP1质粒转染SW480,SW620和LOVO细胞。博伊登室试验表明,FBXW7的重新引入可以抑制miR-92a-3p介导的促进CRC细胞迁移和侵袭。此外,在5-FU / L-OHP处理下,FBXW7和MOAP1的重新表达显着降低了CRC细胞的集落形成和存活能力。 FBXW7的过表达抑制了miR-92a-3p的表达从而导致干细胞特性,增殖和EMT表型受到抑制,MOAP1 可诱导了CRC细胞中凋亡蛋白BAX的表达和半胱天冬酶-3的裂解,从而促进了癌细胞的凋亡。构建了细胞的慢病毒感染。SW620 / miR-92a-3p细胞在肺和肝脏中显着形成更多的转移结节。在5 FU / LOHP治疗下,引入FBXW7胞可减少源自 miR-92a-3p细胞的皮下肿瘤,miR-92a-3p / FBXW7细胞衍生的肿瘤具有:较低的ki67增殖指数,但凋亡细胞和(caspase-3)凋亡蛋白表达却有所增加。这些结果表明FBXW7和MOAP1可以在体内减轻miR-92a-3p介导的CRC细胞的转移和化疗耐药性。
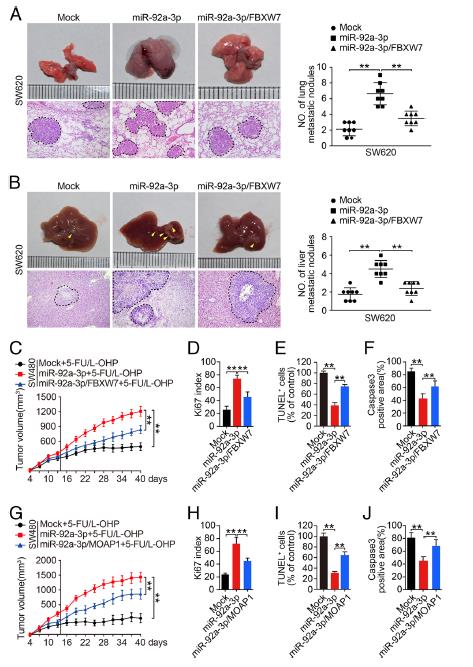
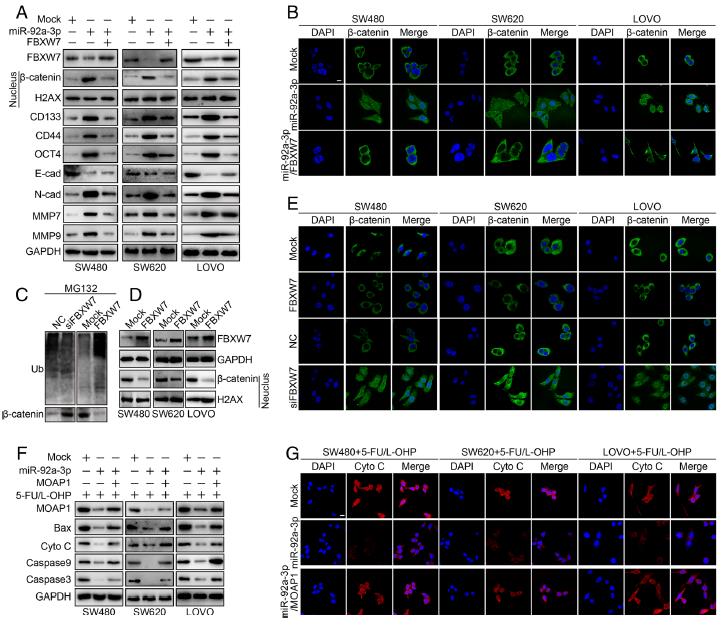
6.FBXW7和MOAP1通过促进β-catenin的泛素化降解和线粒体凋亡来逆转miR-92a-3p的致癌作用。外源性miR-92a-3p的引入可显著增加CRC细胞核中β-连环蛋白(β-catenin)的表达,而在表达miR-92a-3p的细胞中重新引入FBXW7会降低细胞核中β-catenin的表达。miR-92a-3p的过度表达在CRC细胞中增加了CD133,CD44,OCT4,N-钙黏着蛋白,MMP7,MMP9但降低了E-钙黏着蛋白。相反,在miR-92a-3p表达细胞中FBXW7的过表达却显示出相反的作用。发现FBXW7通过促进CRC细胞中的β-catenin泛素化和降解来抑制细胞核中的β-catenin. 在5-FU / L-OHP治疗下, MOAP1减弱miR-92a-3p对CRC化疗耐药性作用的机制。这一过程说明FBXW7和MOAP1通过促进β-catenin的泛素化降解和线粒体凋亡来逆转miR-92a-3p的致癌作用。
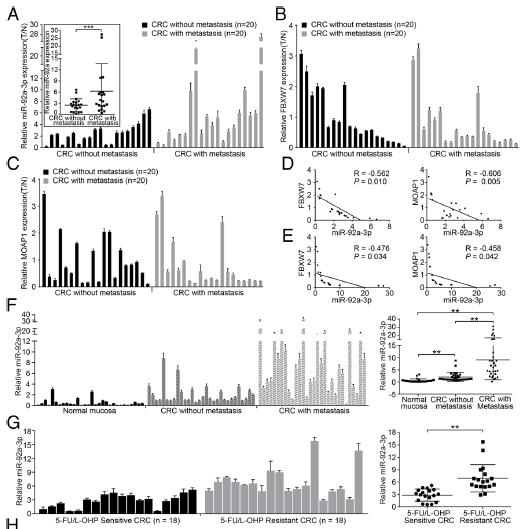
7.MiR-92a-3p与FBXW7和MOAP1负相关,血清中miS-92a-3p的高表达可预测CRC患者的转移和化疗耐药性。实时PCR检测了其在40例CRC组织和相应正常黏膜中的表达。与正常粘膜相比,miR-92a-3p在CRC组织中的表达更高。而且,与无转移的CRC相比,有转移的CRC中的miR-92a-3p更高。CRC组织中FBXW7和MOAP1的表达低于正常粘膜。相关分析表明,在有或没有转移的情况下,CRC都与miR-92a-3p与FBXW7和MOAP1呈负相关。临床样品检测验证了5-FU / L-OHP耐药的CRC患者的外泌体miR-92a-3p显着更高。FBXW7和MOAP1都是miR-92a-3p的下游靶基因,外泌体miR-92a-3p可能是CRC转移和化疗耐药的预测指标。
总结:
CAF可以将富含miR-92a-3p的外泌体分泌到肿瘤微环境中。外泌体miR-92a-3p通过靶向CRC细胞中的FBXW7和MOAP1来促进迁移,侵袭,转移,干细胞和5-FU / L-OHP化疗耐药性。此外,在转移和5-FU / L-OHP化疗耐药的CRC患者血清中,外泌体miR-92a-3p上调。我们设想,阻断CAF分泌的外泌体miR-92a-3p的功能可以用作CRC转移和治疗耐药性的预测和治疗的替代方法。
简而言之,结直肠癌(CRC)细胞摄取与癌相关的成纤维细胞分泌的外泌体,导致CRC细胞中miR-92a-3p和干性,EMT,转移以及5-FU / L-OHP耐药性增加。具体地说,miR- 92a-3p通过直接结合FBXW7和MOAP1的3'UTR并抑制它们在CRC细胞中的表达,从而增强了侵略性和化疗耐药性。FBXW7和MOAP1的重新表达通过抑制CRC中的Wnt /β-catenin和线粒体凋亡来减弱miR-92a-3p的作用。






