circNUSN2的m6A甲基化修饰促进结直肠癌肝转移
circRNA在基因表达调控中发挥重要作用,可作为疾病的生物标志物。circRNA表达异常已在不同的病理过程中被发现,包括肝癌、膀胱癌、肺癌和口腔癌的发病机制。已有报道m6A修饰广泛存在于circRNA中。但m6A修饰对circRNA的影响与调控机制及其在肿瘤进展中的生物学意义尚不清楚。Nature Communications杂志发表了一篇circRNA m6A修饰的文章“N6-methyladenosine modification of circNSUN2 facilitates cytoplasmic export and stabilizes HMGA2 to promote colorectal liver metastasis”,文章报道发现m6A修饰的circNSUN2可结合YTHDC1并促进其出核,进一步结合IGF2BP2稳定HMGA2 mRNA的稳定性,从而促进结直肠肝转移。
结果:
1.circNSUN2的表达分析
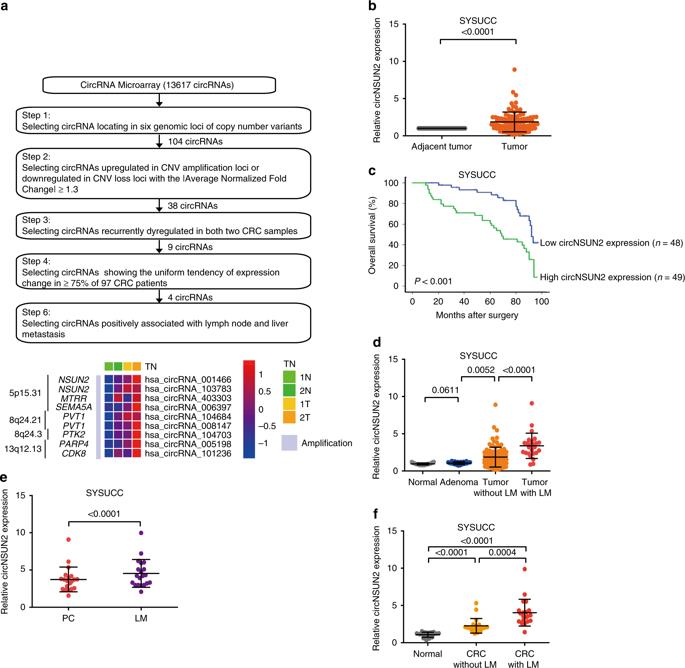
我们使用两对CRC和邻近非肿瘤组织样本进行高通量circRNA微阵列。在这些基因组位点中,我们鉴定出38种调节异常的circRNA。其中,我们进一步选取9个有统计学意义且循环失调的环状circRNAS作为候选(图1a)。其中4种circRNA在超过75%的标本中呈现出高表达的趋势(图1b)。另外,ircNSUN2高表达的组生存状况显著低于低表达组(图1c)。而且与正常结直肠组织和腺瘤对照组相比,原发性CRCs中特别是LM的CRCs中circNSUN2表达显著上升(图1d)。此外,我们比较了从相同患者手术获得的原发性CRCs (PC)和匹配的LM组织中circNSUN2的表达,发现与原发性CRCs组织相比,在LM组织中circNSUN2的表达显著增加(图1e)。与对照组的CRCs患者相比,患有LM的CRCs患者的血清circNSUN2表达也显著升高(图1f)。
2.CRCs中circNSUN2的鉴定
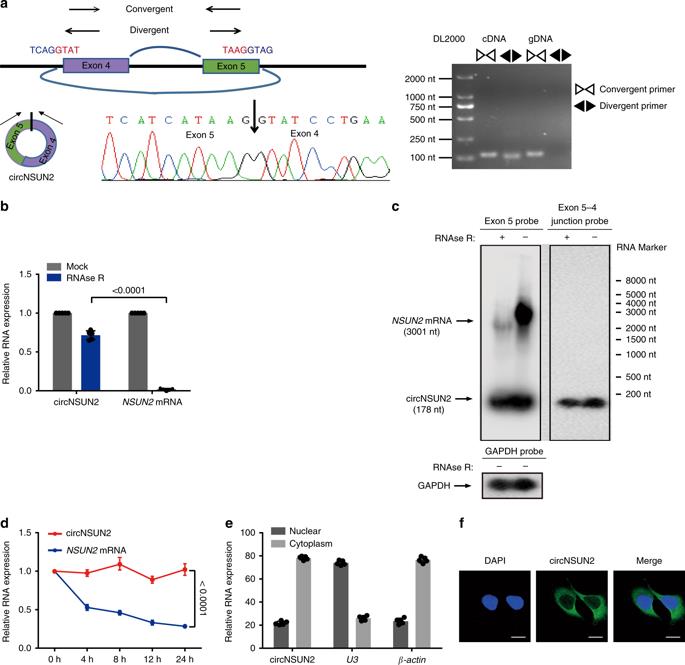
我们通过RT-PCR、Sanger测序、RNase R处理和northern blot对HCT116细胞中的circNSUN2进行分析。经扩增引物RT-PCR检测,序列产物与circNUSN序列一致(图2a)。对RNase R外切酶的耐消化性证实,该RNA物种具有环状RNA结构(图2b)。然后,我们使用探针来区分circNSUN2及其宿主基因NSUN2(图2c)。经转录抑制剂actinomycin d处理后,qRT-PCR分析显示,circNSUN2的半衰期超过24小时,而相关线性转录物的半衰期约为4小时(图2d),说明circNSUN2在CRC细胞中更加稳定。进一步的核质分离(图2e)和荧光原位杂交(图2f)检测显示,circNSUN2主要分布在胞质中。这些结果共同揭示了circNSUN2是CRC中表达丰富而稳定的circRNA。
3.circNSUN2促进CRC转移
鉴于circNSUN2在CRC侵袭性中的重要临床意义,我们研究了circNSUN2在CRC细胞转移中的体内功能。结果表明,在PDX CRC细胞中,circNSUN2表达下调后,无论是在肝脏(图3a)还是肺(图3c)转移模型中,肿瘤转移均受到明显抑制。相比之下,通过过度表达circNUSN2注入TC71细胞的裸小鼠与对照组相比,肝脏(图3b)或肺(图3d)的转移性结节明显增多。
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\1Y}B]S}9)K@Z)%KTX{A2O{T.png](https://img1.dxycdn.com/2020/0114/633/3390799366532132773-14.jpg)
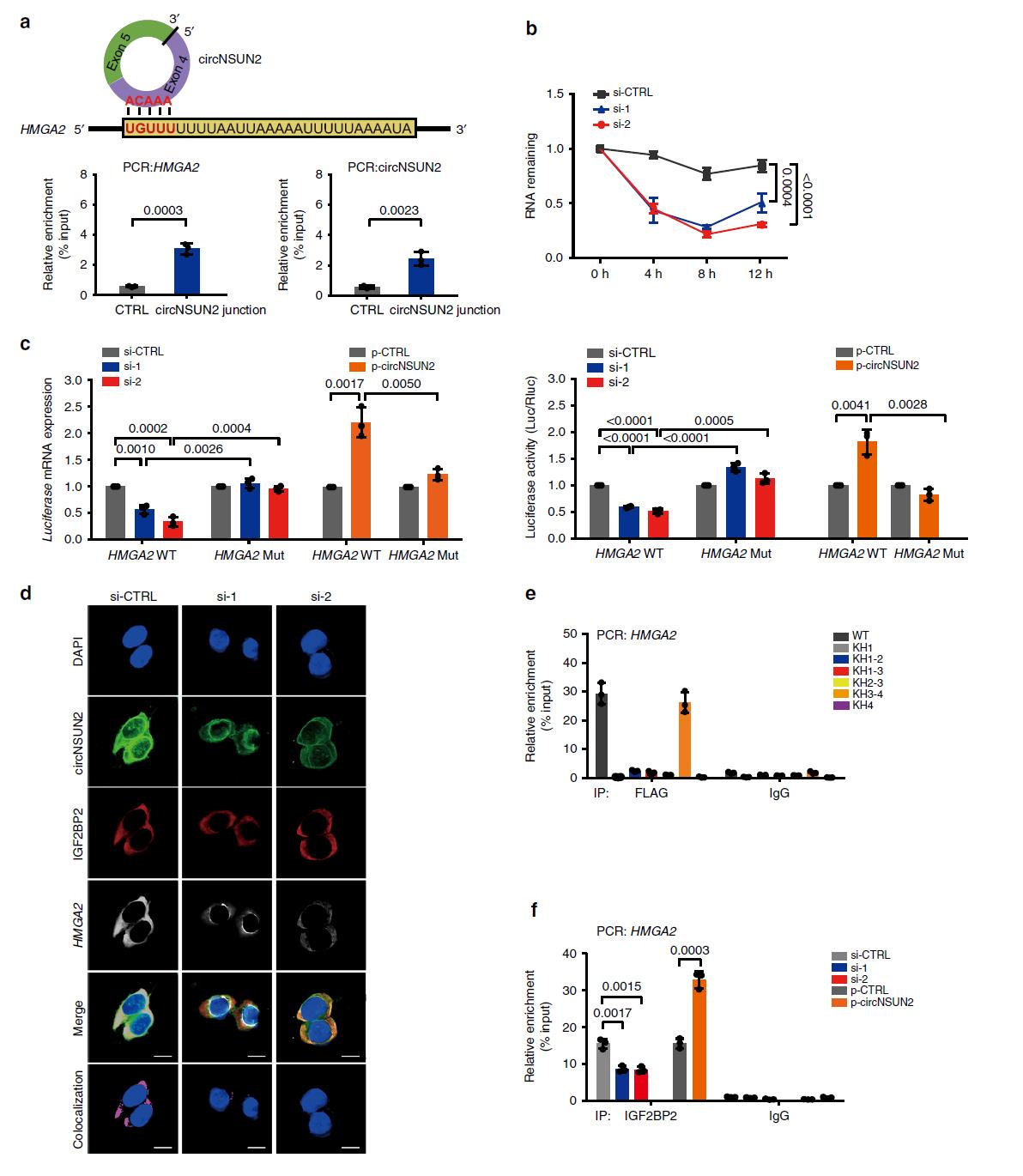
4.YTHDC1促进m6A修饰的circNSUN2的细胞质输出
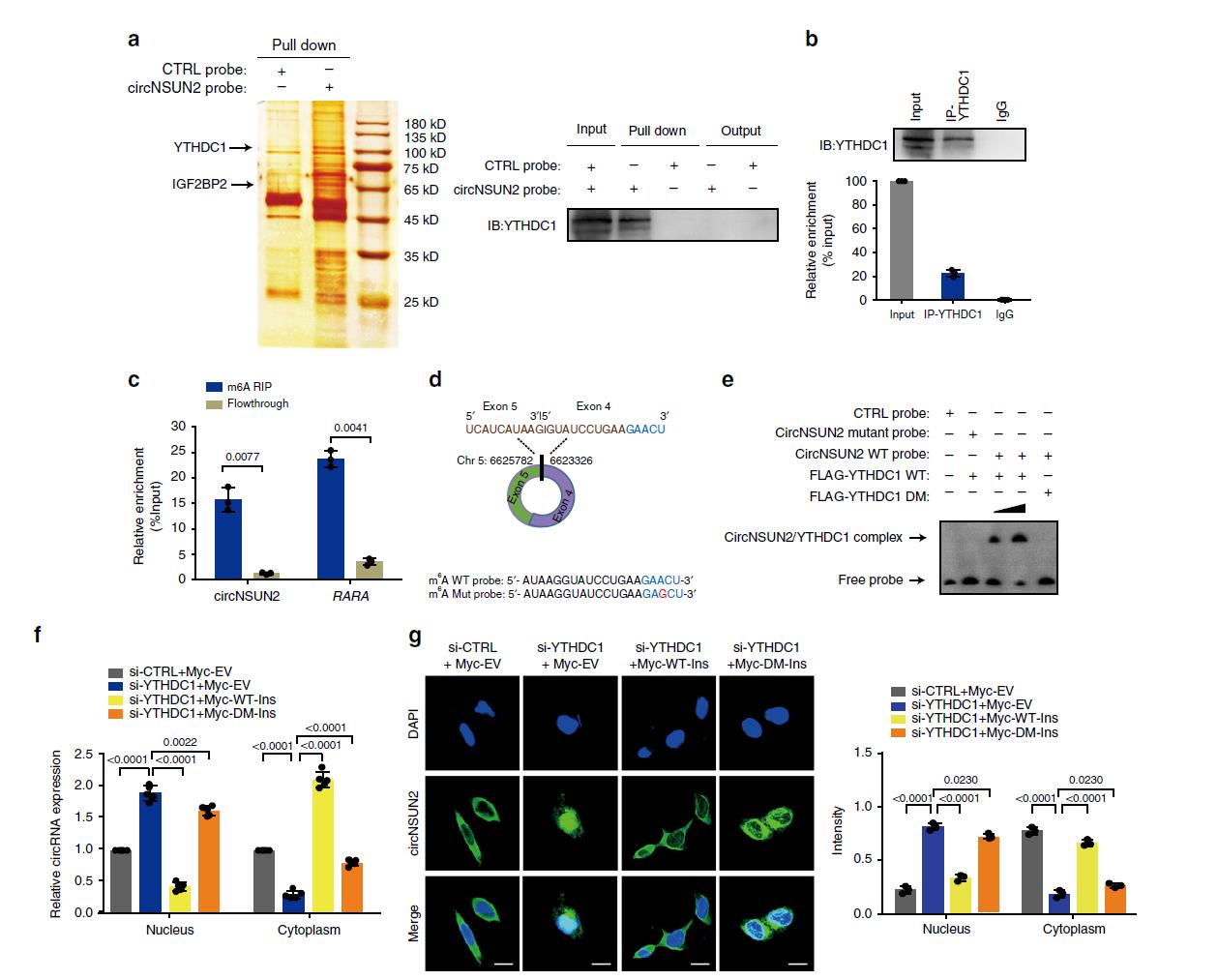
为了探索circNSUN2调控CRC恶性肿瘤的潜在分子机制,我们首先进行了RNA下拉实验和质谱分析来筛选与circNSUN2相互作用的蛋白(图4a)。我们验证了YTHDC1和IGF2BP2是推测的circNSUN2结合蛋白。进一步的RNA结合蛋白免疫沉淀实验表明,与对照相比,使用YTHDC1抗体沉淀的复合物中circNSUN2富集(图4b)。由于YTHDC1是已知的m6A读码器,我们想知道circNSUN2是否含有m6A甲基化。通过甲基化RNA免疫沉淀分析,我们发现circNSUN2的外显子5和外显子4连接序列在m6A的析出分数中得到了高度富集(图4c),证实了circNSUN2中的m6A修饰。序列分析预测到了circNSUN2中存在GAACU motif,通过突变实验我们发现,当RNA探针中GAACU m6A基序或YTHDC1的m6A结合基序发生突变,YTHDC1与circNSUN2的相互作用能力下降(图4e)。此外,核质分离(图4f)和FISH(图4g)表明,YTHDC1的沉默显著增加了细胞核circRNA的含量。YTHDC1野生型(WT)的强迫表达挽救了circNSUN2的细胞质输出缺陷。总之,这些结果证明YTHDC1可以与circNSUN2结合,从而促进circNSUN2以m6A依赖的方式从 细胞核向细胞质输出。
5.circNSUN2通过CAUCAU与IGF2BP2相互作用
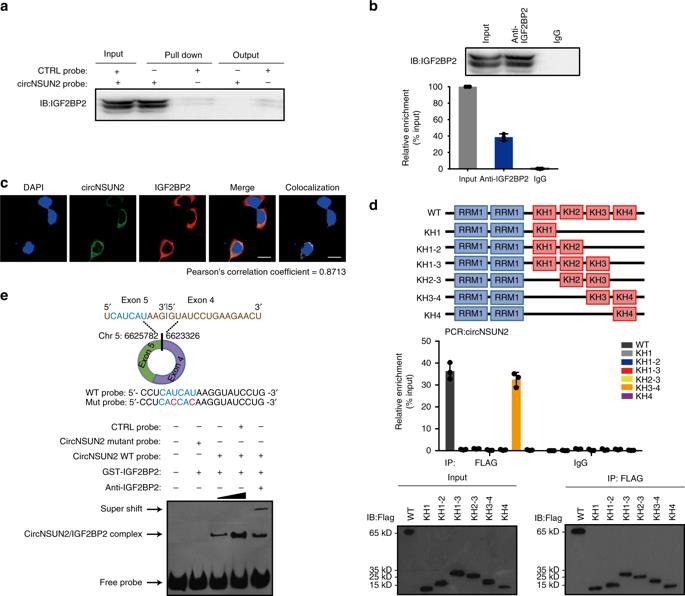
从RNA下拉实验中,我们首先观察到circNSUN2被大量的IGF2BP2蛋白下拉(图5a),进一步的RNA免疫沉淀证实了IGF2BP2与circNSUN2之间的相互作用(图5b)。通过免疫荧光和荧光原位杂交检测,我们证实了胞质中内源性表达的circNSUN2和IGF2BP2的共域化(图5c)。这些结果表明circNSUN2/IGF2BP2在细胞质中形成了RNA蛋白复合物。另外,我们研究了IGF2BP2与circNSUN2相互作用的结构域。RIP分析(图5d)显示,IGF2BP2的KH3-4-di-domain特异性地与circNSUN2结合。之前已报道IGF2BP2结合RNA的motif是CAUH (H = A、U或C),在circNSUN2中存在该基序,于是基于位点突变前后EMSA分析,我们验证了circNSUN2内的CAUCAU是IGF2BP2相互作用所必需的(图5e)。我们的数据揭示了IGF2BP2通过KH3-4–di-domain与circNSUN2的CAUCAU结合。
6.circNSUN2/IGF2BP2/HMGA2复合物促进HMGA2 mRNA稳定
由于IGF2BP2对mRNA的稳定性至关重要,我们接下来想知道circNSUN2/IGF2BP2复合物是否能稳定某些未知的下游靶点。因此,我们设计了干扰circNSUN2前后分析转录组的差异情况,644个mRNA表达在circNSUN2沉默后显著下降。据报道,IGF2BP2优先与AU含量高的靶mRNAs的3’UTR结合。基于已发表的CLIP数据分析了这644种mRNA的情况,其中有21种mRNA可以结合IGF2BP2。考虑到circNSUN2促进了转移进程,结合qRT-PCR和WB验证,我们证实了HMGA2是circNSUN2的靶点。RNA下拉实验证实了circNSUN2和HMGA2之间的相互作用(图6a)。干扰circNSUN2后HMGA2的mRNA稳定性显著降低(图6b)。荧光素酶报告基因实验、免疫荧光-FISH共定位分析和circNSUN干扰证明了circNSUN2在促进IGF2BP2与HMGA2相互作用方面起着关键作用,并通过形成circNSUN2/ IGF2BP2/HMGA2 RNA蛋白三元复合物来提高HMGA2的 mRNA稳定性(图6c-f)。
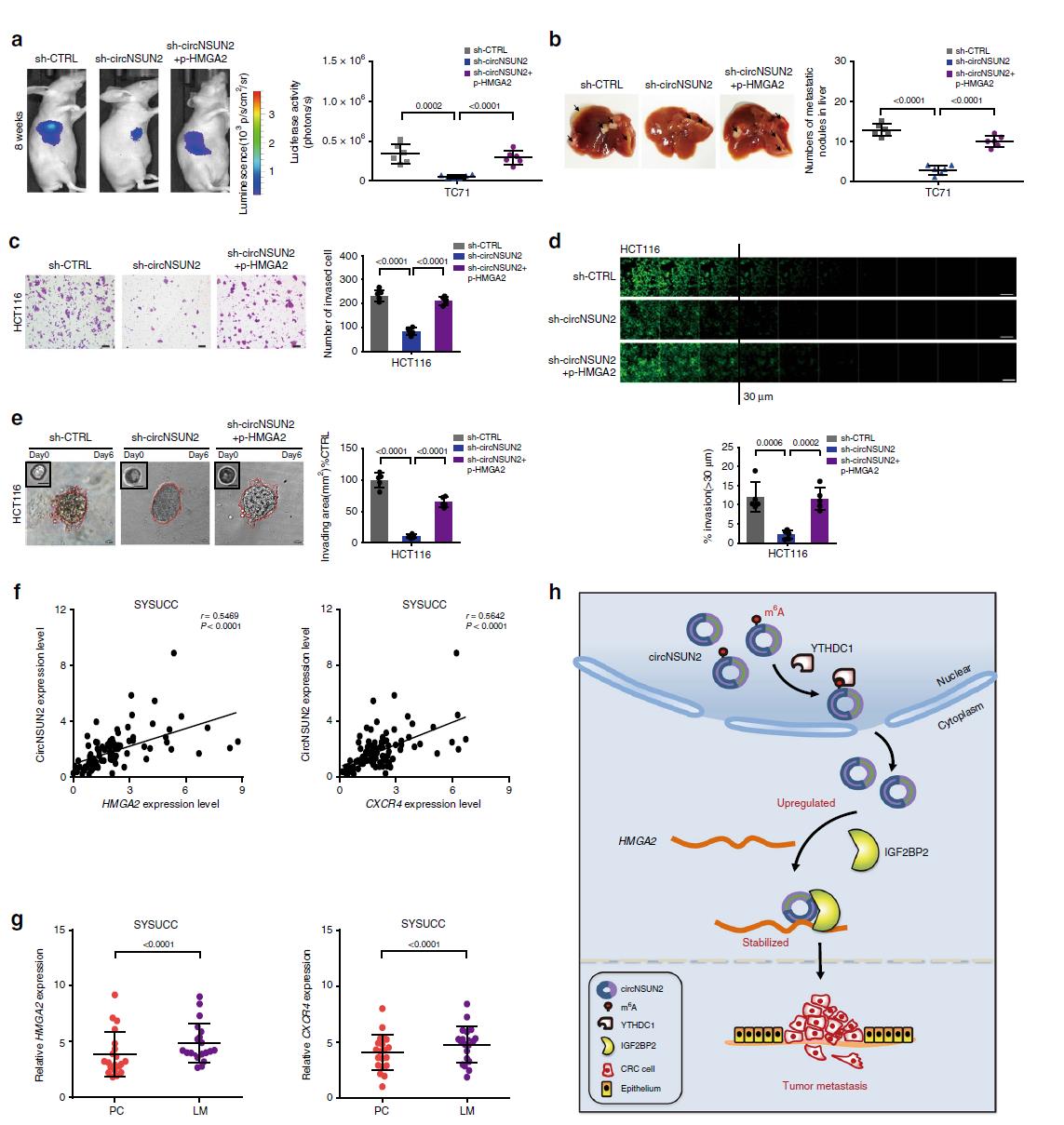
7.circNSUN2通过HMGA2途径促进CRC肝转移
我们研究circNSUN2在CRC转移中的作用是否依赖于HMGA2。体内模型表明,干扰circNSUN2可抑制肝转移,但同时过表达HMGA2则促进肝转移(图7a-e)。另外,为了揭示circNSUN2在CRC中的临床相关性,我们检测了97例CRC患者中circNSUN2和HMGA2的表达水平。我们发现HMGA2的表达水平与circNSUN2的转录水平呈正相关(图7f)。接下来我们又检测了20例CRC患者原发性和肝转移组织中HMGA2的表达水平。结果显示,HMGA2的表达上调在肝转 移中比在原发性组织中更为普遍(图7g)。
结论:
circNSUN2与细胞核内m6A结合蛋白YTHDC1结合,并且YTHDC1以m6A依赖的方式调控circNSUN2的出核定位。同时发现胞浆circNSUN2可与RNA结合蛋白IGF2BP2结合,并能直接结合下游HMGA2 mRNA,形成circNSUN2/IGF2BP2/HMGA2 RNA-蛋白三元复合物,促进HMGA2 mRNA稳定性。进一步通过体内裸鼠转移及体外细胞功能实验,证明了circNSUN2通过促进HMGA2mRNA的稳定性进而最终促进结直肠癌肿瘤的肝转移。






