原发性前列腺癌通过外泌体丙酮酸激酶 M2 促进骨转移
原发性前列腺癌通过外泌体丙酮酸激酶 M2 促进骨转移
9月份,Jinlu Dai等人发表一篇“Primary prostate cancer educates bone stroma through exosomal pyruvate kinase M2 to promote bone metastasis.”的SCI文章,IF= 10.892,这项研究确定PCa 衍生的外泌体是否可以通过调节骨髓微环境来促进骨转移,并确定实现该目的的机制。
骨转移是许多转移性癌症的常见后遗症。在患有晚期前列腺癌(PCa)的男性中,骨骼是最常见的转移靶标。大约84%的男性会发生骨转移;而最常见的软组织转移部位,即肝脏在体重不太严重的男性中很少见治疗后骨转移,发生率低得多(〜65%).与软组织转移相比,促进 PCa 更频繁地发展为临床可检测的骨转移的机制尚未明确。转移是一个复杂的过程,涉及成功建立临床上有意义的转移的多个步骤。广义上讲,增加的骨特异性可能是由于转移性细胞相对于软组织部位向骨骼的播种增加和/或骨骼微环境比软组织部位更有效地促进 PCa 生长的能力。这些概念反映了Stephen Paget的“种子和土壤”理论,表明癌细胞与远处微环境的某些组合可以优化癌细胞的生长机会.但是,该理论并不要求在肿瘤生长之前就存在最佳的微环境。
因此,肿瘤可以利用来促进转移的一种策略是改变远处的微环境以促进肿瘤细胞的接种或肿瘤的生长。几份报告表明,原发肿瘤释放的外泌体可以修饰远处,以促进这些部位的转移.外泌体是在 30-120 nm 范围内的膜结合囊泡,在多囊泡体内合成,并在多囊泡体与细胞膜融合后从细胞释放.外泌体包含多种生物分子,包括蛋白质, mRNA, lncRNA和 microRNA,它们可能会影响远处的细胞功能。因此,来自原发肿瘤的外泌体可能能够递送改变远处的生物分子,从而使其具有促进转移的能力。此过程定义为“转移前的niche”的创建。
技术路线:

一、前期准备工作
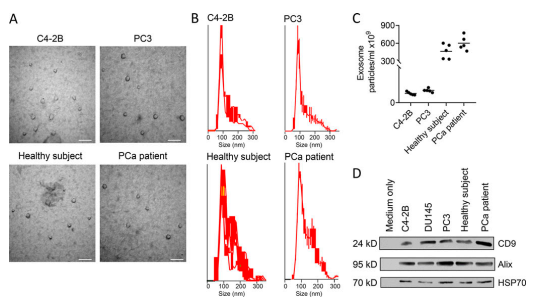
A.评估PCa外泌体是否影响影响转移过程,从PCa细胞系中收获外泌体,并对外泌体进行表征。从PC-3和C4-2B PCa细胞由基于电子显微镜代表性图片。微囊泡的最大范围为300 nm,并且大多数表达CD9,ALIX,和HSP70蛋白。
B.运用 NanoSight确定外泌体定大小分布。
C和D. 使用 Nanosight 测定每毫升来自C4-2B 或 PC3 条件下培养基和人类受试者的血清的外泌体数量。对外泌体蛋白质marker进行蛋白质印迹检测。
一、PCa 衍生的外泌体促进小鼠骨骼中的肿瘤生长
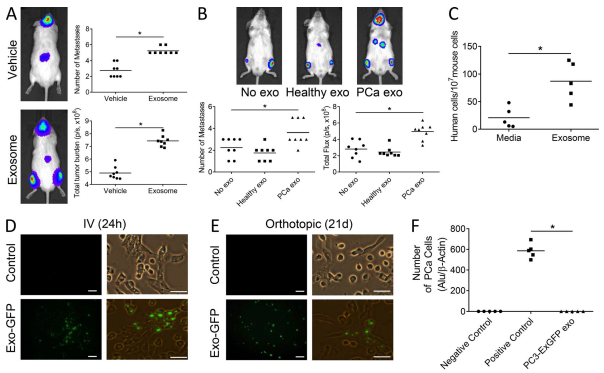
A. 用外泌体对SCID小鼠进行预处理,随后将PCa 细胞进行心内(ic)注射(左心室),并连续处理外泌体 21 天。与媒介物相比,PCa 外泌体诱导了转移部位数量的增加和总肿瘤负荷的增加。用 C4-2B 衍生的外泌体(A)或完全培养基的外泌体进行预处理 4 d,然后 ic 注射 PC3-荧光素酶细胞,连续外泌体治疗 21 d。
B. 为了确定 PCa 患者的外泌体是否影响 PCa 转移,我们使用健康男人血清与原发性 PCa 肿瘤患者的外泌体重复了 PCa小鼠模型实验。与健康男性相比,患有原发性 PCa 肿瘤的男性的外泌体增加了转移和转移负担的总数。
C. 我们用 PCa 外泌体预处理小鼠 4 d,将 PCa 细胞注入左心室,然后在 24 小时后收获骨髓,以定量接种骨髓的 PCa 细胞。与媒介物处理相比,用 PCa 外泌体进行预处理可使骨髓中 PCa 细胞的播种量增加约 115%.
补充实验结果:外源性外泌体对 PCa 的生长没有影响。
D. 我们对细胞进行了工程改造以表达荧光标记的将工程改造为表达荧光外泌体的 PCa细胞注射到受体小鼠的前列腺中,并于 3 周后评估了骨髓基质中的外泌体。注射肿瘤细胞后第 3 周,骨髓基质中存在外泌体。我们最初将这些外泌体静脉内注射入小鼠体内,并在 24小时内鉴定出它们在骨髓基质细胞(BMSC)中的存在。
E. 将工程改造为表达荧光外泌体的 PCa细胞注射到受体小鼠的前列腺中,并于 3 周后评估了骨髓基质中的外泌体。注射肿瘤细胞后第 3 周,骨髓基质中存在外泌体.
F.为了排除荧光是否是由于癌细胞在该时间点扩散所致,我们使用 PCR 对 Alu 序列进行了评估,评估了骨髓中人类细胞的存在.在任何骨髓样本中均未发现 Alu,这表明该时间点没有人类细胞存在.
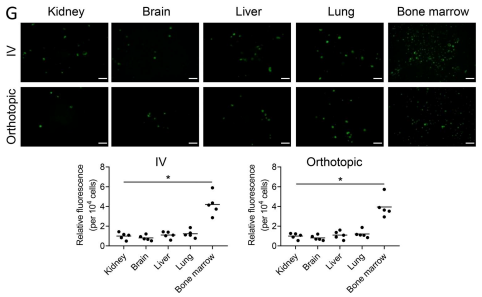
G. PCa 有转移到骨骼的倾向。然而,它确实转移到其他部位(例如肝脏),尽管频率较低。为了确定 PCa 外泌体是否除了骨骼外还靶向软组织部位,我们在小鼠中静脉注射了荧光标记的 PCa 外泌体,并在 24 h 评估了肾脏,脑,肝,肺和骨髓的外泌体。外泌体存在于所有组织中。但是,在每个细胞的基础上,它们靶向骨髓基质的水平高于其他组织.
综上所述,这些结果表明, PCa 外泌体对 PCa 细胞没有直接影响,而是通过遥远的靶微环境间接靶向和促进 PCa进程,并具有针对骨髓的选择性。来自 PCa 细胞系条件培养基的外泌体,一旦在体内注射后,可能会被修饰以直接对癌细胞产生影响,但这不太可能,因为 PCa 患者的外泌体包括体内–衍生的外泌体对肿瘤细胞没有直接影响,但是它们确实对体内有影响。
二、PCa 衍生的外泌体教育骨基质细胞增加 PCa 肿瘤细胞的增殖和侵袭
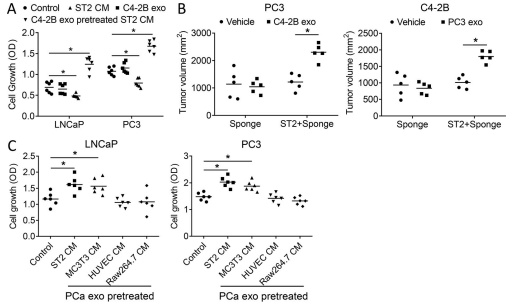
A. 评估了外泌体改变 BMSC 影响PCa 细胞生长的能力的程度。像以前一样, PCa 外泌体对 PCa 细胞没有直接作用。但是,未经处理的基质细胞产生的条件培养基会抑制 PCa 细胞的生长。相反,用外泌体预处理的基质细胞条件培养基(源自 PCa 细胞或 PCa 患者血清)可增加 PCa 细胞的生长
B. 将 PCa 细胞皮下植入了没有基质细胞或基质细胞的胶原海绵中小鼠相反侧面的细胞,然后用运载体或 PCa 外泌体处理小鼠。单独的外泌体和单独的基质细胞都不会影响 PCa 的生长,而在充满基质细胞的海绵中,外泌体诱导 PCa 的生长
C. PCa 外泌体影响内皮细胞,成骨细胞和破骨细胞前体细胞调节 PCa 生长的能力。外泌体在成纤维细胞基质细胞中作用最强,其次是成骨细胞,对内皮细胞或破骨细胞没有影响
D. 外泌体对 PCa 细胞侵袭特性的影响。基质细胞条件培养基单独促进 PCa 侵袭。然而,来自 PCa 细胞外泌体预处理的基质细胞的条件培养基进一步提高了 PCa 细胞的侵袭能力。
三、PCa 衍生的外泌体增加基质细胞中丙酮酸激酶 M2
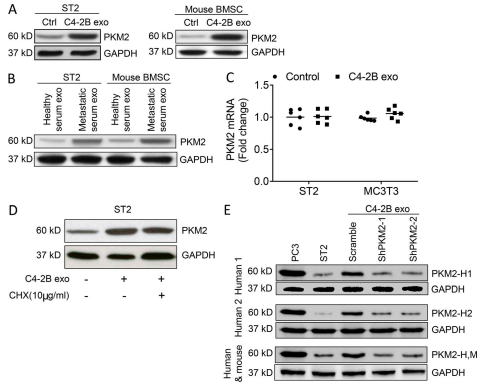
A. 为了验证外泌体调节基质细胞 PKM2 表达,将基质细胞暴露于外泌体,并评估 PKM2 蛋白表达。PCa 外泌体增加了 ST2细胞和原代 BMSCs 中 PKM2 蛋白的表达。
B. PCa患者的外泌体增加了 ST2 细胞和原代 BMSCs 中 PKM2 蛋白的表达。
C. 与基质细胞中 PKM2 蛋白的增加相反,基质细胞中外泌体不会改变 PKM2 mRNA 的表达。
D. 我们发现用含有人 PKM2 的外来体处理基质细胞会增加基质细胞中人 PKM2 的表达.
E. 当基质细胞用衍生自 PCa 细胞的外泌体处理时,人PKM2 没有增加,其中 PKM2 被敲低。此外,当基质细胞用衍生自 PCa 细胞的外泌体处理后,小鼠 PKM2并未增加,其中 PKM2 被敲除. 综上所述,外泌体将 PKM2 蛋白转移到基质细胞,而不是诱导 PKM2 mRNA 合成或蛋白合成。
F. 表明外泌体将 PKM2 蛋白转移到基质细胞,而不是诱导 PKM2 mRNA 合成或蛋白合成
接下来,确定 PKM2 是否可以解释外泌体调节基质细胞以促进 PCa 生长的能力。
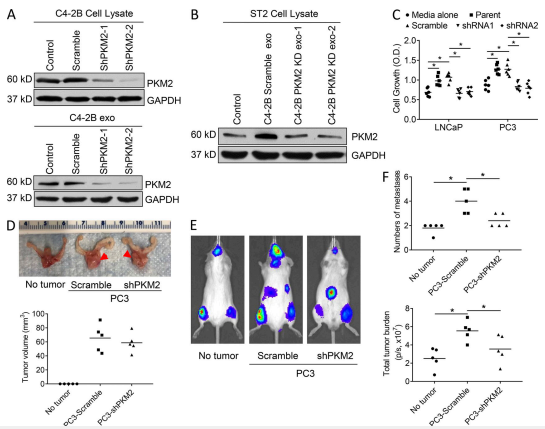
A. PKM2 的敲低导致外泌体缺乏PKM2。补充实验:PKM2 不会影响外泌体的产生。
B. 缺乏PKM2的外泌体不会改变ST2基质细胞中PKM2蛋白的表达。
C. 将癌细胞系与基质细胞的条件培养基一起培养,该基质来自用缺乏 PKM2 的外泌体处理的基质细胞。PCa 外泌体中 PKM2 表达增加导致丧失PCa 外泌体诱导 PCa 细胞生长的能力。
D. 敲除 PKM2 是否会影响原位原位肿瘤的生长。注射肿瘤细胞后第 14 天,安乐死每组小鼠的一部分,并测量肿瘤大小。在对照组和PKM2 基因敲低的 PCa 细胞之间,原位肿瘤的大小没有差异。
E和F. 原发性原位肿瘤的存在(由对照加扰的 shRNA 细胞组成)增加了转移的数量和总体转移负担。然而,在原发性肿瘤细胞中 PKM2 的敲低 部分减弱了原发性肿瘤增加转移数目和转移负担的能力。这些结果证明原发性前列腺肿瘤促进转移,而 PKM2 促进原发性肿瘤的转移能力。这些结果与原发性肿瘤可以部分通过外泌体 PKM2 促进转移的观点相一致。
四、PCa 外泌体通过 PKM2 诱导的 BMSC 通过 CXCL12 促进PCa 肿瘤生长
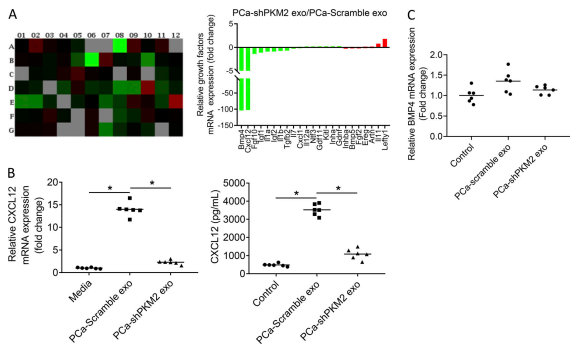
目的:探讨 PCa 外泌体中的 PKM2 是否调节基质细胞产生可溶因子以促进 PCa 生长
A. PKM2 敲低改变了几种细胞因子的表达;然而,骨形态发生蛋白 4(BMP-4)和 CXCL12 的表达明显降低。
B. PCa 衍生的外泌体诱导CXCL12 mRNA 和蛋白质表达超过 13 倍,而敲除 PCa 外泌体中的 PKM2 降低了 PCa 衍生的外泌体诱导 CXCL12 mRNA和蛋白质表达的能力。
C. PCa衍生的外泌体诱导 BMP-4 mRNA 的表达少于 1 倍,尽管PCa 衍生的外泌体中 PKM2 的敲低降低了 PCa 衍生的外泌体诱导 BMP-4 mRNA 表达的能力。
确定 PCa 外泌体培养的基质细胞是否通过 CXCL12 促进 PCa 细胞生长
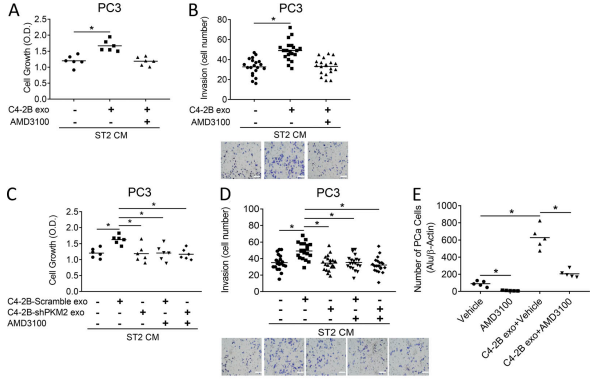

AMD3100:抑制CXCL12 结合其靶标
A和B. 来自 PCa 的外来体处理过的基质细胞的条件培养基增加了 PC3 和 C4-2B 细胞的生长和侵袭。但是,AMD3100 取消了对增殖和入侵的诱导。
C和D. 来自 PCa 的外来体处理过的基质细胞的条件培养基增加了 PC3 和 C4-2B 细胞的生长和侵袭。但是,AMD3100 取消了对增殖和入侵的诱导。
E. PCa 衍生的外泌体增加了 PCa 植入骨髓的能力,AMD3100 减少了 PC-3 细胞的接种。
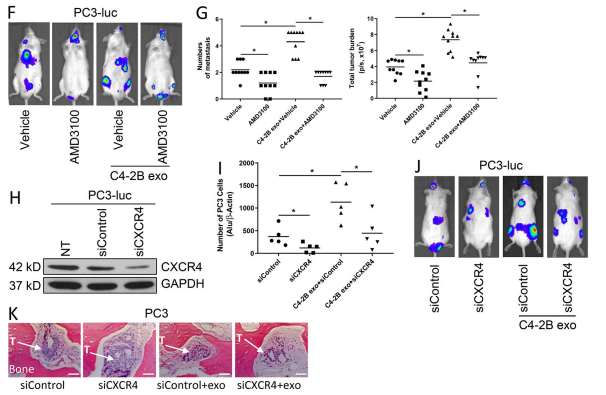
F和G.PCa 衍生的外泌体增加了 C4-2B 和 PC-3 肿瘤细胞的转移数量和总转移负担,而 AMD3100 抑制了这些作用.
H. 为了进一步确认这些结果是通过 CXCL12: CXCR4信号轴介导的,我们敲低了 PC-3 细胞中 CXCR4 的表达.
I和J. PC-3 细胞中 CXCR4 的敲低减少了外来体诱导的接种以及转移的数量和总转移负担.综上所述,这些结果表明外泌体含有 PKM2,它可以刺激基质细胞产生 CXCL12,从而促进 PCa 转移的进展.
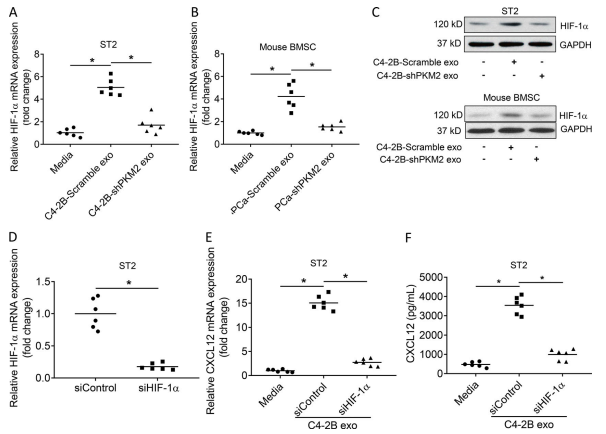
A-C. 确定外泌体是否促进了 HIF-1α 表达,并且这是否依赖于 PKM2。PC 衍生的外泌体刺激了 ST2 基质细胞系和原代鼠 BMSCs 中的 HIF- 1αmRNA 和蛋白表达,而 PCa 衍生的外泌体中的 PKM2 敲低显着降低了 HIF-1αmRNA 和蛋白表达的诱导.
D. PCa 衍生的外来体以 PKM2 依赖的方式促进 HIF-1α 表达。为了确定外泌体诱导的 HIF-1α 是否调节CXCL12 表达,我们敲低了基质细胞中的 HIF-1α,并用外泌体处理了细胞,以确认 HIF-1α 表达的丧失.
E 和F. 我们用 C4-2B PCa 衍生的外泌体处理基质细胞,观察到基质细胞中 HIF-1α 的敲低显着降低了外泌体介导的HIF-1α 诱导CXCL12 mRNA和蛋白质.






