外泌体指导的细胞重编程技术,可以直接将促炎性M1原位转化为抗炎性M2巨噬细胞
外泌体指导的细胞重编程技术,可以直接将促炎性M1原位转化为抗炎性M2巨噬细胞
伤口愈合是一个高度程序化的过程,涉及一系列精心策划的细胞和分子事件:止血,炎症,增殖和重塑阶段。巨噬细胞(Mφ)被认为是促进炎症-增殖相变的关键因素。由特定环境信号激活的Mφ大致可分为两个主要亚型:具有促炎特性的经典激活M1Mφ和具有抗炎和修复伤口功能的M2Mφ。因此,在特定时间点控制从M1到M2的Mφ表型转换为伤口修复的炎症阶段向增殖阶段的转变提供了有希望的解决方案。但是,许多尝试着重于与M2Mφ活性增加,招募更多M2Mφs或增加外源M2Mφs相关的策略,而又不影响M1Mφs。3当促炎性M1Mφ持续存在而未转变为抗炎表型时,据信这会损害伤口愈合
今年10月份,韩国大学KU‐KIST融合科学与技术研究生院与韩国科学技术研究院(KIST)生物医学研究所合作发表一篇“Exosome‐Guided Phenotypic Switch of M1 to M2 Macrophages for Cutaneous Wound Healing.”的SCI文章,IF= 15.804。这篇文献提出了用外泌体引导的细胞重编程技术能将促炎性M1表型直接转换为抗炎性M2表型以进行有效的伤口处理。M2巨噬细胞衍生的外泌体(M2-Exo)可以在体外诱导M1转换为M2的。因为M2-Exo不仅具有Mφs重编程因子,还具有促进伤口修复的各种细胞因子和生长因子。将M2-Exo皮下给药到伤口边缘后,观察到M1和M2的分别有明显的减少和增加,外泌体成功诱导M2 Mφs增殖。伤口部位的M1直接转化为M2 Mφs的结果是通过增强血管生成,上皮化和胶原沉积来加速伤口愈合的。外泌体具有优异的细胞重编程能力和先天生物相容性,诱导Mφs表型转换后通过调节促炎症与抗炎症之间的平衡而成为各种炎症相关病症的希望疗法。
技术路线:
一、小鼠M1和M2 Mϕs的建立以及Mϕs衍生的外泌体的表征
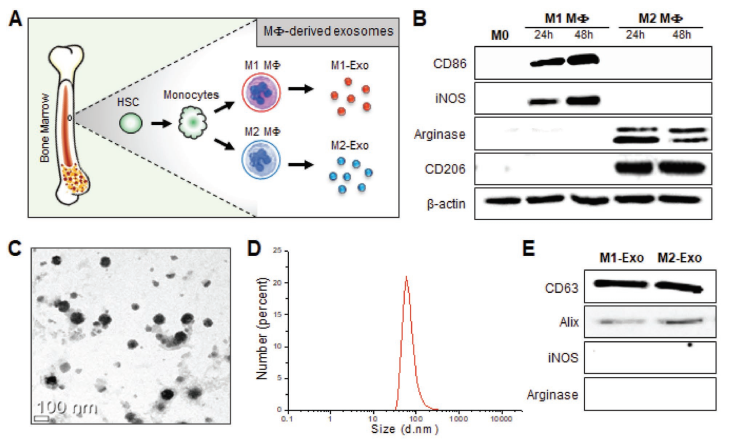
A)Mϕ和外泌体制备示意图。从BALB / c小小鼠股骨和胫骨中分离出骨髓来源的造血前体,并在存在单核细胞集落刺激因子(M-CSF)的情况下孵育7天,以促进单核细胞的分化。具有圆形和扁平形态的原代培养单核细胞开始粘附在培养皿上,并进一步分化为未定型的Mφ(M0)。在体外激活Mφ获取促炎M1(IFN-γ激活)和抗炎M2(IL-4激活)表型。
B)Western印迹分析,证明了24h与48h时间在M1(CD86和iNOS)与M2(Arginase和 CD206)标志物表达上的差异。
C)用乙酸铀负染后,外泌体的代表性TEM图像。
D)使用动态光散射测量的M2-Exo尺寸分布图。
E)外泌体的蛋白质印迹分析。从外泌体提取的等量总蛋白进行免疫印迹实验检测CD63,Alix,iNOS和Arginase的表达。
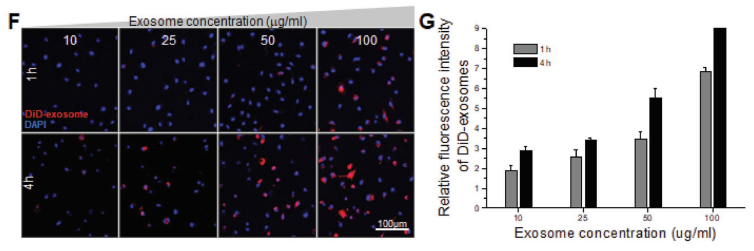
F)10、25、50和100 µg mL -1DiD标记的M2-Exo分别孵育M1 Mϕs1或4 h后,共聚焦图像显示带有DAPI的DiD标记的M2-Exo(红色)图像。
G)在M1 Mϕs中内化的DiD标记的M2-Exo的相对荧光强度。
二、从外体引导的M1到M2 Mϕs的体外重编程
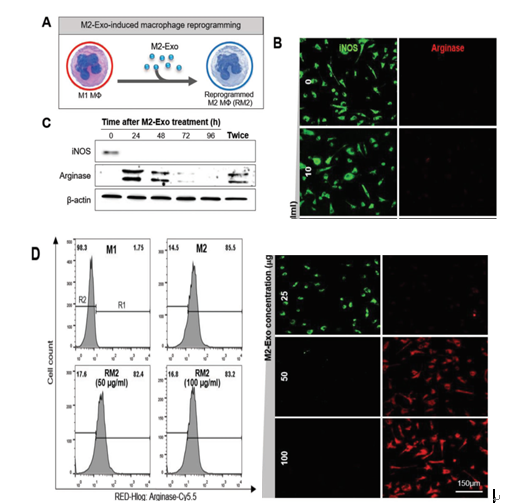
A)M2-Exo诱导的Mϕ重编程插图。
B)iNOS和Arginase在M1 Mϕs中分别与10、25、50和100 µg mL -1的M2-Exo 孵育24小时后的免疫染色。
C)随时间推移用50 µg mL -1的M2-Exo 处理的M1 Mϕ的蛋白质印迹分析。D)FACS直方图,显示了用50和100 µg mL -1的M2-Exo 处理的M1 Mϕ的重编程效率
三、鉴定与M2引导Mϕ重编程有关的主要分子和机制
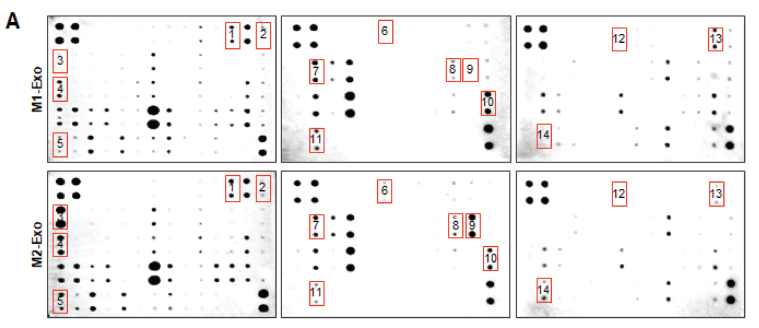
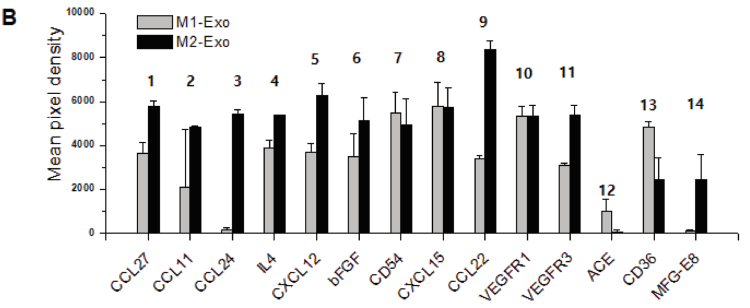
通过抗体阵列和巨噬细胞重编程主要分子的鉴定确定外泌体的细胞因子表达谱。
A)144种细胞因子抗体阵列的代表性图像。
B)比较M1-Exo和M2-Exo细胞因子的平均表达差异。
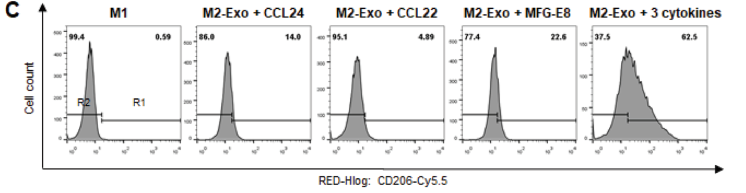
C)FACS直方图,显示了用M2-Exo(25 µg mL -1)和每种细胞因子(100 ng mL -1)处理的M1 Mϕ的重编程效率。
综上所述,M2-Exo具有关键的重编程因子以及各种伤口愈合因子,为伤口愈合应用中的M2-Exo引导的Mφ重编程提供了更多好处。
四、通过重编程的M2 Mϕs增强成纤维细胞迁移和内皮细胞管形成
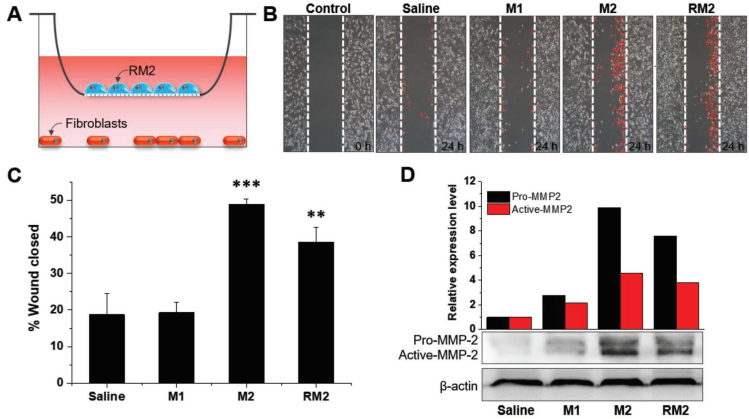
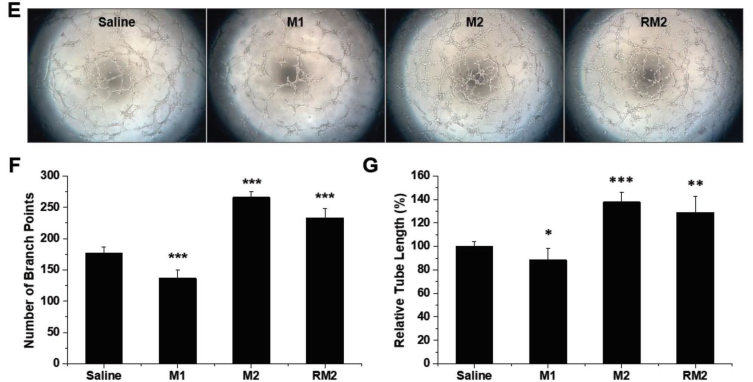
RM2 Mϕs的体外治疗作用。
A)成纤维细胞和Mϕs共培养插图。
B)与Mϕs共培养的受伤成纤维细胞的代表性相衬图像。
C)三种类型的Mϕ组中伤口闭合的定量。n = 3;** p <0.01,和*** p<0.001(相对于盐水)。
D)造成伤口后24小时,Mϕ /成纤维细胞共培养上清液中MMP-2的水平。
E)与Mϕs共培养的血管内皮细胞的管形成试验的代表性照片。
F,G)内皮细胞和Mϕs共培养后24 h的分支总数和管长的定量评估。n = 5;* p <0.05,** p <0.01和*** p 相对于盐水<0.001。
五、原位外泌体表型转换为M2 Mϕs的伤口愈合效应。
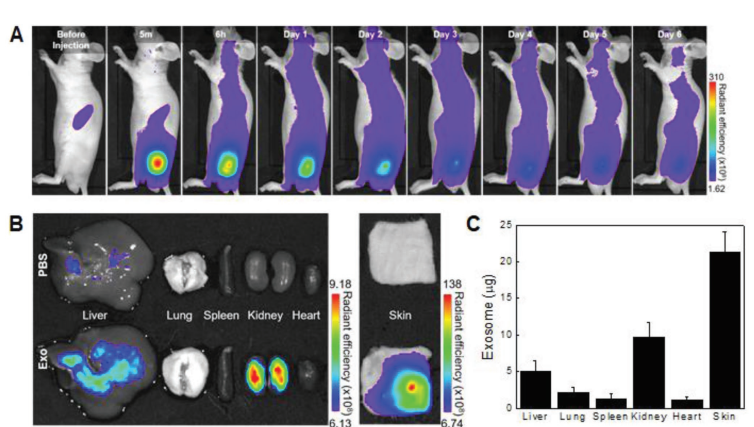
外泌体的体内生物分布。
A)Cy5.5‐NHS标记的外泌体的实时体内成像。皮下注射磷酸盐缓冲液(PBS)和每100 µL外泌体100 µg后,在指定的时间对小鼠进行分析。
B)在用外泌体处理小鼠后第2天,对皮肤和主要器官进行离体成像。
C)皮下注射外泌体后第2天,外泌体的组织分布。
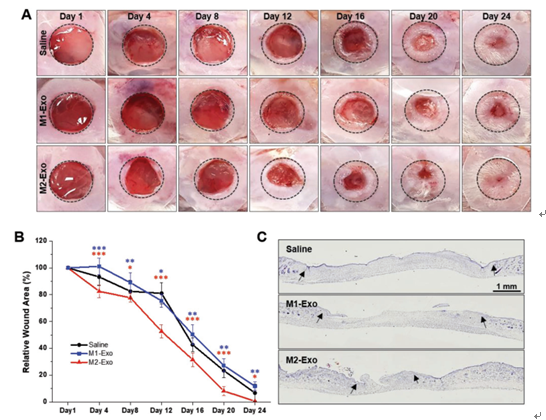
M2 Mϕs衍生的外来体促进体内伤口愈合。
A)局部注射生理盐水,M1-Exo和M2-Exo后伤口闭合的代表性图像
B)每4 d伤口后的伤口面积。n = 4;与盐水相比,* p <0.05,** p <0.01和*** p<0.001。
C)伤口后第24天注射了盐水,M1-Exo和M2-Exo的整个伤口切片的代表性照片。黑色箭头指示伤口边缘
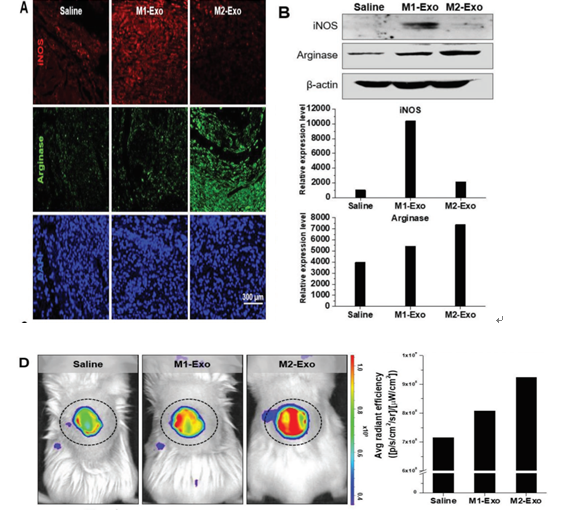
RM2 Mϕs的体内治疗作用。
A)伤后8 d小鼠皮肤组织中M1(iNOS)和M2(精氨酸酶)Mϕs的代表性免疫染色图像。
B)用PBS,M1-Exo和M2-Exo(100 µg / 100 µL)对小鼠皮肤组织中iNOS和精氨酸酶表达的蛋白质印迹分析。
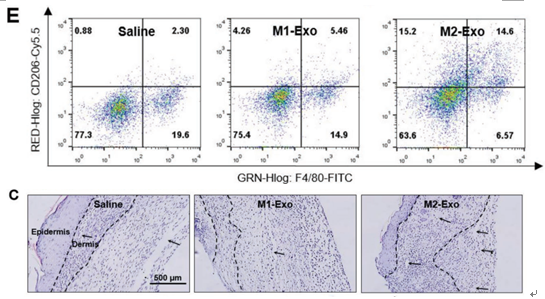
C)受伤和皮下注射PBS,M1-Exo和M2-Exo后24天伤口的代表性放大照片(H&E染色)。虚线表示真皮区域,黑色箭头表示胶原纤维。
D)使用可激活MMP-2的探针在伤口床周围的MMP-2活性的荧光图像。
E)受伤和皮下注射PBS,M1-Exo和M2-Exo后5 d伤口中M1和M2 Mϕs群体的代表性流图。
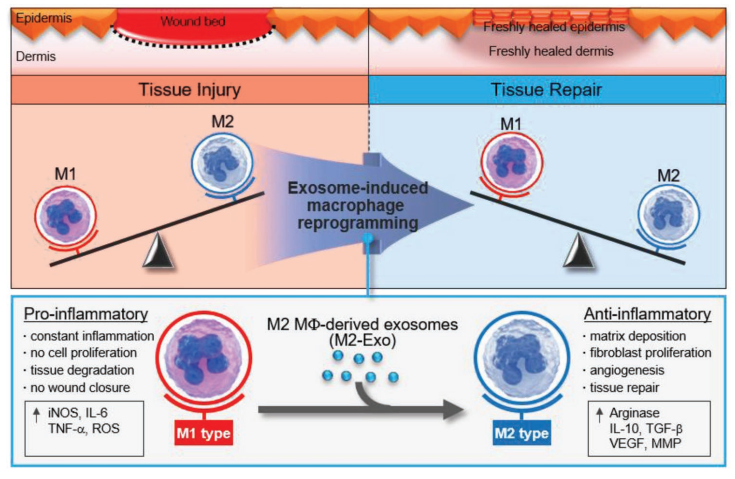
外泌体引导的巨噬细胞重编程的示意图。M2 Mϕ衍生的外泌体(M2-Exo)可以诱导M1转化为M2 Mϕs,并加速皮肤伤口愈合
matrix deposition :基质沉积 ;fibroblast proliferation:成纤维细胞增殖;angiogenesis:血管增生






