巨噬细胞特异性HIF-1α导致非酒精性脂肪性肝炎的自噬潮受损
导语:
炎性细胞活化在肝病期间驱动多种细胞程序设计。低氧诱导因子(HIFs)最近已被确定为免疫和炎症的重要调节剂。在非酒精性脂肪性肝炎(NASH)中,HIF-1α在肝细胞中被上调,并诱导脂肪变性。然而,尚未探讨HIF-1α在代谢应激下巨噬细胞中的作用。
技术路线:
1、对比甲硫氨酸缺乏胆碱(MCD)饮食喂养的小鼠和NASH患者的巨噬细胞肝巨噬细胞中的HIF-1α的水平。
2、验证HIF-1α的增加与小鼠和人类巨噬细胞中自噬标记物BNIP3,Beclin-1,LC3-II和p62之间的关联。
3、证明在巨噬细胞中稳定的HIF-1α水平的LysMCre-HIFdPAfl / fl小鼠与采用MCD饮食的HIFdPAfl / fl小鼠相比较脂肪变性和肝脏炎症情况。
4、利用体外和离体实验表明饱和脂肪酸棕榈酸(PA)诱导HIF-1α并损害巨噬细胞的自噬通量。
5、使用siRNA介导的敲低和HIF-1α在巨噬细胞中的过度表达,证明PA通过HIF-1α损害自噬。
研究结果:
1、肝巨噬细胞增加了NASH中的HIF-1α表达并损害了自噬通量。
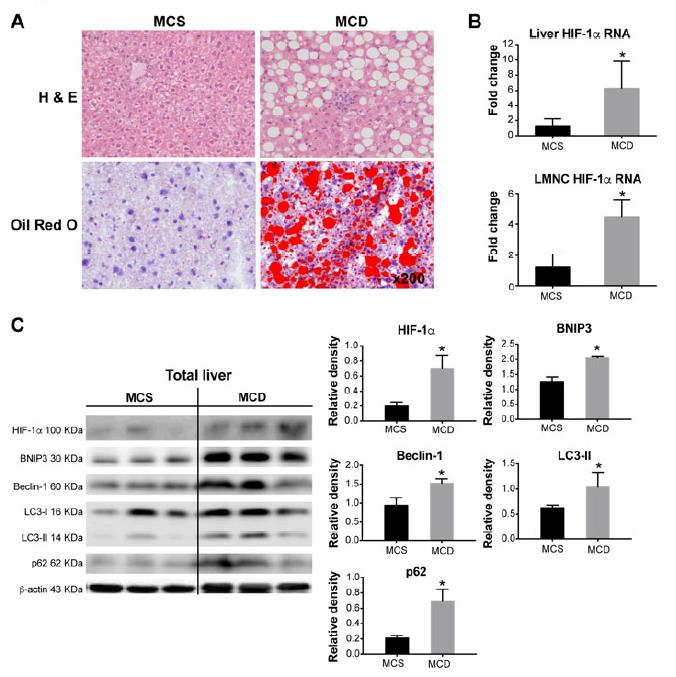
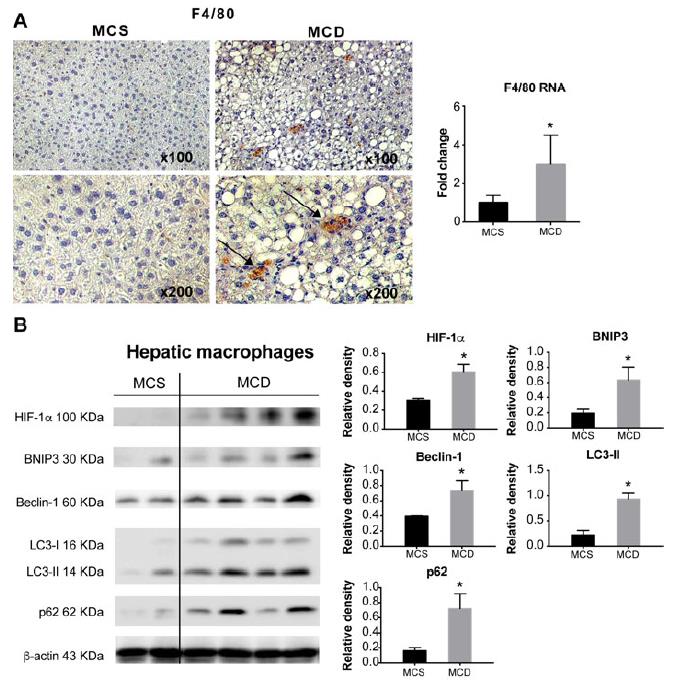
使用了MCD饮食诱导的NASH小鼠模型,以油-红-O染色和明显的坏死性炎症指示的脂肪变性显示。MCD饮食诱导的NASH的总肝脏HIF-1αmRNA水平显着增加(5倍),并且分离的肝单核细胞(LMNCs升高6倍)。饲喂HF-HC-HS饮食的小鼠表现出与MCD饮食模型相似的肝脏和LMNC中HIF-1α升高的趋势。检测到MCD饮食喂养的小鼠中HIF-1α蛋白水平显着增加,并且发现自噬标志物,BNIP3,Beclin-1,LC3-II和p62的表达与MCS对照相伴增加。与MCS对照相比,MCD饮食喂养的小鼠肝脏中F4 / 80染色证实了巨噬细胞浸润的增加。与对照组相比,NASH肝巨噬细胞中HIF-1α和自噬标志物Beclin-1,LC3-II,BNIP3和p62的含量均显着更高(图2B)。结果表明NASH中的巨噬细胞调节涉及增加HIF-1α表达和减少自噬通量。
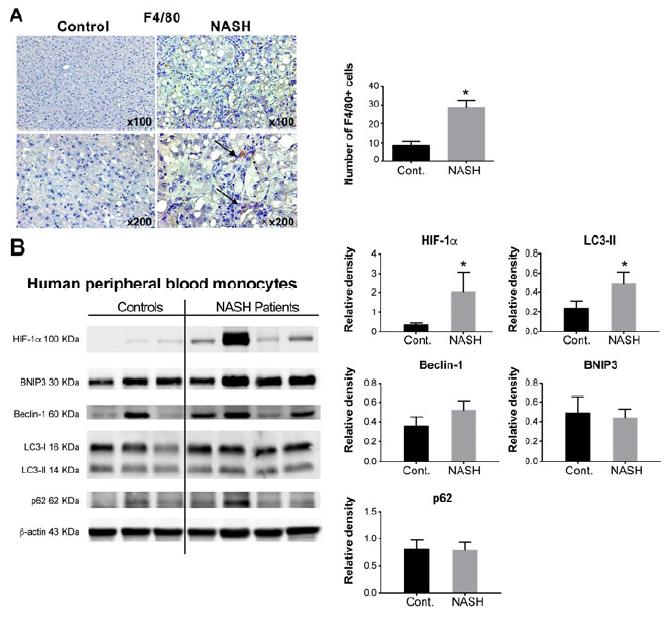
2、NASH患者的肝巨噬细胞和循环单核细胞显示HIF-1α表达增加且自噬通量受损。
在NASH患者的肝脏中,与健康对照组相比,我们检测到F4 / 80 +巨噬细胞的数量显着增加,这与在MCD饮食喂养小鼠的肝脏中的发现一致。 接下来,比较了NASH患者和健康对照组的循环单核细胞中HIF-1α的表达和自噬标记,发现NASH患者的HIF-1α和LC3-II蛋白水平升高,但BNIP3,Beclin-1和p62水平没有差异。 因此,结果表明NASH患者外周血单核细胞的自噬通量受损。
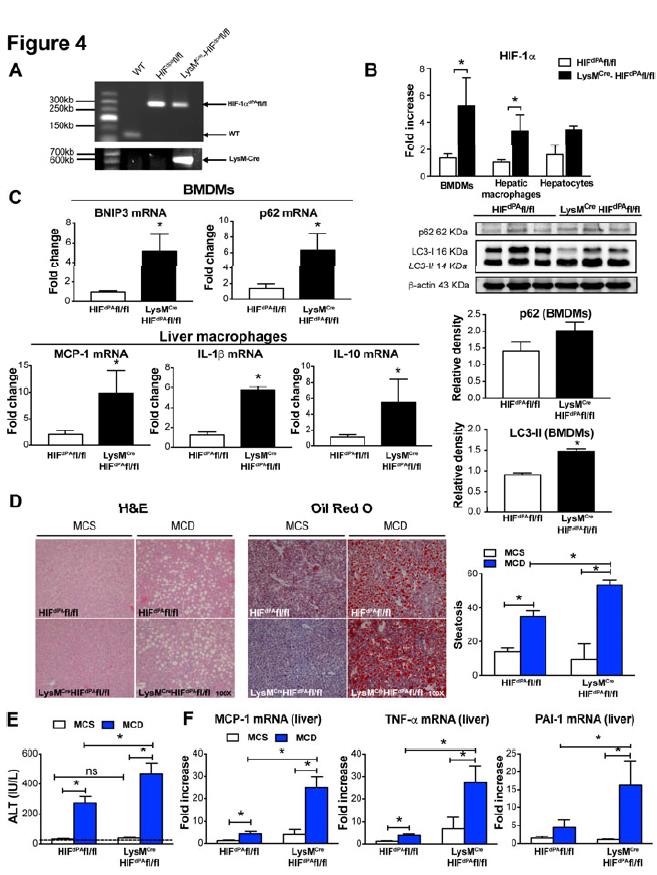
3、稳定髓样细胞中的HIF-1α可增强MCD饮食诱导的炎症和脂肪变性。
使用了LysMCreHIFdPAfl / fl小鼠,其中髓样细胞中HIF-1α的水平稳定,导致HIF-1α的水平高于野生型小鼠。使用PCR证实了LysMCreHIFdPAfl / fl小鼠和相应的对照小鼠HIFdPAfl / fl的基因型。BMDM和肝巨噬细胞中HIF-1αmRNA水平增加,但肝细胞中HIF-1αmRNA水平没有增加,这证实了HIF-1α的髓样细胞特异性增加。在来自LysMCreHIFdPAfl / fl小鼠的BMDM中,BNIP3和p62 mRNA水平以及LC3-II蛋白水平均升高。然而,p62蛋白水平并未显着增加。与HIFdPAfl / fl小鼠相比,LysMCreHIFdPAfl / fl的肝巨噬细胞中MCP-1,IL-1β和IL-10的mRNA水平增加。与HIFdPAfl / fl小鼠相比,接受MCD饮食5周后,LysMCreHIFdPAfl / fl小鼠表现出更大程度的肝脂肪变性和ALT水平。 MCP-1,TNF-α和PAI-1 mRNA水平的升高表明脂肪变性和肝损伤的增加以及肝脏炎症的发生。总之,这些结果表明,巨噬细胞HIF-1α水平的增加通过自噬通量的受损和促炎性细胞因子的增加而促进了MCD饮食诱导的NASH。
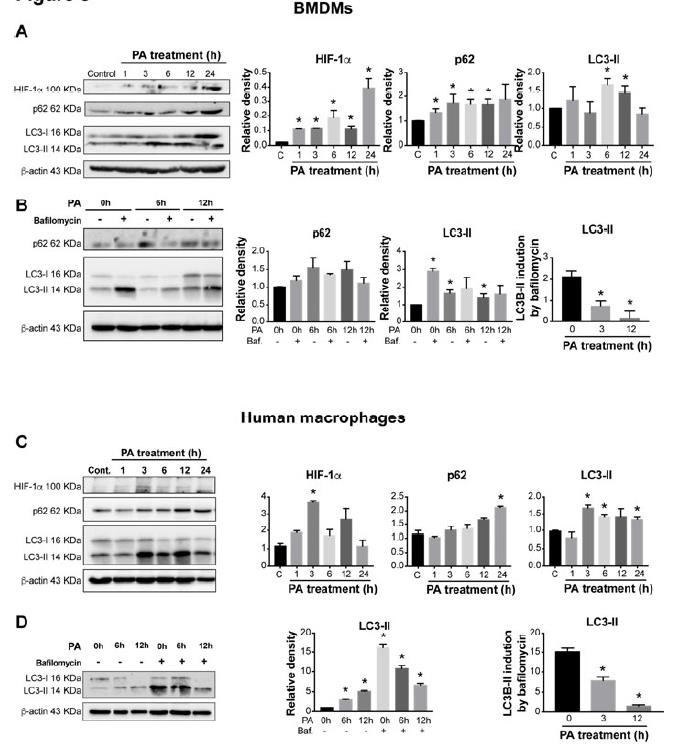
4、棕榈酸激活HIF-1α并削弱巨噬细胞自噬通量。
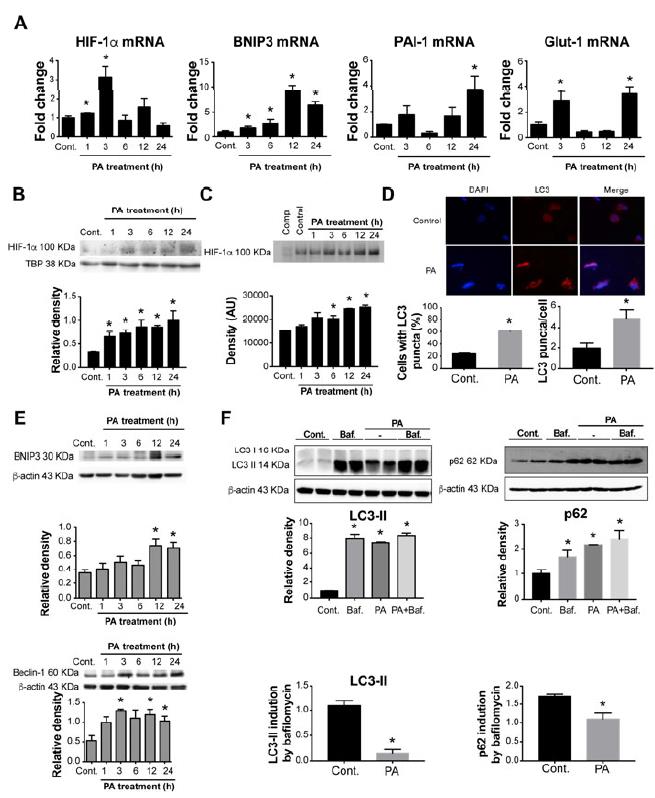
PA治疗原发性肝和骨髓源性巨噬细胞(BMDM)增加HIF-1αmRNA水平,然后上调HIF-1α靶基因BNIP3和PAI-1。BMDM中的HIF-1α蛋白水平也有所提高和PA处理后人类巨噬细胞与p62和LC3-II水平的升高相关。巴氟霉素与PA的组合不会进一步增加LC3-II的水平。将LC3-II对β-肌动蛋白的条带强度归一化,并计算了经bafilomycin处理与未处理的人类巨噬细胞的归一化LC3-II条带比率。人类THP-1巨噬细胞中的PA处理诱导HIF-1αmRNA水平迅速升高,并在3小时达到峰值,然后上调HIF-1α靶基因,BNIP3,PAI-1和Glut-1、12刺激后-24小时。HIF-1α蛋白水平和DNA结合PA处理后,人THP-1巨噬细胞中的活性也增加了。我们发现PA治疗可导致BNIP3,Beclin-1,LC3-II和p62水平显着增加巨噬细胞。使用荧光显微镜,证明了PA刺激后,具有LC3-II点状细胞的百分比显着增加,这是自噬的一种表现。bafilomycin加PA的组合并没有进一步增加LC3-II的水平。这表明自噬通量的减少以bafilomycin引起的LC3-II或p62诱导降低为代表。
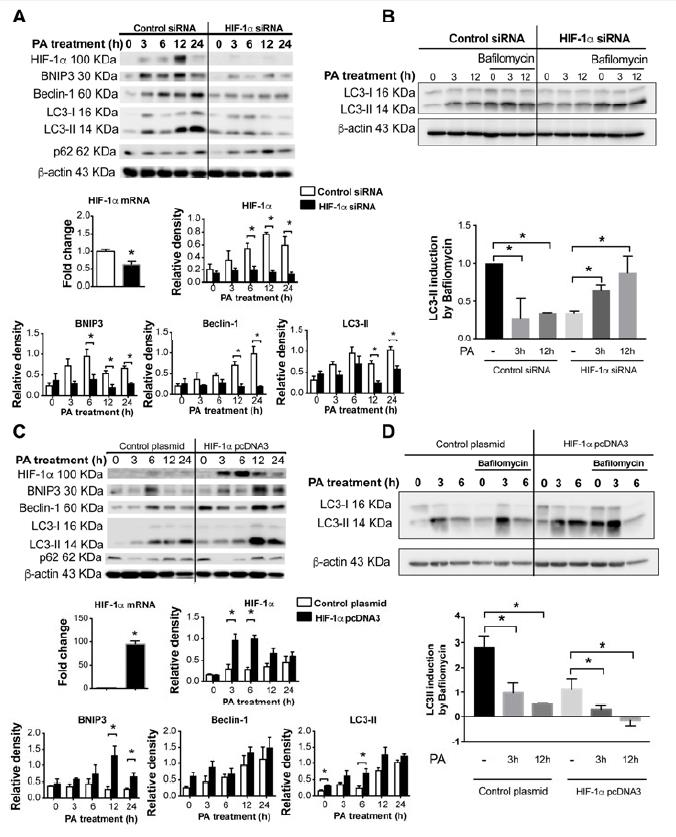
5、HIF-1α调节PA刺激的巨噬细胞的自噬。
为了测试HIF-1α是否在PA诱导的代谢应激下调节巨噬细胞的自噬,检查了其中siRNA敲低HIF-1α的巨噬细胞或通过质粒转染增强了HIF-1α的巨噬细胞。使HIF-1α沉默可防止PA诱导的HIF-1α增加,并显着下调BNIP3,Beclin-1和LC3-II表达。 HIF-1α的过表达显着增加了PA诱导的HIF-1α和自噬成分BNIP3,Beclin-1和LC3-II的水平。PA刺激后,HIF-1α诱导在6-12小时达到峰值,BNIP3,Beclin-1和LC3-II在6-24小时左右达到峰值。在巴氟霉素处理的THP-1巨噬细胞中,PA在HIF-1α敲低细胞中增加了LC3-II的诱导,但在对照细胞中则没有。 HIF-1α过表达产生相反的效果;与对照细胞相比,PA降低了过表达HIF-1α的经巴菲霉素处理的巨噬细胞的LC3-II诱导。
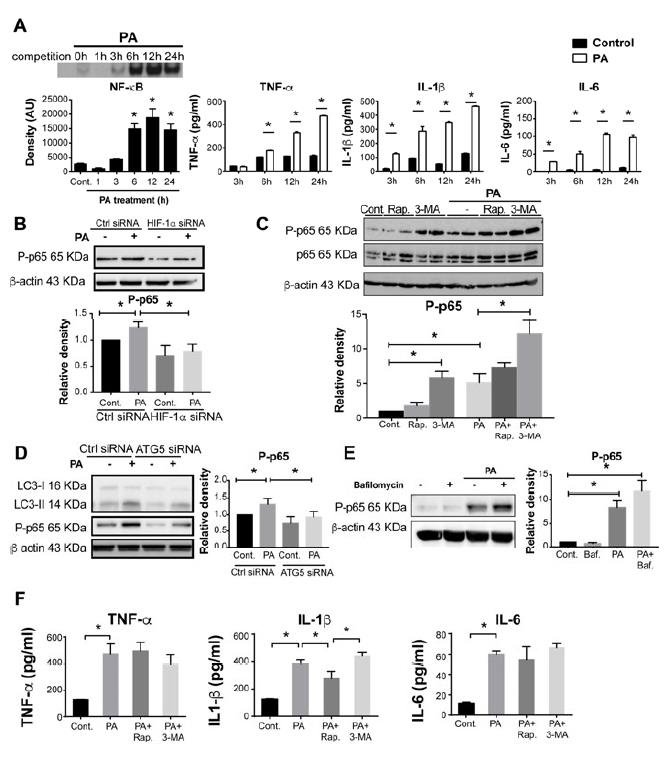
6、HIF-1α介导的巨噬细胞自噬抑制棕榈酸诱导的促炎反应并下调NF-κB活化。
PA处理后,THP-1巨噬细胞中NF-κB的DNA结合活性和促炎细胞因子TNF-α,IL-1β和IL-6的水平呈时间依赖性增加。在HIF-1α敲低的细胞中,PA诱导的p65磷酸化被完全消除,在来自LysMCreHIFdPAfl / fl小鼠的肝巨噬细胞中观察到了类似的效果,显示出增强的MCP-1和IL-1β。单独使用3-MA抑制巨噬细胞的自噬会增加NF-κB的激活,而使用3-MA加PA的治疗会进一步增强这种激活。当我们沉默负责自噬体形成的蛋白质ATG5时,我们发现未处理的细胞和用PA处理的细胞中LC3-II表达和p65磷酸化均降低。Bafilomycin治疗未能调节培养基或PA刺激的巨噬细胞中的p65磷酸化,表明自噬功能受损不会影响巨噬细胞中NF-κB的活化。用3-MA抑制自噬没有明显的附加作用。结果表明,HIF-1α参与了NF-κB的激活,巨噬细胞的促炎反应以及PA诱导的自噬的损害。
总结:
棕榈酸通过巨噬细胞中的HIF-1α激活来损害自噬。 HIF-1α和受损的自噬存在于NASH体内的小鼠巨噬细胞和人血单核细胞中。从而发现,HIF-1α激活和自噬通量减少通过上调NF-κB激活刺激巨噬细胞中的炎症。这些结果表明,NASH中的巨噬细胞活化涉及HIF-1α和自噬之间的复杂相互作用,因为这些途径促进MCD饮食诱导的NASH中的促炎性过度活化。
这篇研究表明巨噬细胞特异性HIF-1α在NASH小鼠模型中的作用。尽管MCD饮食喂养的小鼠会出现脂质蓄积,肝炎症和纤维化,但它们并未表现出体重增加或胰岛素抵抗,这在人类NASH患者中观察到。但是,我们发现NASH患者的人类血液单核细胞以及HF-HC-HS饮食的小鼠的肝脏和LMNC中的HIF-1α表达均增加,这可能暗示在HIF-1α表达增加后观察到的效应也可能存在于类人模型中。总之,在NASH中,PA对巨噬细胞中HIF-1α的激活在疾病进展中具有重要作用。巨噬细胞中的HIF-1α激活降低自噬通量并增加IL-1β的产生。 HIF-1α还激活NF-κB,这对于MCP-1表达很重要。 IL-1β和MCP-1均可引起肝脂肪变性和炎症。文章指出了巨噬细胞特异性HIF-1α在MCD饮食诱导的NASH中的重要作用。鉴于晚期NASH中普遍存在炎症,因此未来的工作应评估HIF-1α活化的巨噬细胞特异性靶向是否具有潜在的治疗应用。






