Circ-AKT3—透明细胞肾细胞癌治疗的新靶标
环状RNA(circRNA)是一种环状内源性RNA,通过特殊的选择性剪接产生,参与多种疾病的进展。然而,circRNA在透明细胞肾细胞癌(ccRCC)中的作用仍鲜有报道。因此,小编和大家分享最近发表在Molecuar Cancer上的文章“Circ-AKT3 inhibits clear cell renal cell carcinoma metastasis via altering miR-296-3p/E-cadherin signals”,从而了解Circ-AKT3在透明细胞肾细胞癌转移中的作用。

我们使用环状RNA芯片检测ccRCC中circ-AKT3的低表达。然后,应用qPCR芯片检测60例ccRCC组织及邻近正常组织中circ-AKT3的表达情况,以及在ccRCC细胞系和人正常肾细胞(HK-2)的表达情况。另外,我们在体内外研究了circ-AKT3在ccRCC中的作用,并通过Western blotting、生物信息学分析、RNA下拉实验和荧光素酶报告基因实验检测其作用机制。
结果:
1、Circ-AKT3在ccRCC中稳定低表达
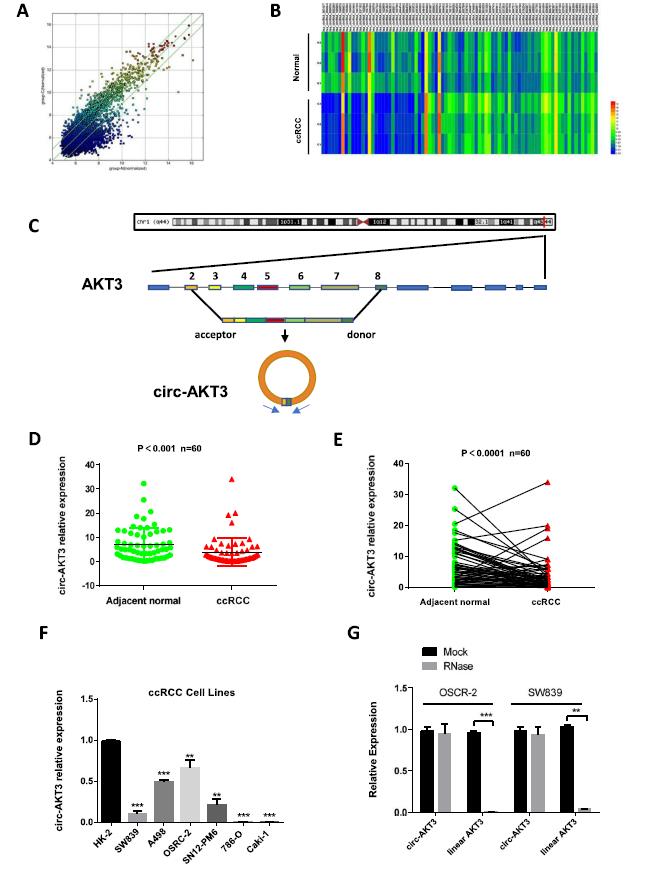
首先研究circRNA在ccRCC中的表达情况,我们使用circRNA芯片分析了3对与癌旁正常组织配对的ccRCC组织样本(图1a)。在ccRCC组织中总共有53个circRNA被显著上调,30个circRNA被下调(图1b)。然后,我们选择了10个最显著的高表达和低表达circRNA来验证它们在ccRCC组织样本和细胞系中的丰度。与正常肾组织相比,ccRCC组织中AKT3基因位点明显降低,这与circRNA芯片结果一致(图1d-e)。此外,circ-AKT3在人类ccRCC细胞系中表达下调(图1f)。通过RNase处理和qPCR检测,结果表明circ-AKT3呈环状,在细胞内稳定表达(图1g)。
2、Circ-AKT3在ccRCC细胞的迁移和侵袭过程中起抑制作用
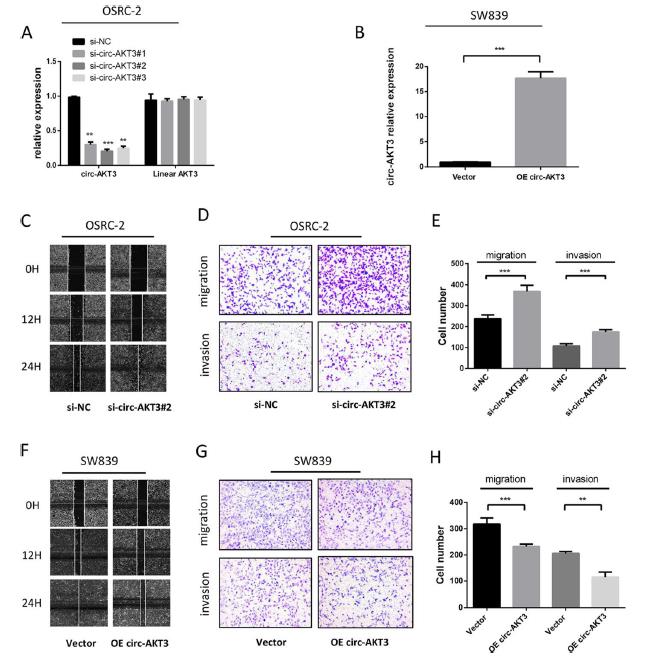
为了探索circ-AKT3在ccRCC中的作用,我们使用了三种siRNA寡核苷酸来定位这个circRNA独特的反向剪接连接。反义剪接连接的siRNAs可显著降低circ-AKT3的表达,而线性AKT3 mRNA水平未见下降(图2a)。利用Geneseed合成circ-AKT3过表达慢病毒质粒,利用qRT-PCR检测其转染效率(图2b)。在敲低circ-AKT3后,OSRC-2细胞在伤口愈合实验中显示出增强的迁移能力,反之亦然(图2c)。Transwell试验进一步证明了沉默circ-AKT3显著促进了OSRC-2细胞的迁移和侵袭(图2d,e)。与此同时,过度的circ-AKT3显著抑制SW839细胞的迁移和侵袭(图2f,h)。综上所述,circ-AKT3通过抑制ccRCC细胞的迁移和侵袭而起到保护作用。
3、Circ-AKT3通过恢复E-cadherin的表达来抑制ccRCC的迁移和侵袭
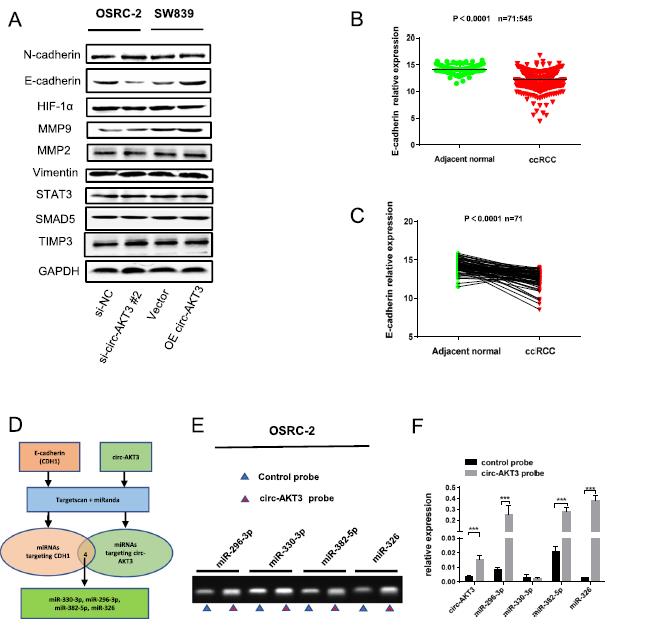
为了检测circ-AKT3在ccRCC中的具体作用机制,我们将研究重点放在了ccRCC转移相关的基因上。其中,Western blot结果显示,与转移相关的基因E-cadherin明显受circ-AKT3调控(图3a)。之前有研究表明,E-cadherin在ccRCC转移中发挥关键的保护作用。通过对TCGA数据库的分析,肿瘤组织中E-cadherin的mRNA水平较癌旁组织大多数下调(图3b,c)。
4、miR-296-3p被circ-AKT3吸收,在ccRCC转移中起积极作用
由于circRNA的功能主要是作为miRNA的海绵调节下游基因,我们接下来探讨了circ-AKT3与miRNA结合的能力。使用在线生物信息学数据库寻找靶向E-cadherin mRNA的潜在miRNA,并作为circ-AKT3海绵,预测了4种miRNA(miR-330- 3p、miR-296-3p、miR-382-5p和miR-326)(图3d)。结果表明,miR-296-3p、miR-382-5p和miR-326均被circ-AKT3海绵化(图3e,f)。
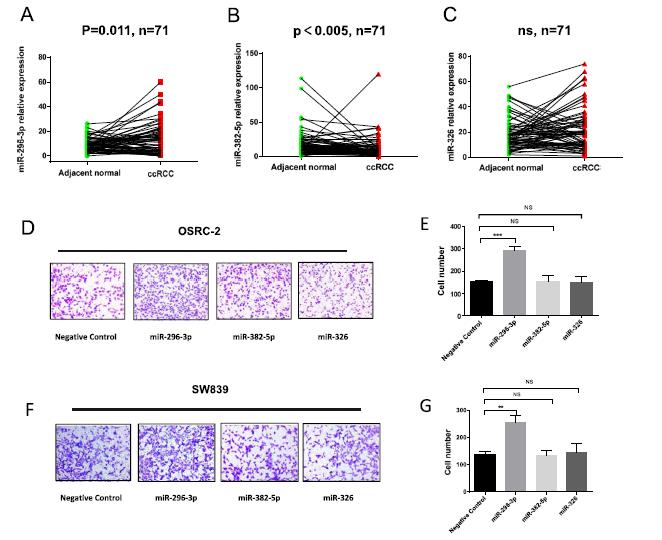
随后,我们基于TCGA数据库分析miR- 296-3p、miR-382-5p和miR-326在配对的ccRCC组织中的表达水平。结果显示,miR- 296-3p在配对和未配对的ccRCC组织中表达增加(图4a)。然而,miR-382-5p在ccRCC组织中表达下降(图4b),而miR-326在ccRCC组织与邻近正常组织中无显著差异(图4c)。Transwell实验被用来确定miRNA在ccRCC转移中的作用。结果表明,只有miR-296-3p促进了ccRCC细胞的迁移(图4d-g),而其他两个miRNA对ccRCC细胞的迁移没有影响。因此,这些结果表明,miR-296-3p在ccRCC细胞的转移中发挥了积极作用,circ-AKT3充当了miR-296-3p的海绵。
5、miR-296-3p介导circ-AKT3依赖性的E-cadherin表达和细胞迁移侵袭
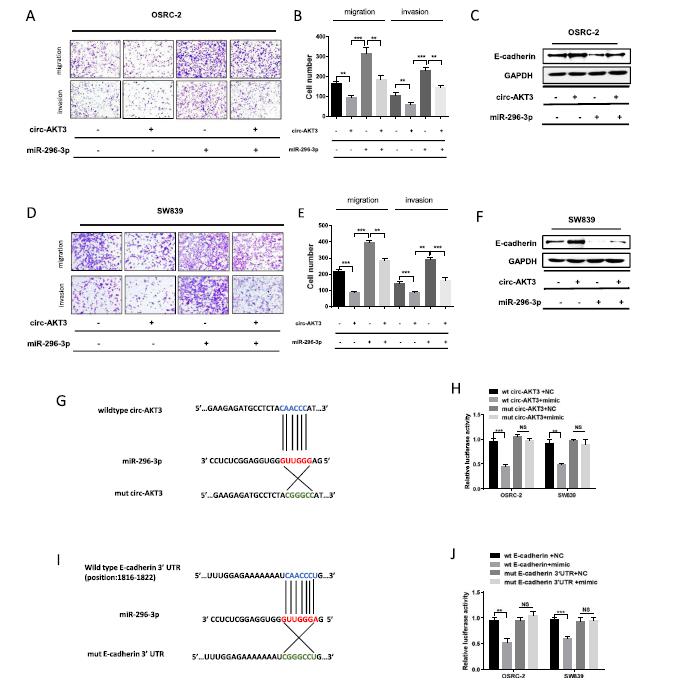
为了研究circ- AKT3与miR-296-3p在ccRCC细胞中的功能相互作用,我们使用Transwell实验进行了挽救实验。我们发现,miR-296-3p模拟物促进了OSRC-2细胞的迁移和侵袭,可以通过添加circ- AKT3来挽救(图5a,b)。此外,miR-296-3p模拟物显著抑制了E-cadherin的表达,而转染circ-AKT3过表达质粒后,这种作用可以逆转(图5c)。在SW839细胞中重复进行Transwell分析和western blotting分析,结果与OSRC-2细胞一致(图5d-f)。
为了确定预测的circ-AKT3序列中miR-296-3p结合位点是否对其相互作用至关重要,我们将预测结合位点中circ-AKT3的野生型和突变序列插入荧光素酶报告载体pmirGLO中(图5g)。结果表明,转染野生型序列的OSRC-2和SW839细胞的荧光素酶活性显著降低,而转染突变型序列的细胞与对照组相比没有差异(图5h)。这些数据表明,circ-AKT3可能通过预测的结合位点作为miR-296-3p的海绵。接下来,为了确定miR-296-3p是否可以与E-cadherin mRNA 3’-UTR结合,我们构建了含野生型Ecadherin 3'-UTR和具有潜在位点突变的3 '-UTR的报告质粒(图5i)。如图5j所示,miR-296-3p模拟物可降低转染含有野生型E-cadherin mRNA 3’-UTR序列质粒的细胞的荧光素酶活性,而转染miR-296-3p结合位点突变的组未见此效应,表明miR-296-3p直接在预测的结合位点与E-cadherin mRNA的3’-UTR结合。综上所述, circ-AKT3通过充当miR-296-3p的海绵,在一定程度上抑制了E-cadherin mRNA的降解,从而抑制了细胞的迁移和侵袭。
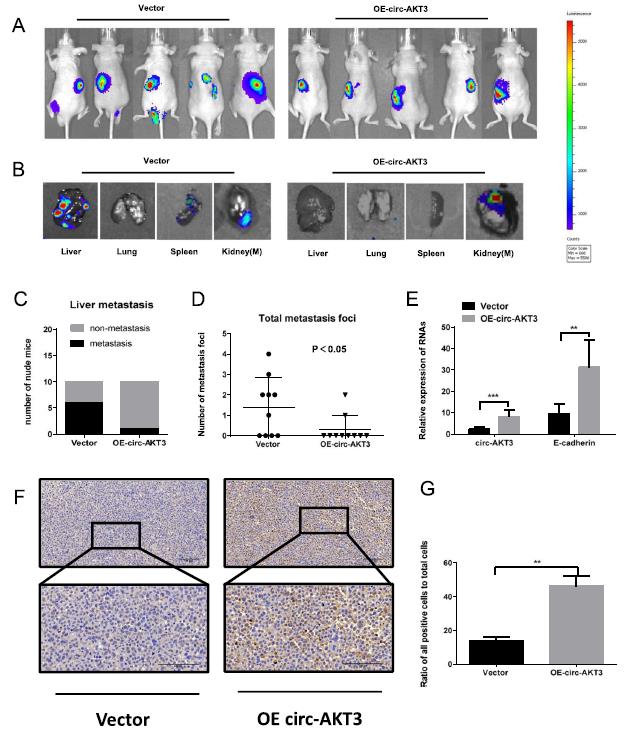
6、circ-AKT3的修复抑制了ccRCC的体内转移
进一步的体内研究是为了确定circ-AKT3的强制表达对ccRCC转移的调节作用。将稳定表达荧光素酶的细胞感染circ-AKT3过表达慢病毒,经puromycin筛选后,将OSRC- 2-luciferase-circ-AKT3或OSRC-2-luciferase-vector细胞注射到BALB/c裸小鼠肾包膜下。与载体组相比,注射过表达circ-AKT3细胞的裸鼠转移灶较少(图6a-d)。此外,与对照组相比,OE-circ-AKT3组的E-cadherin表达水平明显上调(图6e)。免疫组化结果显示,与对照组相比,在OE-circ-AKT3肿瘤中,E-cadherin表达明显增强。综上所述,这些结果表明circ-AKT3的强制表达能够有效抑制ccRCC在体内的转移。
结论:
Circ-AKT3通过竞争性结合miR-296-3p来抑制E-cadherin的表达,从而抑制ccRCC的转移。因此,Circ-AKT3可以作为一种新的治疗手段,更好地抑制ccRCC的转移。






