外泌体介导的铁离子转运调节铁死亡抗性
研究背景:
铁死亡是新发现的一种程序性细胞死亡方式。它是2012年研究人员通过筛选发现小分子化合物erastin介导的一种特殊细胞死亡方式。它的基本特征包括脂质活性氧聚集和依赖于铁。在细胞形态和分子机制上,铁死亡与细胞凋亡有显著区别。铁死亡发生时,线粒体发生皱缩、膜密度增加和膜完整性收到破坏。铁螯合剂能抑制铁死亡,而其他凋亡、自噬相关抑制剂无法抑制铁死亡。在病理性的细胞损伤和癌症中,铁死亡都扮演了重要的角色。
铁死亡中的很多分子机制尚未明确,不同细胞间的铁死亡抗性为何不同也存在巨大疑问。在近期发表于Development Cell上的Prominin2 Drives Ferroptosis Resistance by Stimulating Iron Export [1]一文为这些问题提供了新的答案。
当上皮细胞,即那些在体腔表面排列的上皮细胞,脱离被称为细胞外基质(ECM)的支架状蛋白的网状结构时,就会引起细胞死亡。在之前的研究中,该文作者发现了细胞外基质去除(ECM detachment)后会促进铁死亡的发生[2]。但在该条件下,仍有细胞能够存活。于是作者通过RNA-seq找到了ECM detachment条件下表达显著上调的Prominin2(PROM2)(图1A)。并提出猜想:PROM2与铁死亡抵抗相关。
本文技术路线:

作者首先证明了铁死亡诱导了PROM2的表达,结果如图1所示。在乳腺癌细胞系MCF10A和Hs578t中,GPX4共价结合抑制剂RSL3处理能显著上调PROM2的表达(图1D)。同时,铁死亡抑制剂ferrostatin-1的处理能显著回复干扰PROM2后的ECM detachment细胞死亡增多(图1C)。
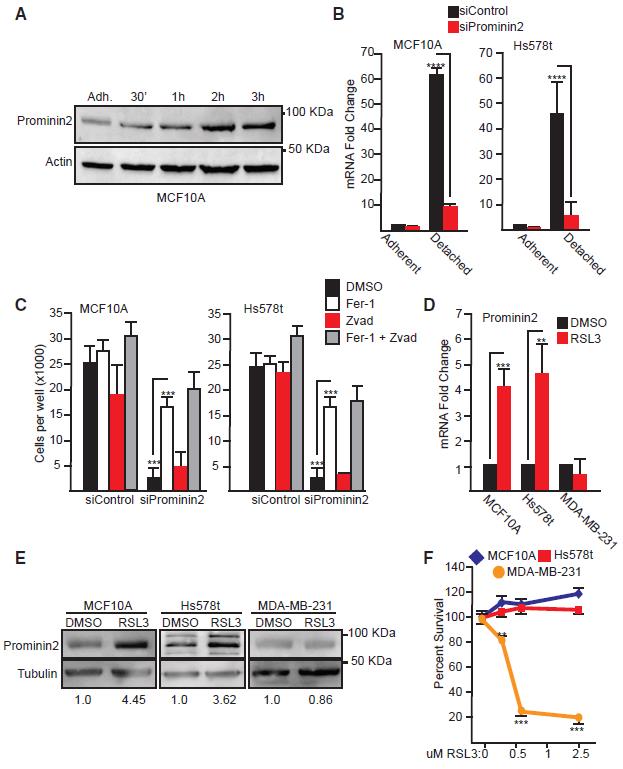
图1 Prominin2是铁死亡响应蛋白
接下来作者检测了PROM2是否影响铁死亡。在MCF10A和Hs578t细胞中使用不同类型的铁死亡激活剂处理后,敲低PROM2能显著增加细胞的铁死亡敏感性(图2A-B)。而过表达PROM2则有相反的效果(图2D)。
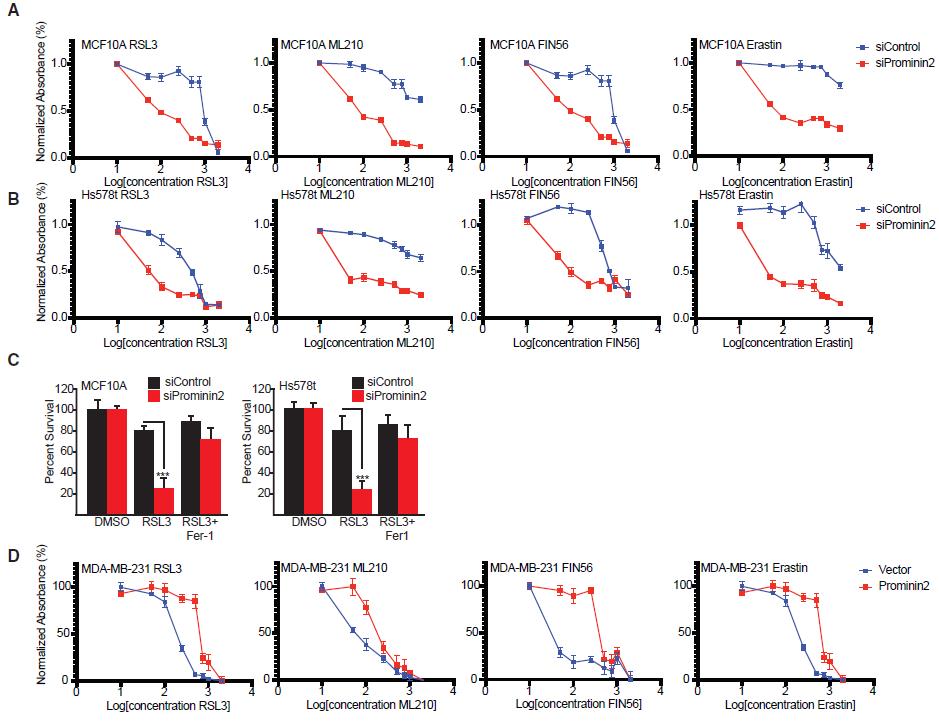
图2 Prominin2能提升铁死亡抵抗能力
在发现这些表型后,作者开始探究PROM2调节铁死亡的分子机制。免疫荧光检测铁死亡过程中PROM2的细胞定位结果显示:PROM2与multivesicular bodies (MVBs)分子标志TSG101共定位。干扰PROM2后,MVBs的形成收到阻碍(图3D-E)。同时,作者也证实了MVBs的形成是细胞逃逸铁死亡所必须的。
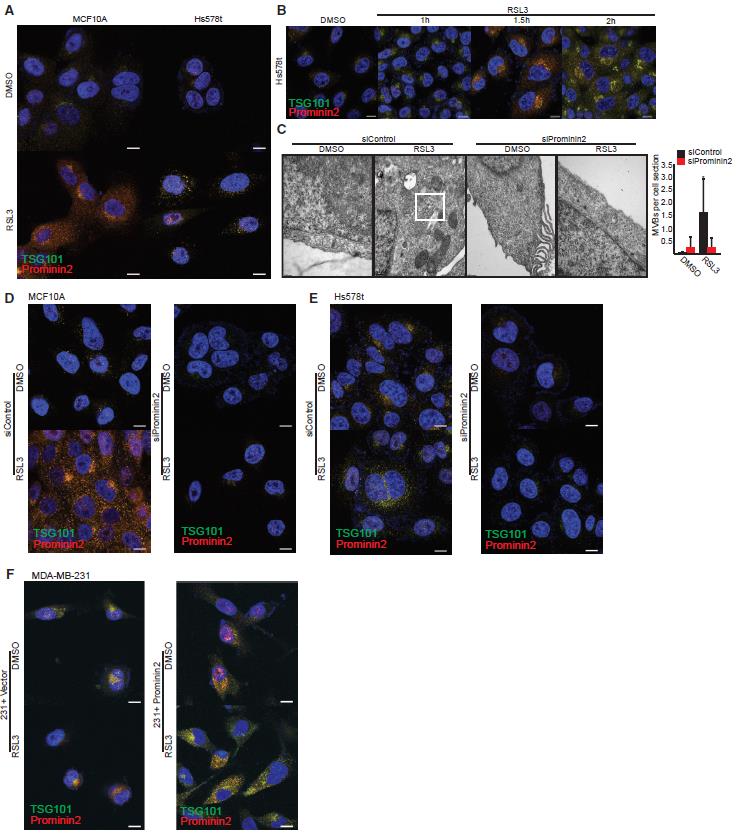
图3 在抑制GPX4诱导铁死亡的情况下,Prominin2促进MVBs的形成
作者猜想该过程中MVBs转运了某种促进铁死亡的因子至细胞外从而促进了铁死亡抵抗。同时前人报道了铁储存蛋白ferritin能通过外泌体转分泌到细胞外[3]。因此作者提出了外泌体转运ferritin至胞外抑制铁死亡的假说。实验结果表明,RSL3处理激活铁死亡后,阻断PROM2或ferritin能显著提升细胞内自由铁离子浓度(图4A-B)。
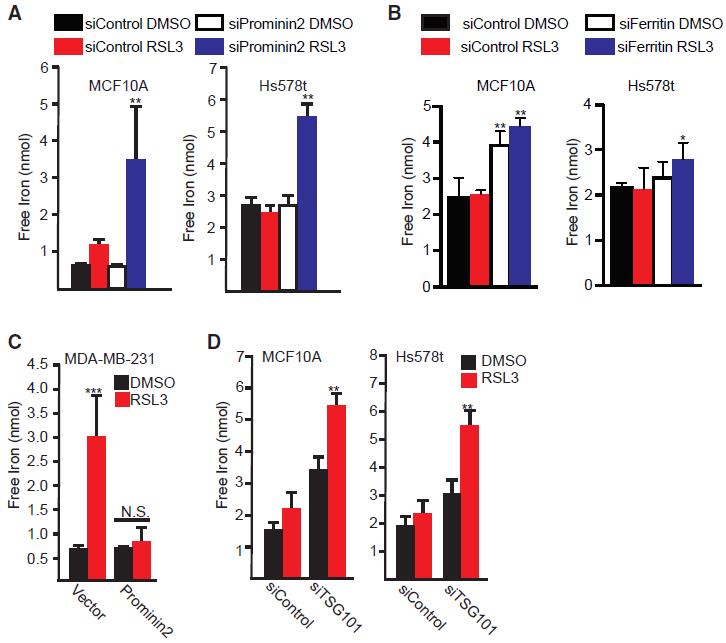
图4 Prominin2和Ferritin调节抑制GPX4后的细胞内自由铁离子浓度
参考文献:
1.Brown, C.W., et al., Prominin2 Drives Ferroptosis Resistance by Stimulating Iron Export. Dev Cell, 2019.
2.Brown, C.W., J.J. Amante, and A.M. Mercurio, Cell clustering mediated by the adhesion protein PVRL4 is necessary for alpha6beta4 integrin-promoted ferroptosis resistance in matrix-detached cells. J Biol Chem, 2018. 293(33): p. 12741-12748.
3.Truman-Rosentsvit, M., et al., Ferritin is secreted via 2 distinct nonclassical vesicular pathways. Blood, 2018. 131(3): p. 342-352.






