代谢相关新microRNA——miR-378a
代谢性疾病,如2型糖尿病或肥胖症,是机体代谢途径中断的结果。小非编码RNA——microRNAs(MiRNAs)——作为转录后基因调节因子的发现,为开发新的策略来对抗上述疾病打开了新的大门。miR-378a,miR-378a-3p和miR-378a-5p的两条链在Ppargc1b基因中编码,在如线粒体代谢和自噬等几种代谢途径的调节中起着积极的作用。最近的研究确认miR-378a是能量和葡萄糖稳态的重要调节因子,并强调它是改善代谢失调的潜在靶点。在综述“miR‑378a: a new emerging microRNA in metabolism”中,讨论了miR-378a的已有知识,并特别强调其在新陈代谢、线粒体和自噬中的生物学功能和作用机制。

一、miR-37a对代谢的调节
1.miR-378a的起源和结构
过氧化物酶体增殖物激活受体-γ(PPARγ)协同激活因子-1β(PGC-1β)由基因Ppargc1b编码并在其第一内含子中嵌入miR-378家族的两个成员(图1)。
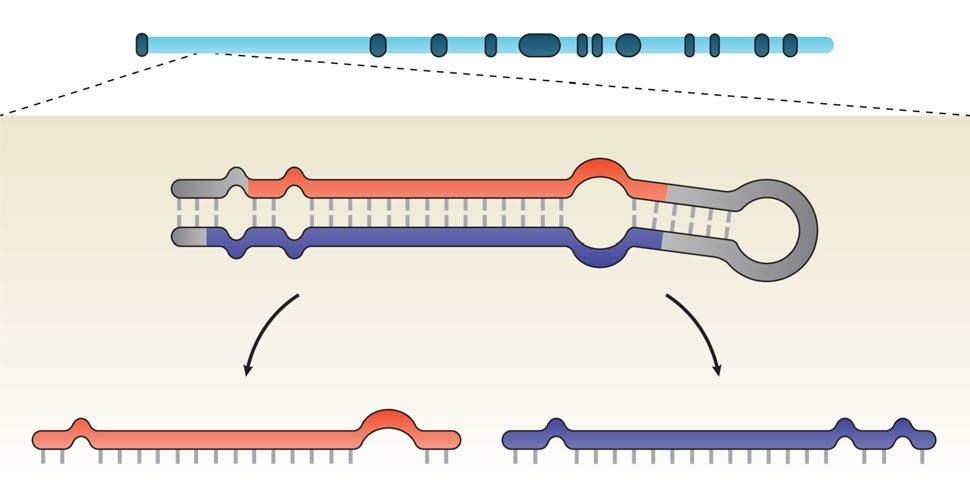
图一:miR-378a在Ppargc1b中的基因组定位。MIR-378a位于Ppargc1b的第一内含子中,其preRNA的加工产生了两条链,miR-378a-5p和miR-378a-3p。miR-378a-3p:通常被识别为miR-378,曾被命名为miR-422b。miR-378a-5p:通常识别为miR-378*。miR-378a-3p和miR-378a-5p在线粒体丰富的组织中表达,如骨骼肌、心脏、肝脏和棕色脂肪组织(BAT),且可能参与PGC-1β调控的代谢途径,如葡萄糖和系统能量稳态、脂肪酸氧化和线粒体代谢。此外,这些miRNAs还与癌症代谢和组织分化有关,例如,miR-378a通过抑制肌源性抑制因子MyoR诱导成肌细胞分化,对牛前脂肪细胞诱导分化,通过下调MAPK1诱导3T3-L1细胞分化,在棕色脂肪细胞分化过程中观察到miR-378a-3p水平升高,与先前观察到的PGC-1βmRNA水平在BAT分化和C2C12成肌细胞分化过程中升高的情况一致。
2. miR-378a在肿瘤发展中的作用
瓦尔堡效应是指在有氧条件下,癌细胞优先选择糖酵解而不是氧化磷酸化作为其主要的能量代谢途径,其主要目的是通过将糖酵解中间体引导到生物合成途径中来促进癌细胞的增殖和生长。但癌细胞的新陈代谢是收多种因素调节的,如miRNAs。
已有报道miR-378a参与肿瘤代谢、肿瘤生长和血管生成。miR-378a-5p的过度表达导致雌激素相关受体γ(ERRγ)和转录因子GA结合蛋白α(GABA PA)的mRNA水平降低,揭示了内含子miRNA直接参与其宿主基因伙伴的调节。MIR-378a-5p也被发现是乳腺癌细胞中瓦尔吧效应的主要参与者。它的过度表达有利于糖酵解途径,通过下调编码三羧酸(TCA)循环的代谢物的代谢基因,ERRγ靶向,同时减少有氧呼吸。
3. miR-378a在代谢失调中的作用
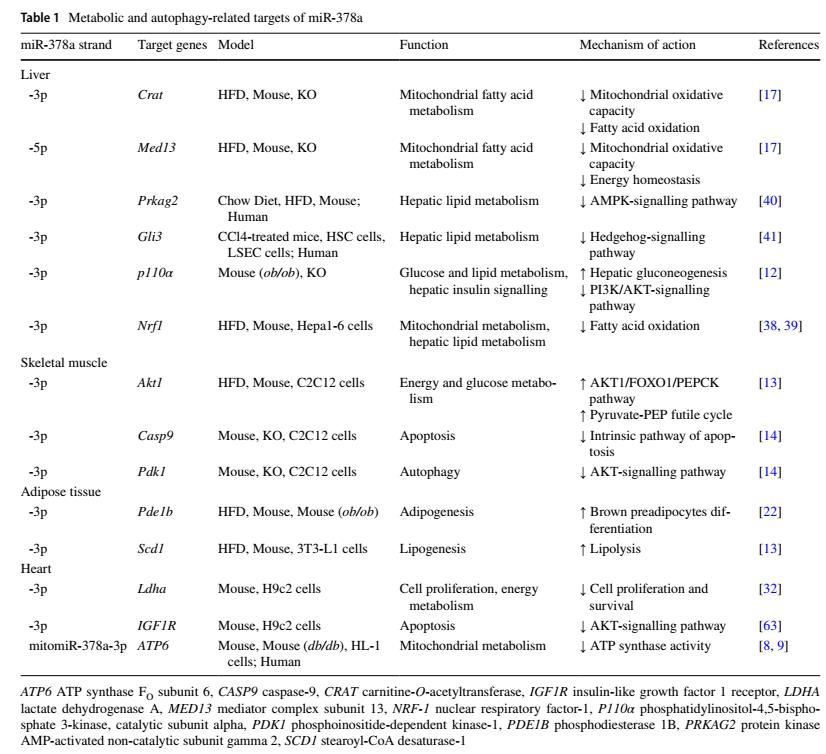
miR-378a-3p和miR-378a-5p参与了代谢紊乱的调控,被发现可干扰大量的细胞过程(表1)。
表一 miR-378a的代谢和自噬相关靶点
有研究报道,丝氨酸/苏氨酸蛋白激酶(SRPK1)的减少和增加都会通过激活AKT导致相同的致瘤表型,miR-378a对新陈代谢的调节也可能存在类似的机制。此外, miR-378a-3p在小鼠中的过表达导致骨骼肌无用循环的激活,同时改善脂肪组织中的脂解作用。进一步的实验发现Akt1是miR-378a-3p的主要靶标,被发现通过AKT1/FOXO1/PEPCK途径激活PEP-磷酸烯醇式PEP无效循环(图2A)。PEP可以直接还原为乳酸,而不是用于为无效循环提供燃料; miR-378a-3p过表达不影响乳酸水平或乳酸脱氢酶A(LDHA)转录本水平。
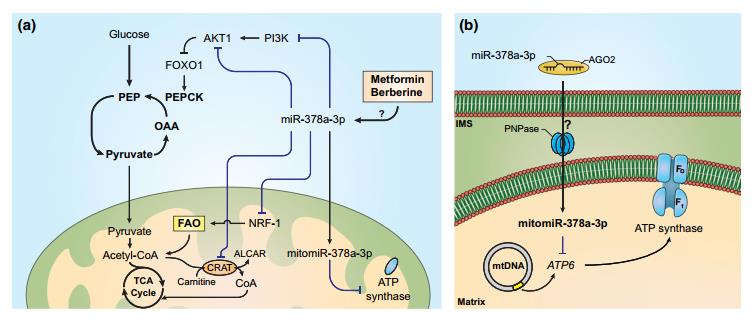
图二 miR-378a-3p对代谢和线粒体途径的调节。a miR-378a-3p在调节氧化和线粒体代谢中起着至关重要的作用,被发现能抑制胰岛素途径的重要元件PI3K和AKT1。此外,抑制AKT1刺激了骨骼肌中的Pyruvic Acid-PEP无效循环。此外,miR-378a-3p抑制了氧化代谢的关键调节因子,如NRF-1和CRAT。b miR-378a-3p转运到线粒体的模型,在其中干扰线粒体基因的转录,如ATP6。另一项研究报道miR-378a-3p靶向并能够抑制H9c2心肌细胞中的LDHA。miR-378a-3p导致葡萄糖代谢中断,导致骨骼肌的能量缺乏状态,这被证明是独立于胰岛素信号传导的。
4. miR-378a在线粒体功能障碍中的新作用
线粒体功能障碍是一些代谢性疾病的特征。miR-378a参与线粒体内氧化代谢的调控,其抑制作用被证明改善线粒体的氧化能力并增加了耗氧量;miR-378a-3p针对核呼吸因子-1(NRF-1);miR-378a-3p在HFD喂养的小鼠肝脏中上调,抑制NRF-1,导致肝脏骨质疏松症的恶化。miR-378a-3p的过度表达抑制Nrf1促进脂质积累和损害脂肪酸氧化,导致肝骨病的加重(图2A)。此外,NRF-1和miR-378a-3p似乎参与了前馈环,其中NRF-1转录抑制miRNA。miR-378a-3p还被报道是一种在HFD处理的小鼠肝脏中通过靶向其编码基因Prkag2的亚基AMPKγ2的抑制剂。miR-378a-3p似乎在纤维化中具有双重作用,它有利于肥胖小鼠的肝纤维化,而当在有肝纤维化的动物身上使用时则具有治疗作用。
1)线粒体基因组的调节因子mitomiR‑378a‑3p
成熟的miRNAs高度集中在细胞质中,但它们在细胞核或线粒体等细胞器中亦有存在。有报道称功能性miRNAs位于线粒体内,被命名为线粒体定位miRNAs(MitomiRs),并被证明在线粒体基因表达调控中具有积极作用。事实上,线粒体可以由能够干扰线粒体DNA转录的mRNA的有丝分裂因子进行内部调节。miR-378a-3p被鉴定为mitomiR(mitomiR-378a-3p),并被发现干扰编码ATP合成酶FO亚单位6的线粒体ATP6。
2)复合物I抑制剂调节miR - 378a的表达
线粒体复合物I是组成电子传递链的主要复合物之一,使其成为干扰氧化磷酸化的合适靶标。melbine是治疗T2 DM的常用双胍类药物,可抑制肝脏糖异生,继而导致肝脏葡萄糖生成减少。melbine通过特异性抑制呼吸链复合物I而发挥作用,导致细胞内AMP/ATP比值升高,从而触发AMPK及其相关信号通路的激活。isoquinoline生物碱小檗碱也被报道分别通过抑制复合物I和通过激活骨骼肌和肝脏中的SIRT1和SIRT3激活AMPKor来改善T2 DM的状况。这两种抗糖尿病化合物被证明参与了miRNAs的调节。使用锁定核酸(LNA)技术的miRNA图谱显示,在MIHA和HepG2细胞中,小檗碱处理似乎诱导了miR-378a的表达。此外,有报道melbine能够提高miR-378a-3p的表达水平。miR-378a-3p被证明是通过靶向细胞周期依赖性激酶1(CDK1)并下调这一重要的细胞分裂因子而抑制肝癌细胞增殖的重要角色,进而导致抑制肿瘤生长。这是一个值得注意的发现,因为miR-378a-3p刺激肝糖异生基因的表达,而melbine已知可以抑制肝糖异生。因此,这个问题需要进一步阐明,以了解melbine是如何上调miR-378a-3p的,以及它在多大程度上参与了melbine的作用机制。
5. miR - 378a可调节内分泌
一些细胞外miRNAs存在于血浆和血清中,甚至在健康和患病个体中表达不同。这表明miRNAs作为内分泌分子能够调节远距离靶细胞的基因表达,还可以作为疾病生物标记物的潜在用途。一些研究已经提供了证据支持细胞外miRNAs在癌症、心血管疾病或代谢性疾病中的生物学功能。最近的研究报道,在生物体液中发现miR-378a和其他几种miRNAs。例如,与1型糖尿病和中度DKD患者相比,miR-378a-5p在重度糖尿病肾病(DKD)患者的外周血液中上调。在未来,确定这些修饰是否是组织特异性的,或者它们是否是从循环中摄取miRNA并从组织中释放的结果是至关重要的。现有的研究主要集中在对某一疾病中大量的胞外miRNAs的评价,而没有对胞外miR-378a的生理功能进行详细的探讨。因此,有关miR-378a内分泌功能的一些重要问题仍需进一步探讨。
二、miR - 378a对程序性细胞死亡的调节作用
细胞存在多种死亡机制:凋亡、自噬或坏死。近年来,已发现miRNAs与自噬相关,可干扰宏观自噬途径不同阶段的组分。miR-378a可以调节细胞凋亡和自噬,有报道称转染miR-378a-3p的缺氧H9c2细胞通过降低CASP3蛋白水平而抑制凋亡并提高细胞存活率,而miR-378a-3p抑制则加剧了凋亡。胰岛素样生长因子1受体(IGF1R)被鉴定为miR-378a-3p的直接靶标,抑制AKT信号传导,从而导致促凋亡蛋白的上调,促进细胞死亡。
miR-378a在宏观自噬中的作用亦已被验证。miR-378a-3p对于维持骨骼肌细胞凋亡和自噬等细胞死亡程序是重要的。miR-378a在禁食或饥饿应激下上调,并被炎症抑制。miR-378a-3p通过抑制CASP9抑制凋亡,并通过靶向和抑制正常激活AKT的磷酸肌醇依赖性激酶-1(PDK1)来增强宏观自噬。宏观自噬可由三个与AKT相互作用的不同因子调节:FOXO1,FOXO3和哺乳动物靶标雷帕霉素复合物1(MTORC1)。一方面,miR-378a-3p导致FOXO1和FOXO3的激活,正向调节宏观自噬。另一方面,mTORC1因此被miRNA抑制,导致自噬诱导剂ULK1复合物的激活。此外,缺乏miR-378a-3p/miR-378a-5p的小鼠在腓肠肌中发现异常肿胀的线粒体堆积。评估线粒体功能以进一步证实线粒体氧化代谢受到miR-378a缺失的负面影响是很有意义的。






