标书新亮点——铁死亡
铁死亡是一种调节性细胞死亡,其特征是致命脂质活性氧物质的铁依赖性积累,有助于组织内环境稳定和多种病理,可用于治疗。然而,细胞对铁死亡的敏感性不同,一个关键的挑战是理解导致耐药性的机制。2019年11月14日发表的新研究“Prominin2 Drives Ferroptosis Resistance by Stimulating Iron Export”,该文通过结合细胞外泌体深入研究,揭示了铁死亡抗性可以由Prominin2-MVB-外泌体蛋白途径驱动,并对铁稳态、细胞内转运和癌症具有广泛的意义。

亮点:
1)前铁感受器刺激诱导蛋白Prominin2的表达
2)Prominin2促进上皮细胞和癌细胞的铁死亡抗性
3)Prominin2促进含有铁蛋白的多泡体和外泌体的形成
4)铁蛋白胞外运出细胞抑制铁死亡
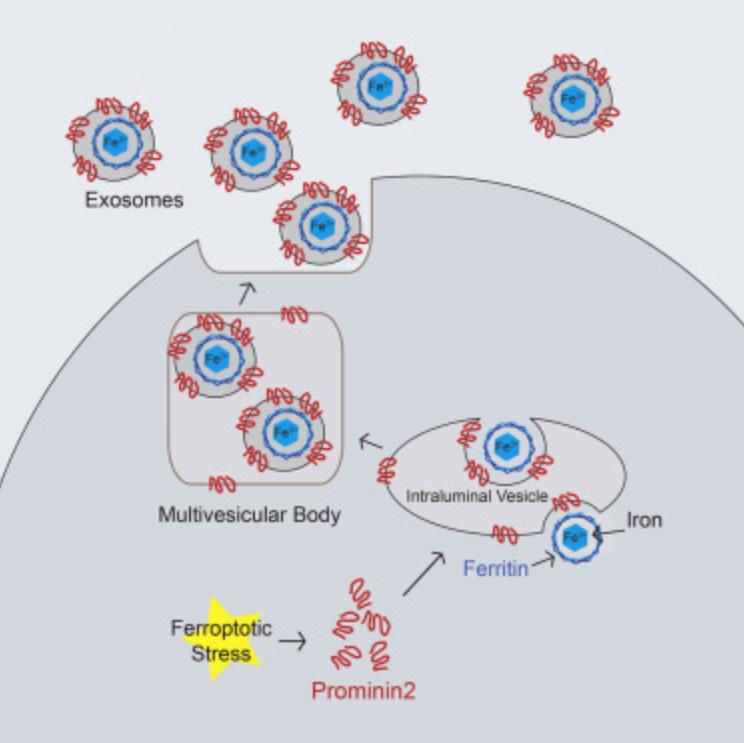
结果:
一、Prominin2由铁依赖应力诱导并促进对铁依赖细胞死亡的抗性
为了深入了解促进铁死亡抗性的机制,采用核糖核酸测序法比较了粘附和细胞外基质分离的永生化乳腺上皮细胞中的基因表达。与贴壁细胞相比,PROM2编码pentaspanin蛋白prominin2在细胞外基质分离细胞中的表达显著增加。此外,它被认为在脂质动力学和膜组织中有作用,这些过程可能与铁死亡抗性相关。经证实,在蛋白质和基因水平(图1A和1B)。在分离的和粘附的Hs578t乳腺癌细胞(图1B)。在MCF10A和Hs578t细胞中prominin2表达的沉默导致细胞外基质分离条件下生存力的显著丧失(图1B和1C)。通过与铁死亡的特异性抑制因子ferrostatin-1,但不能与泛半胱天冬酶抑制剂ZVAD-fmk共同治疗 (图1C)。这些数据表明,在细胞外基质脱离后未能上调PROM2可能导致铁死亡。
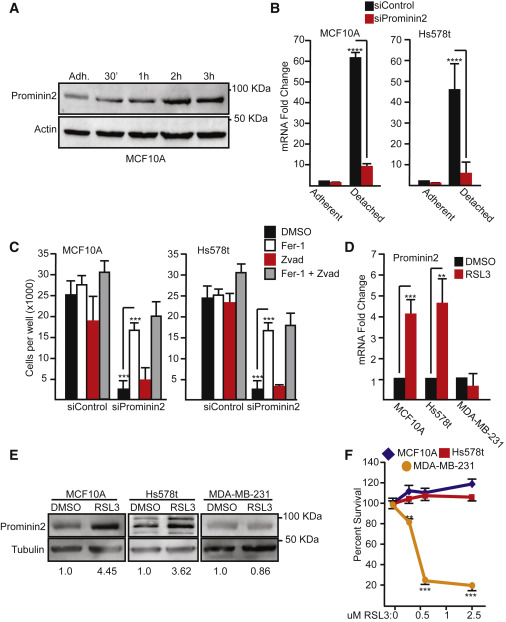
图1Prominin2是一种铁死亡应激反应蛋白
我们接下来研究GPX4的药理学抑制是否改变了粘附细胞中的prominin2表达并影响了铁死亡。MCF10A和Hs578t细胞用共价GPX4抑制剂RSL3处理2 h,导致两种细胞系中prominin2 mRNA和蛋白质表达增加(图1d和1E)。与MCF10A和Hs578t细胞不同,RSL3在另一种乳腺癌细胞系MDA-MB-231细胞(图1d和1E)。prominin2表达的诱导与GPX4抑制诱导的对铁死亡的抗性相关。在高达2.5微米的浓度下,MCF10A和Hs578t细胞对arsenic bloom诱导的细胞死亡具有抗性,而arsenic bloom浓度低至0.5微米(图1f)。
对照MCF10A细胞比Hs578t细胞对这些化合物更具抗性(图2A和2B)。与两种细胞系的对照细胞相比,在prominin2敲除细胞中观察到对所有四种化合物的敏感性显著增加(图2B)。 Ferrostatin-1完全弥补了Prominin2缺失细胞中细胞活力的丧失,这表明Prominin2沉默的细胞对敏感性的提高并不是由细胞死亡的另一种模式引起的(图2C)。在MDA-MB-231细胞中,外源性Prominin2的表达足以抑制响应RSL3、ML210、FIN56和erastin (图2D)。prominin2的表达促进了对铁死亡的抗性。随后的实验使用RSL3作为原型GPX4抑制剂。
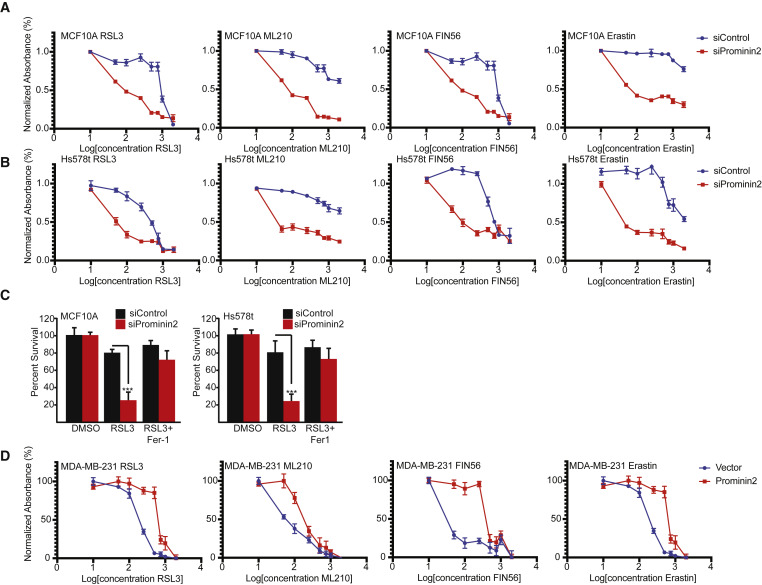
图2 Prominin2增加对铁死亡的抵抗力
二、Prominin2促进多囊体和外泌体的形成
为了深入了解prominin2如何促进铁死亡抗性,我们评估了GPX4抑制后的亚细胞定位。免疫荧光显微镜显示,prominin2定位于离散的细胞质点,以响应RSL3(图3A)。在prominin2和TSG101(多囊体的标志)之间观察到显著的共定位 (图3A)。早在GPX4被抑制后30分钟,prominin2和TSG101的共定位就很明显,这种共定位在核周区(图3B)。在后期(1.5-2小时),这种共定位在整个细胞质中是明显的。
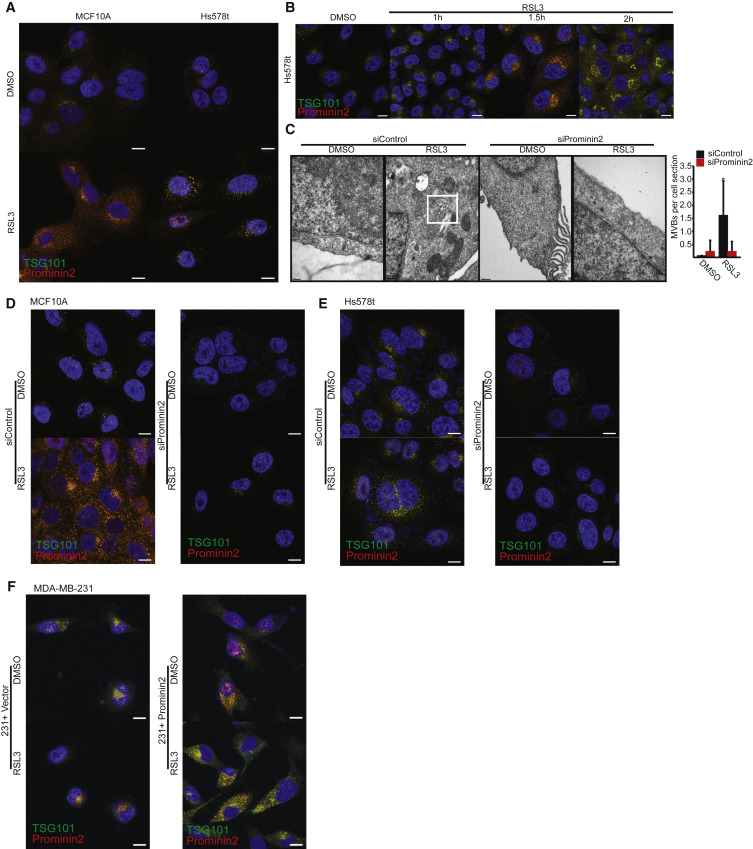
图3 Prominin2在GPX4抑制作用下促进微血管生成
上述结果促使我们评估prominin2是否响应GPX4抑制作用促进MVB的形成。RSL3处理的MCF10A和Hs578t细胞比载体对照处理的细胞含有更多的TSG101阳性结构,表明GPX4抑制诱导MVB形成(图3A、3B)。R使用透射电子显微镜(TEM)评估了这些结构的形成是否取决于prominin2。实际上,经RSL3处理的MCF10A细胞每个细胞所含的MVB比对照细胞要多得多,这在Prominin2沉默的细胞中未观察到(图3C)。免疫荧光显示,与对照细胞相比,缺失prominin2的MCF10A和Hs578t细胞中TSG101阳性点减少(图3D、3E)。相反,在MDA-MB-231细胞中外源性Prominin2的表达增加了TSG101阳性结构的数量,并且如上所述,降低了铁死亡敏感性(图3F)。与MVBs在铁死亡抗性中的因果作用一致,TSG101表达的减少增加了MCF10A和Hs578t细胞对RSL3诱导的细胞死亡的敏感性(图4A、4B)这一死亡是用ferrostatin-1(图4C)。这些数据表明GPX4的抑制刺激prominin2的表达和prominin2依赖的MVB形成,这促进了铁死亡抗性。
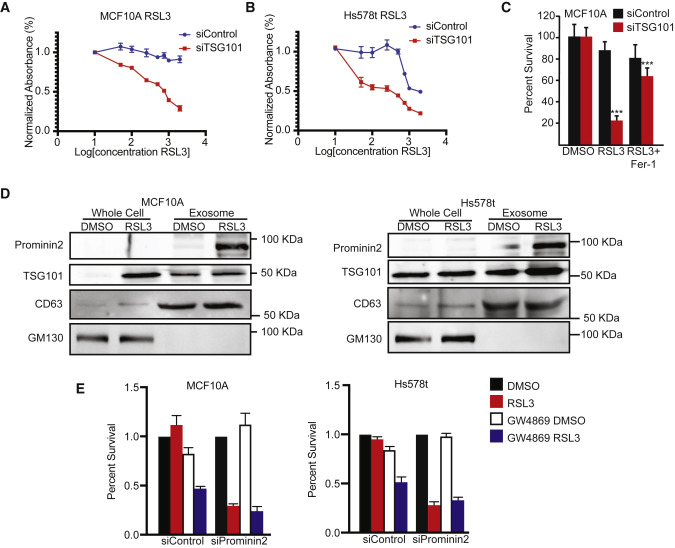
图4逃避铁死亡需要多泡体的形成
微血管中不同的ilv,与外泌体的大小一致(80纳米) 在RSL3处理的细胞中(图3C)。为了评估GPX4抑制对胞外泌体形成的影响,通过超速离心从对照(DMSO)和RSL3处理的MCF10A和Hs578t细胞中收集胞外泌体。GPX4的抑制增加了胞外泌体的形成,这可以从RSL3处理的细胞的胞外泌体制剂中存在大量蛋白质的事实来证明(图4D)。相反,对照细胞中的胞外泌体蛋白在该实验中没有检测到(数据未显示)。通过免疫印迹分析显示,这些外泌体含有prominin2、CD63和TSG101,是由prominin2依赖性MVB形成(图4D)。通过使用鞘磷脂酶抑制剂GW4869,发现抑制胞外泌体释放增加了对照MCF10A和Hs578t细胞对RSL3的敏感性,但它并不显著影响缺失prominin2细胞(图4E)。
三、MVB/外泌体铁转运有助于抗铁死亡
铁蛋白与prominin2共定位于RSL3处理的MCF10A和Hs578t细胞中,但不在载体对照(DMSO)处理的细胞(图5A)。鉴定了从这些细胞中收获的胞外泌体中的铁蛋白(图5B)。抑制GPX4后,MDA-MB-231细胞不增加铁蛋白表达。与对照细胞相比,外源性prominin2的表达诱导了在RSL3处理中铁蛋白定位的更点状模式(图5C)。
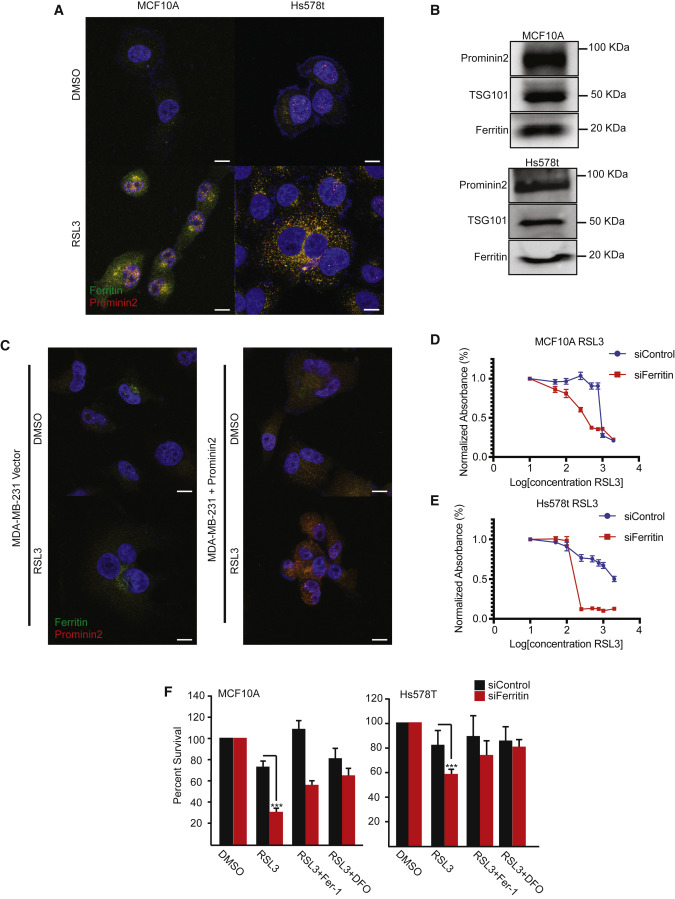
图5 Prominin2和铁蛋白有助于游离铁的调节
铁蛋白重链(FTH1)和轻链(FTL)MCF10A和Hs578t细胞中GPX4抑制引起的细胞死亡增加(图5D、5E)。铁死亡是由ferrostatin-1或铁螯合剂去铁胺(DFO)挽救的(图5F)。当prominin2或FTH1和FTL都被沉默时,Three chlorinated silica处理后游离铁浓度增加(图6A、6B)。通过响应GPX4抑制的表达prominin2的MDA-MB-231细胞中的Prominin2表达阻止了在对照细胞中观察到的响应RSL3的铁的增加(图6C)。此外,通过降低TSG101的表达来阻断MVB途径显著增加GPX4抑制后细胞内游离铁的浓度(图6D)。这些结果表明阻断MVB/外泌体介导的铁蛋白输出导致GPX4抑制时细胞内铁的积累。
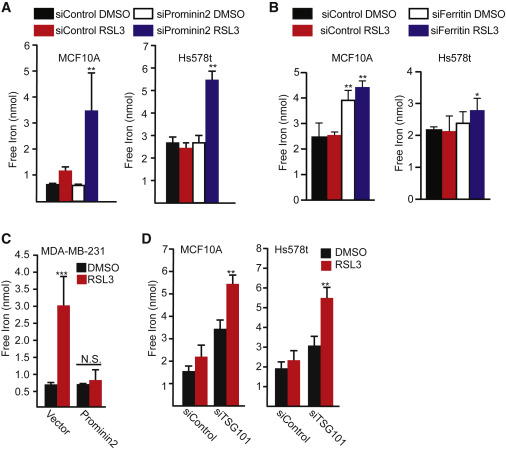
图6 GPX4抑制会改变游离铁浓度
四、细胞外基质分离细胞通过Prominin2介导的MVB/外泌体形成抵抗铁死亡
铁螯合剂去铁胺拯救了细胞外基质分离的、Prominin2缺失的MCF10A和Hs578t细胞中的细胞死亡,这与铁输出促进细胞死亡的缺陷一致(图7A)。与对照细胞相比,细胞外基质的分离增加了缺失prominin2中游离铁的浓度,这种效应在分离后2 h最为明显,这与铁死亡的开始(图7B)。与Three chlorinated silica处理的贴壁细胞相似,细胞外基质分离增加了微血管密度的频率,这种增加依赖于Prominin2(图7C)。外泌体释放通过MVB与质膜的融合来指示(图7C)。在细胞外基质分离的MCF10A和Hs578t细胞(图7D),类似于在粘附的、RSL3处理的细胞中观察到的共定位(图3A)。这些结果表明,生理性铁中毒应激可以通过prominin2/MVB铁输出途径得以逃避。
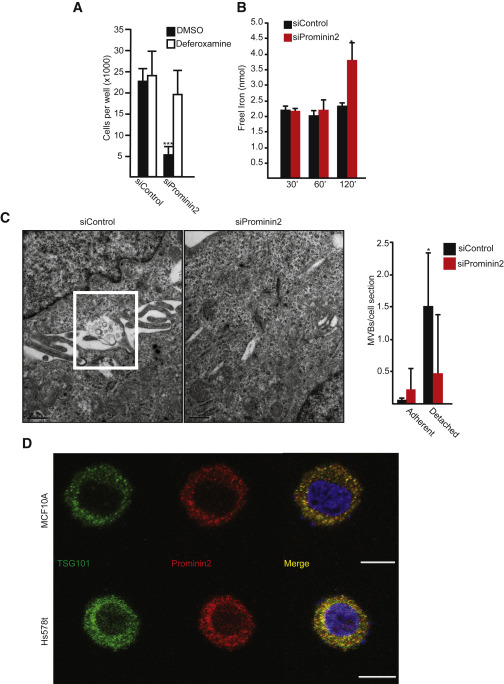
图7脱离细胞外基质诱导Prominin2依赖性MVB形成挽救铁死亡
结论:
Prominin2促进乳腺上皮细胞和乳腺癌细胞的铁下垂抗性。从机理上讲,prominin2促进了含有铁蛋白的多泡体(MVBs)和将铁运出细胞的外体的形成,抑制了铁死亡。这些发现揭示了铁死亡抗性可以由Prominin2-MVB-外体蛋白途径驱动,并对铁稳态、细胞内转运和癌症具有广泛的意义。






