METTL3介导的HDGF mRNA m6A修饰促进胃癌进展
m6A甲基化被认为是真核mRNA中最丰富、最普遍的修饰。m6A修饰的作用包括调控mRNA的稳定性、剪切、转运、定位和翻译和RNA蛋白质交互。在过去的几年中,m6A调节因子的生物学功能被报道与干细胞分化、组织发育、昼夜节律周期和肿瘤进展相关。然而,m6A的生物学意义以及其在人类胃癌(GC)中的潜在调控机制仍不清楚。那么小编为大家介绍一篇最近发表在期刊Gut上的文章:“METTL3-mediated m6A modification of HDGF mRNA romotes gastric cancer progression and has rognostic significance”。在本研究中,我们揭示了METTL3介导的m6A修饰在GC中的生物学作用,并提出METTL3可能是一种新的预测GC进展的生物标志物和治疗靶点。

结果:
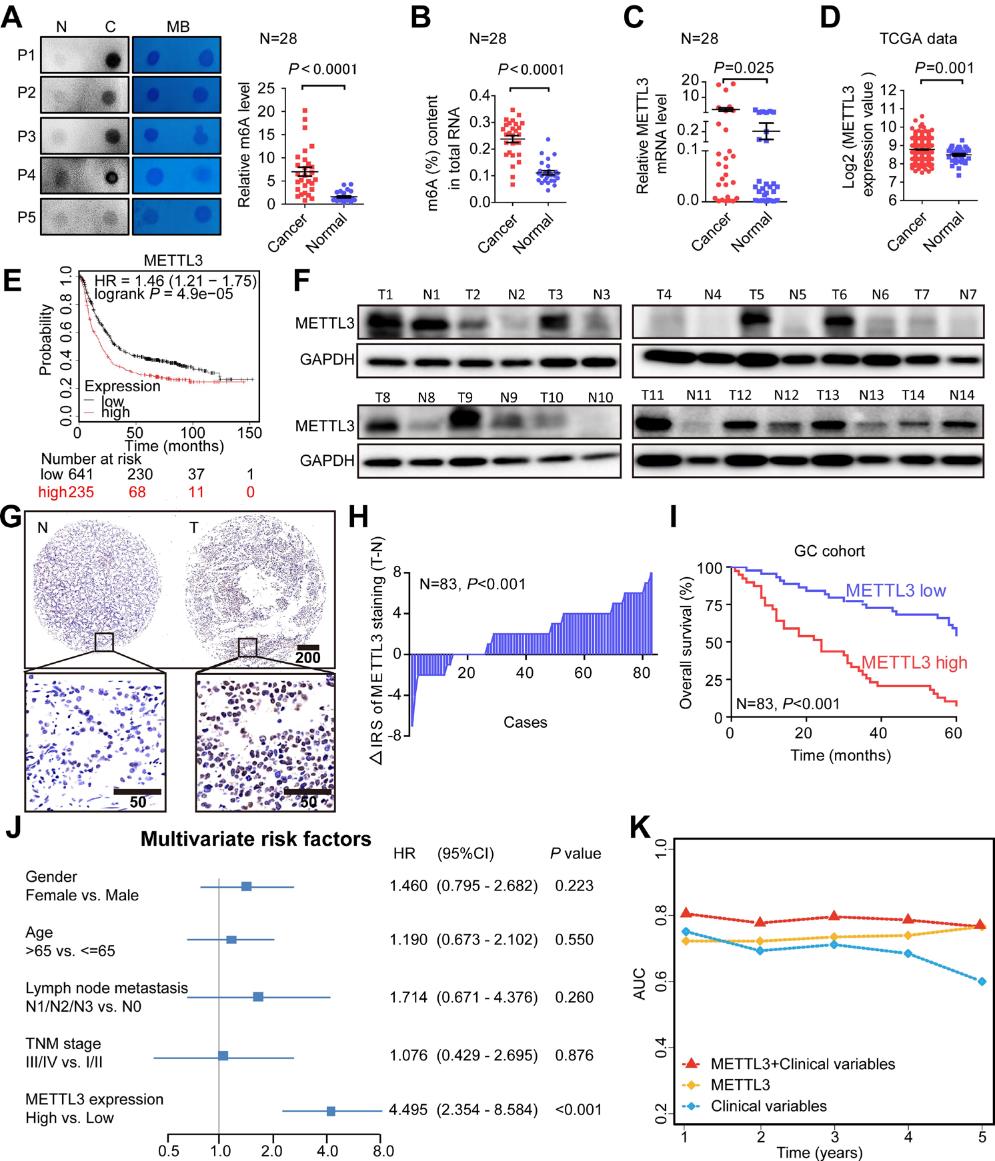
1.METTL3表达升高与胃癌患者预后不良相关
为了阐明m6A修饰在胃癌中的功能作用,我们首先检测了28个胃癌组织和正常胃粘膜的m6A RNA水平。通过dot blot和ELISA检测,我们发现GC组织中的m6A RNA水平明显升高(图1A,1B)。其中甲基转移酶METTL3在GC中显著上调(图1C,1D)。另外,我们还发现,METTL3 mRNA水平升高的GC患者总体生存较差(图1E)。与上述结果一致,经western blot检测发现,86%人胃癌组织中METTL3蛋白水平明显高于正常胃组织(图1F)。这些结果在胃癌组织芯片中得到证实,经免疫组化染色显示,胃癌组织中METTL3的表达较正常胃组织明显增加(图1 G,H)。此外,METTL3表达增高的胃癌患者5年总生存期较差(图I)。多元回归分析表明,METTL3是一个独立的预测患者的预后的标志GC(图1 J)。为了进一步评估METTL3表达的预测能力,我们进行了时间依赖的接受者操作特征曲线分析,结果显示,临床风险评分(TNM期)和METTL3风险评分的联合作用远远大于单独的GC队列中的任何一个(图1K)。综上所述,m6A修饰和METTL3水平在GC中有所升高,METTL3可能是胃癌患者的独立预后因素。
2.p300介导的H3K27ac激活GC中METTL3的转录
为了探索METTL3在GC中的高表达机制,我们首先通过UCSC基因组生物信息学位点分析了METTL3启动子的修饰。如图2A所示,在METTL3的启动子区发现大量的H3K27乙酰化(H3K27ac)信号,提示METTL3可能受染色质乙酰化调控。然后,我们用靶向P300的组蛋白乙酰转移酶抑制剂C646处理HGC-27细胞,结果显示METTL3表达明显下降,呈时间和剂量依赖性,HGC-27细胞未表现出明显的细胞毒性(图2B-D)。使用western blot检测,我们发现C646处理后H3K27ac和METTL3蛋白水平下降(图2E)。接下来,我们使用特定的siRNAs敲除P300(图2F),发现P300的敲除显著降低了METTL3的mRNA和蛋白水平(图2G,H)。此外,染色质免疫沉淀实验结果表明,METTL3的启动子区域在P300结合和H3K27ac信号中富集,P300的敲除可以显著降低METTL3启动子中H3K27ac信号的富集(图2I,J)。这些数据证实,p300介导的METTL3启动子H3K27ac活化可能是METTL3上调的部分原因(图2K)。

3.METTL3促进GC增殖和血管生成
为了研究METTL3在GC中的作用,我们建立了稳定的过表达METTL3的GC细胞(图3A)。METTL3的上调显著提高了GC细胞软琼脂菌落形成效率(图3B)和克隆能力(图3C)。我们还检测METTL3提升GC细胞增殖是否依赖于其m6A催化活性。与野生型细胞相比,催化突变的METTL3能显著降低BGC823细胞的m6A水平(图3D)。此外,METTL3的m6A催化活性对于促进BGC823细胞的克隆能力是必不可少的(图3E)。我们还建立了稳定的METTL3敲除的GC细胞。在METTL3敲除或敲除后,m6A水平显著降低(图3F)。敲除METTL3明显抑制软琼脂菌落形成效率和克隆能力(图3G,H)。另外,过表达METTL3大大促进肿瘤生长(图3 I-K)。IHC结果显示与对照相比,METTL3过表达组的肿瘤组织增加(图3L)。为了进一步研究METTL3在胃癌血管生成中的作用,我们在体外研究了人脐静脉内皮细胞(HUVEC)的生长和成管过程。过表达METTL3的BGC823细胞的条件培养基显著增加了管的形成和HUVEC生长(图3M)。我们还建立了3例不同类型的胃癌患者的器官样体模型,进一步验证METTL3的潜在临床价值。结果表明,慢病毒过表达METTL3可显著促进三种不同类型GC器官中GC细胞的增殖(图3N)。这些数据表明,METTL3可能是一种致癌基因,其m6A催化活性可促进胃癌的增殖和血管生成。
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\D}T]LJJM~K]G6GM]8[4@ASY.png](https://img1.dxycdn.com/2020/0305/322/3400262221014977144-14.jpg)
4.METTL3促进胃癌的体内外转移
为了确定METTL3在胃癌转移中的作用,我们首先在体外进行了迁移和侵袭实验。数据显示METTL3的异位表达促进了BGC823和AGS细胞的迁移和侵袭(图4A,B)。然而,在HGC-27和NCI-N87细胞中,METTL3敲除产生相反的作用(图4C)。我们进一步评估了METTL3对胃癌体内转移的影响。通过裸小鼠脾静脉注射过表达METTL3的BGC823 -荧光素酶细胞及相应的对照细胞。8周后,METTL3的上调明显促进了GC肝转移,生物荧光成像显示,与对照组相比,METTL3的上调明显促进了GC肝转移(图4D-F)。相比之下,METTL3缺乏的NCI-N87细胞显著抑制了GC肝转移(图4G,H)。总之,这些结果表明METTL3在促进胃癌转移中的关键作用。
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\C_V{2B]2A1_Y8II[0P}CCLW.png](https://img1.dxycdn.com/2020/0305/646/3400262274702070992-14.jpg)
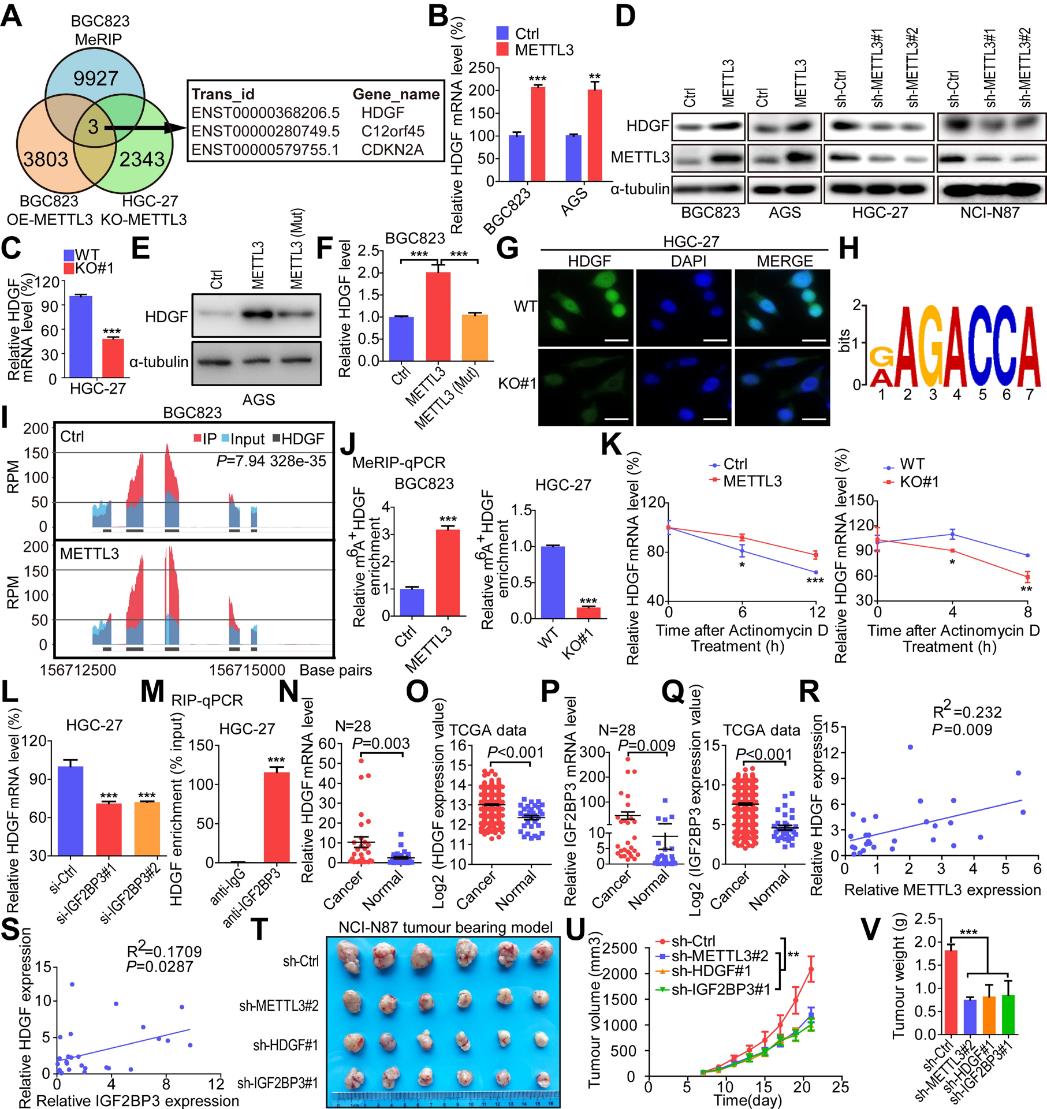
5.METTL3介导的HDGF mRNA m6A修饰维持了其依赖IGF2BP3的稳定性
为了明确METTL3促进胃癌进展的分子机制,我们对METTL3过表达和敲除的GC细胞进行RNA测序,并对METTL3过表达的GC细胞和对照细胞进行m6A修饰的RNA免疫沉淀测序(图5A)。通过分析和细胞实验确定了HDGF mRNA m6A修饰(图5B-G)。METTL3过表达的免疫纯化RNA中AGACC motif高度富集(图5H), METTL3上调时HDGF mRNA中的m6A丰度显著增加(图5I)。另外,m6A特异性抗体显著富集了METTL3过表达的HDGF mRNA,而m6A特异性抗体显著降低METTL3敲除对HDGF mRNA的富集(图5J)。考虑到m6A修饰对HDGF的mRNA水平具有正向调节作用,我们进而研究m6A修饰是否影响HDGF mRNA的稳定性。结果表明,METTL3过表达时HDGF mRNA水平高度稳定,敲除METTL3则相反(图5K)。此外,据报道HDGF是IGF2BP1/2/3的高通量测序结果的靶标之一。因此,我们探讨了IGF2BP1/2/3对HDGF mRNA稳定的影响。其中只有IGF2BP3的下调显著抑制HDGF mRNA的表达(图5L)。与IgG对照抗体相比,IGF2BP3特异性抗体在RIP-qPCR检测中显著富集HDGF mRNA(图5K)。接下来,我们比较了28个GC组织和TCGA数据中HDGF和IGF2BP3的mRNA水平。结果显示,与正常胃组织相比,胃癌组织中HDGF和IGF2BP3的表达显著上调(图5N-Q)。我们还发现METTL3和IGF2BP3的表达与HDGF的表达显著相关(图5R,S)。我们也进行肿瘤异种移植研究。结果表明,敲低METTL3、HDGF和IGF2BP3可显著抑制肿瘤生长(图5T-V)。
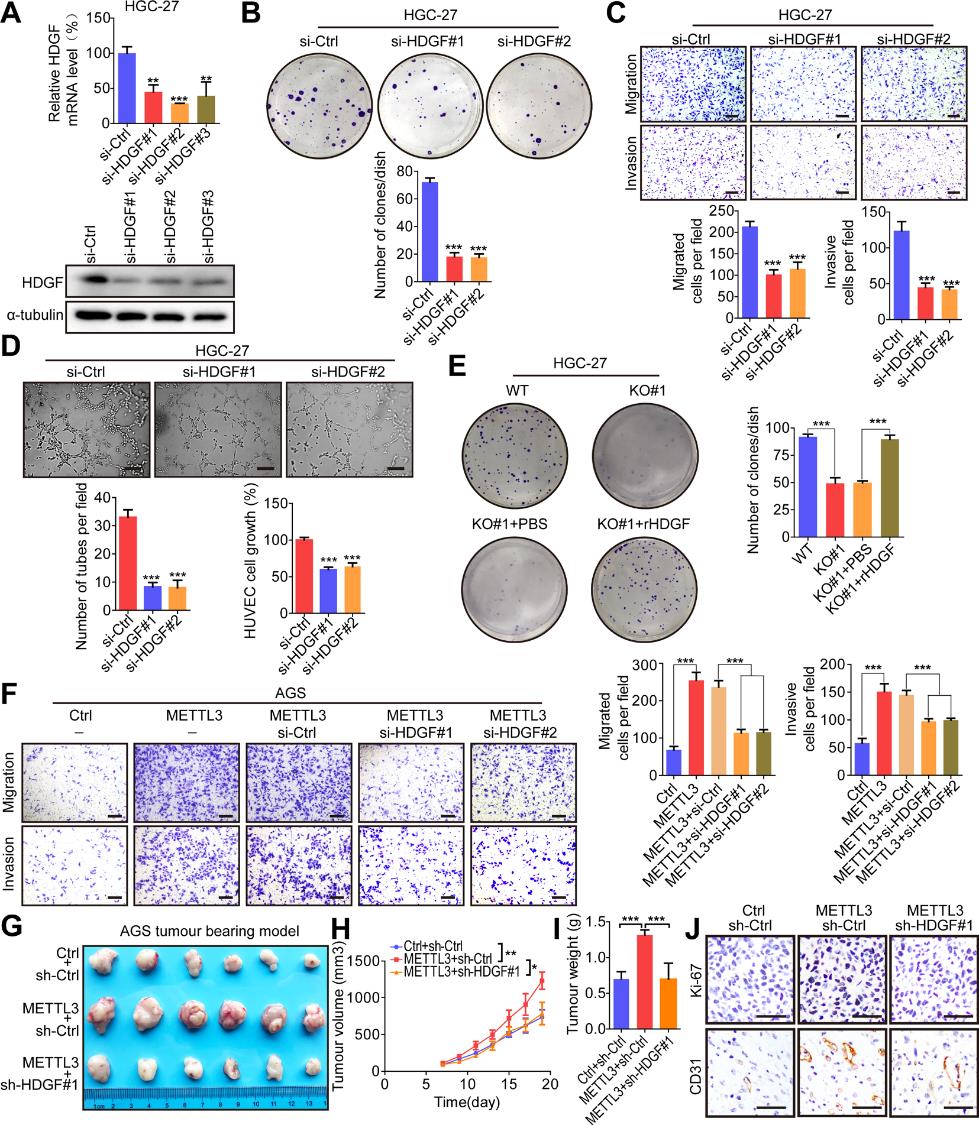
6.METTL3通过上调HDGF表达来加速GC恶性过程
为了进一步表征HDGF在GC中的致癌功能,我们设计了三种不同的针对HDGF的siRNAs,并通过qRT-PCR和western blotting证实了它们的敲除效率(图6A)。HDGF的下调显著抑制了菌落形成、细胞迁移和侵袭以及HUVEC的生长和成管(图6B-D)。此外,HDGF重组蛋白挽救了METTL3敲除GC细胞的集落形成能力(图6E)。与预期一样,在METTL3过表达的AGS细胞中,HDGF的表达被其特异性的siRNAs敲除,从而显著抑制了METTL3诱导的GC细胞迁移和侵袭(图6F)。此外,HDGF的敲低明显抑制METTL3诱导的 GC体内生长和血管生成(图6G-J)。因此,我们的数据表明,METTL3通过上调HDGF表达来促进GC恶性进展。
7.METTL3通过HDGF激活的GLUT4和ENO2的表达来促进GC中的糖酵解
我们研究METTL3是否调节糖酵解促进GC恶性过程。如图7A,B所示,上调BGC823细胞中METTL3的表达可显著增加葡萄糖摄取和乳酸的产生。为了研究HDGF是否能恢复METTL3敲除细胞的糖酵解活性,我们将HDGF过表达质粒转染到METTL3敲除细胞中。结果表明HDGF过表达可恢复METTL3敲除GC细胞的糖酵解活性,并显著增加乳酸产量(图7C)。细胞外酸化速率动力学曲线进一步表明,过表达METTL3的BGC823细胞的糖酵解活性显著增加,而敲除METTL3的HGC-27细胞的糖酵解活性下降(图7D,E)。为了进一步研究METTL3调控糖酵解的机制,我们检测了METTL3过表达和METTL3敲除的GC细胞中与葡萄糖代谢相关的基因的转录(图7F)。我们还检测了这些基因是否受HDGF调控,并检测了HDGF敲低GC细胞中与葡萄糖代谢相关的基因(图7G)。发现只有GLUT4和ENO2的表达水平主要通过上调METTL3而增强。考虑到HDGF可以在细胞核中定位并发挥转录调控作用,我们研究了HDGF是否可以转录激活GLUT4和ENO2的表达。通过ChIP分析发现,HDGF直接与GLUT4和ENO2的启动子区结合,而与HK2的启动子区不结合(图7H)。IHC结果显示,METTL3过表达导致AGS肿瘤异种移植中HDGF、GLUT4和ENO2染色明显增加,而当HDGF敲除时,GLUT4和ENO2表达明显下降(图7I)。同样,在缺乏METTL3的NCI-N87肿瘤异种移植中,HDGF、GLUT4和ENO2染色明显下降(图7J)。总之,这些结果表明METTL3/HDGF通过糖酵解途径促进胃癌的发生和肝转移。
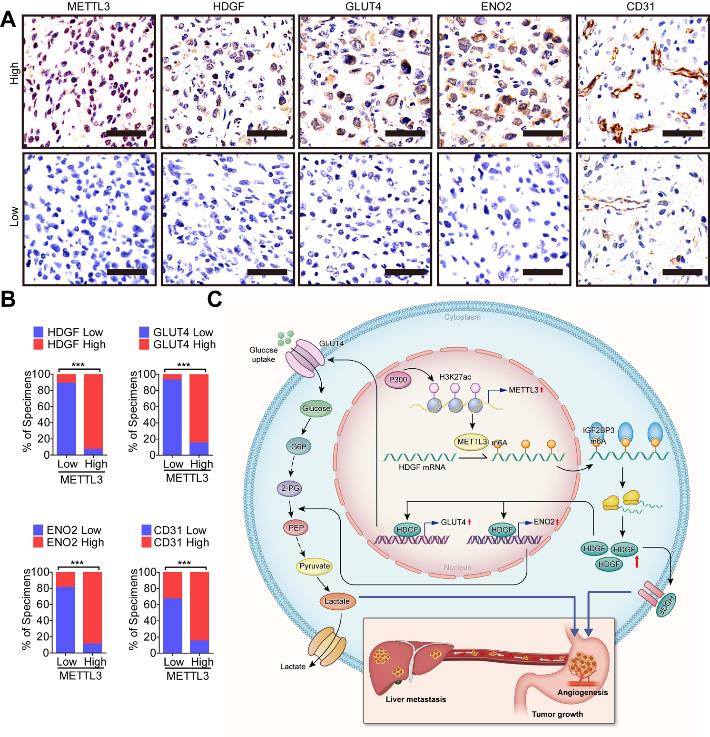
为了研究METTL3 / GC HDGF轴在促进糖酵解和血管生成中的临床意义,我们检查METTL3,HDGF,GLUT4,ENO2和CD31在GC患者癌组织中的表达。54例胃癌患者中METTL3表达与HDGF、CD31、GLUT4、ENO2表达呈正相关(图8A,B)。
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\CU}RQ(XXUB(RK]_217D~7M9.png](https://img1.dxycdn.com/2020/0305/923/3400262416436234872-14.jpg)
结论:
我们的发现揭示了METTL3在胃癌发生发展中的致癌作用。机制上,METTL3/ HDGF/GLUT4/ENO2轴通过增加糖酵解和血管生成来促进胃癌的发生和转移。另外,METTL3在胃癌中的表达明显增加,与胃癌患者预后不良有关。因此,METTL3可能是胃癌潜在的预测和治疗靶点。






