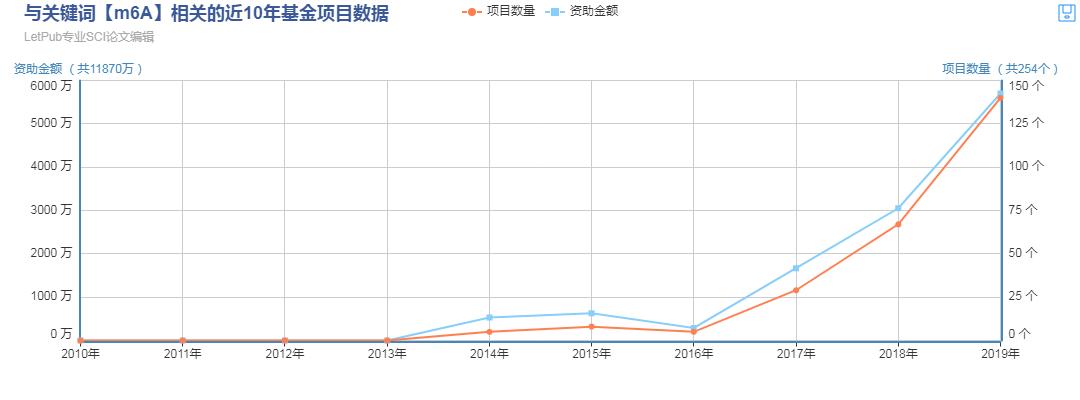
国自然热门领域之m6A
m6A是一种动态可逆的修饰方式,在转录后调控中发挥作用,其在调控基因表达、剪接、RNA 编辑、RNA 稳定性、控制mRNA寿命和降解、介导环状RNA翻译等方面扮演重要角色,具有重要的研究意义。国自然基金申请上,m6A RNA甲基化相关项目增长喜人。2019年有140个中标项目与m6A甲基化相关,较2018年67个中标项目,同比增长109%。文章产出上也连年增长,其高质量文章不断。可以预见在未来三到五年内,m6A甲基化仍会是热门研究领域,且研究产出呈爆炸增长。
今天我们来讲一篇m6A甲基化参与调节肿瘤干性和化疗敏感性的文章。该文章发表于Molecular Cancer期刊,期刊影响因子为10.679,该期刊近年来影响因子逐年上涨,质量较高。文章题名为:m6A modification-mediated CBX8 induction regulates stemness and chemosensitivity of colon cancer via upregulation of LGR5。该文章讲述了m6A修饰后CBX8通过上调LGR5表达调节结肠癌(CC)的干性和化疗敏感性。

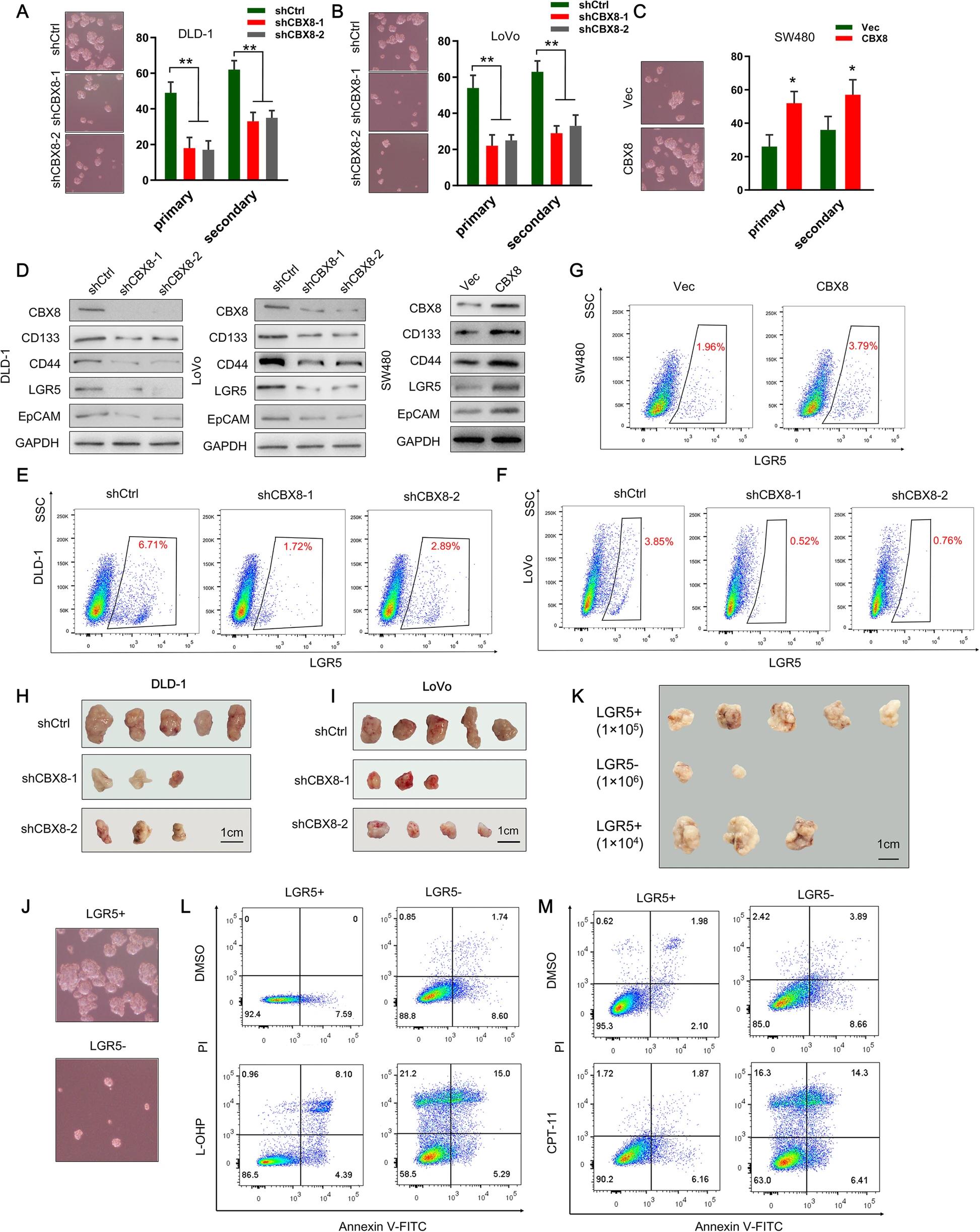
一、CBX8维持CC细胞的干性
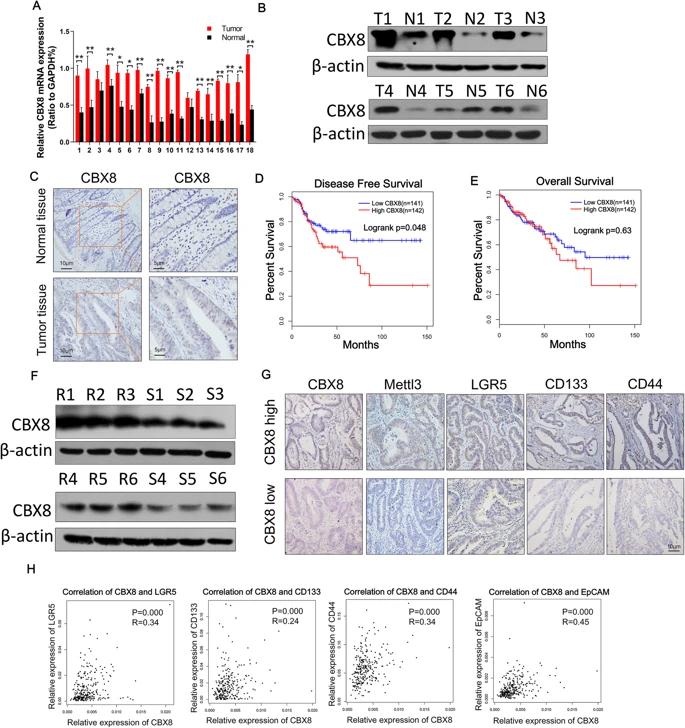
通过TCGA和GTEx数据库分析正常结肠组织和CC组织中CBX蛋白的mRNA表达谱,发现CC组织中CBX2,CBX4和CBX8的表达显着上调。又通过IHC检测三种蛋白在抗化疗CC组织中的表达,抗化疗CC组织中CBX8的表达高于正常组织。由于化疗抗性是癌症干性的关键特征,因此研究了CBX8对CC细胞干性特征的影响。相对于正常上皮细胞系,CBX8在CC细胞系中过表达。抑制CBX8可降低CC细胞初级和次级成球能力;相反,过表达CBX8增强初级和次级成球能力。肿瘤干性标记包括CD133,CD44,LGR5和EpCAM,WB检测了CBX8对肿瘤肝性标记表达调控作用。敲低CBX8显着降低CC细胞中CD133,LGR5,CD44和EpCAM的表达,过表达CBX8显着增加了CC细胞中干性标志物的表达。流式检测到敲低CBX8的CC细胞减少细胞中LGR5高表达的比例,过表达结果相反。皮下成瘤实验中,注射了敲低CBX8基因DLD-1和LoVo细胞的小鼠的肿瘤发病率明显降低。成球实验表明,LGR5+细胞比LGR5-细胞表现出更强的成球能力。LGR5+细胞有助于小鼠的肿瘤形成,并表现出较强的抗细胞凋亡的能力(通过L-OHP或CPT-11诱导)。
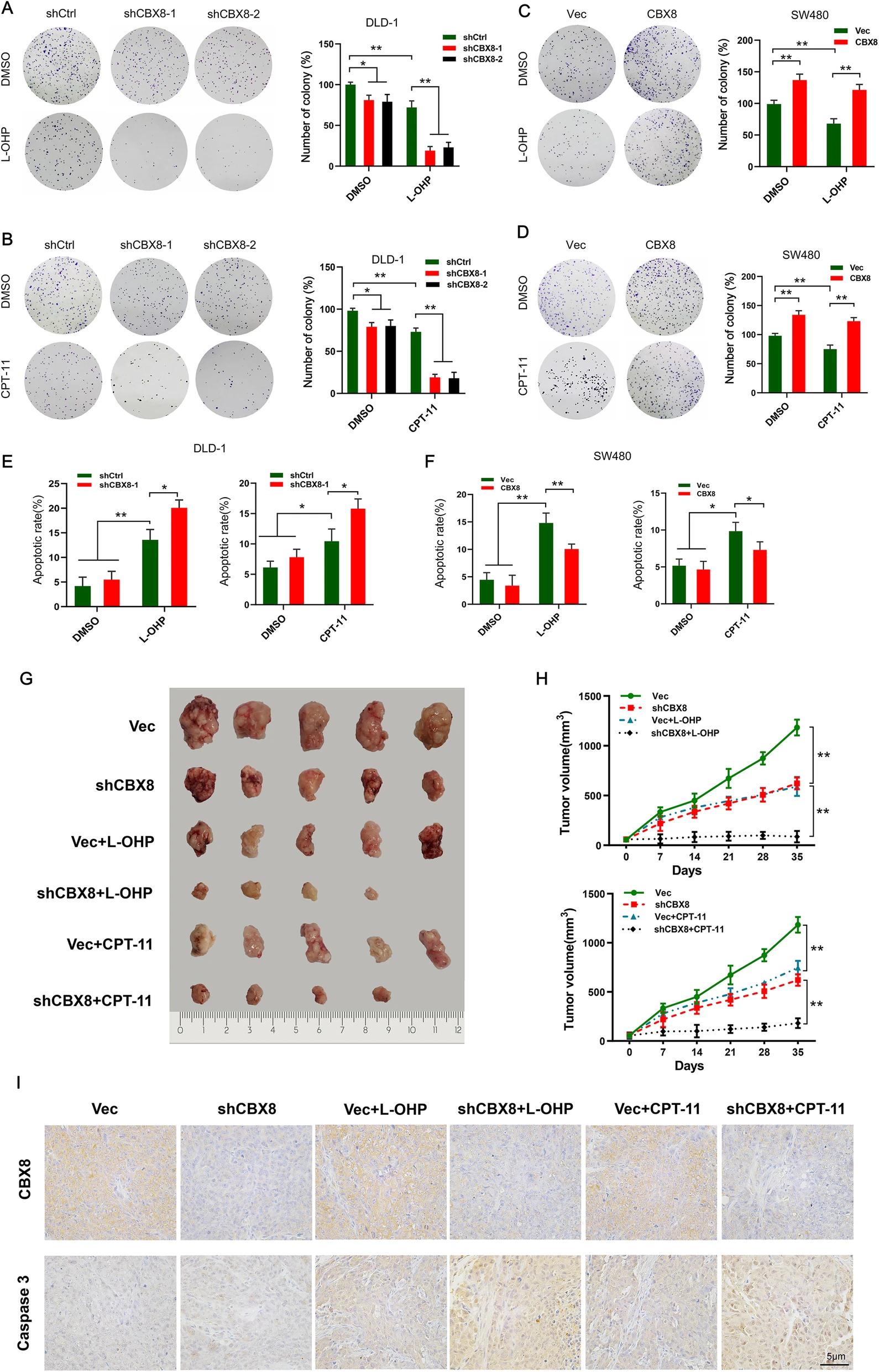
二、CBX8抑制CC细胞对L-OHP和CPT-11的化疗敏感性
由于敲低CBX8抑制CC细胞的干性,接下来检查CBX8是否会影响CC细胞的化疗敏感性。敲低CBX8的CC细胞在L-OHP和CPT-11处理下,表现出较差的集落形成能力和较高的细胞凋亡率。过表达CBX8后,结果相反。结果表明,CBX8敲低或过度表达与化疗药物有协同作用。为了进一步研究CBX8敲低是否影响化疗敏感性,通过慢病毒干扰CBX8表达。结果表明,敲低CBX8表达可有效抑制肿瘤生长;shCBX8与L-OHP或CPT-11的结合对肿瘤生长的抑制作用比任何单独的治疗都要强。IHC结果确认了CBX8的表达被shCBX8干扰,并且shCBX8与L-OHP或CPT-11的组合促进了细胞凋亡。综上所述,这些数据表明病毒介导的CBX8沉默增加了CC细胞对L-OHP和CPT-11的化疗敏感性。
三、LGR5为CBX8的靶标并介导CBX8诱导的CC细胞干性
通过转录组测序确定干扰CBX8和对照细胞的mRNA表达谱。敲低CBX8导致2234个基因的上调和3410个基因的下调。GSEA分析结果表明,差异表达的基因集显著与癌症干性和侵袭相关。使用ChIP-seq方法确定了CC细胞中CBX8的全基因组靶位,CBX8优先分布在基因的转录起始位点(TSS)附近。GO)分析结果表明,CBX8结合基因的最重要生物学功能包括转录的正调控,Pol II调控区序列特异性DNA结合和转录corepressor活性。分析了敲除CBX8后差异表达基因与ChIP-seq数据之间的重叠基因集,发现46个上调基因包含在CBX8目标基因集中,而83个下调基因包含在CBX8目标集中基因。重要的是,LGR5位于83个下调的靶基因中,因此推测CBX8可以参与调控LGR5。
为了进一步评估LGR5对CBX8介导的干特性的影响,用LGR5过表达质粒转染了CBX8敲低的CC细胞。LGR5的过表达恢复了CBX8耗尽诱导的干标记表达,球体形成能力和对L-OHP和CPT-11的化疗敏感性的变化。相反,LGR5敲低挽救了CBX8过表达诱导的干性标记表达,球体形成能力和化疗敏感性的变化。这些结果证实,CBX8可通过LGR5促进癌症干并抑制化疗敏感性。
四、CBX8通过以经典途径与pol II相互作用调节LGR5转录
接下来,研究了CBX8促进LGR5表达的潜在机制。qRT-PCR的结果证实,敲低CBX8导致LGR5表达降低,而过表达CBX8导致LGR5表达升高,表明CBX8在转录水平上调节了LGR5表达。ChIP-seq结果表明,CBX8在LGR5的启动子上富集。使用MEME来分析识别CBX8的结合基序,预测出五个高度相关结合序列,其中第四个基序中富含LGR5启动子,可能在LGR5的转录调控中起关键作用。为了确定是否存在CBX8响应区域,构建了三个荧光素酶报告基因,其中包含LGR5启动子的不同片段。萤光素酶报告基因分析的结果表明,CBX8敲低显着降低了由-591/267片段驱动的萤光素酶活性;而CBX8过表达增强了由该片段驱动的萤光素酶活性。这些结果证实,CBX8启动子的-591/267区含有CBX8响应位点。然后,我们构建了针对LGR5启动子不同区域的七对引物。结合的ChIP和qPCR分析显示,CBX8结合到CBX8启动子中的区域2–5,该区域包括在-591 / 267个片段。Pol II抑制可抑制具有或不具有CBX8过表达的DLD-1细胞中的LGR5活化,ChIP-seq数据表明LGR5 启动子中Pol II高度富集,CoIP分析结果表明CBX8结合了DLD-1细胞中的Pol II。敲低或过表达CBX8,并进行ChIP-PCR分析。结果显示,敲低CBX8时,CBS2和CBS4上Pol II的占用率降低。相反,在CBX8过表达后,发现Pol II在CBS2和CBS4处的占用增加。作者还研究了CBX8是否以经典的PRC1依赖性方式促进LGR5转录。为此,敲低DLD-1细胞中Ring1b的表达,但Ring1b的敲低并未干扰LGR5的表达,这表明CBX8介导的LGR5激活不涉及PRC1的经典机制。

五、CBX8通过与KMT2b结合而在LGR5启动子上维持H3K4me3
为了深入了解CBX8调控LGR5表达的机制,使用UCSC确定是否存在组蛋白修饰(H3K4me3、H3K27me、3H3K27Ac)。H3K4me3和H3K27Ac标记转录激活,而H3K27me3标记转录抑制。结果发现高富集的H3K4me3和H3K27me3的峰重叠。ChIP分析用于进一步确定CBX8是否通过组蛋白修饰调节LGR5。在LGR5启动子处,CBX8的敲低和过表达分别降低和增加了H3K4me3的表达,而CBX8敲低并没有改变H3K27me3或H3K27Ac的表达。这些数据暗示在LGR5启动子上的H3K4me3修饰是CBX8介导的LGR5激活的原因。来自ENCODE的ChIP-seq数据显示KMT2b富含LGR5启动子,干扰KMT2b不会降低LGR5表达。WB结果显示,过表达CBX8并敲低KMT2b-抑制LGR5活化。此外,CoIP检测结果显示CBX8在DLD-1细胞中与KMT2b相互作用。当这些标记的蛋白在HEK293细胞中共表达时,CoIP鉴定了CBX8和KMT2b之间的相互作用。为了进一步评估KMT2b在CBX8介导的LGR5表达中的作用,我们通过ChIP-qPCR重新检查了LGR5启动子的七个区域,ChIP分析表明,KMT2b在区域3、5和6中显着富集。敲低CBX8降低了KBS1和KBS2处KMT2b的结合率,而KMT2b耗尽抑制了KBS1和KBS2处KMT2b和H3K4me3的富集。这些结果表明,CBX8导致KBS1和KBS2处的KMT2b积累,以维持H3K4me3修饰状态。为了进一步确认KBS1和KBS2是否是促进LGR5表达的关键位点,我们构建了几种萤光素酶报告基因质粒,该质粒包含带有或不带有KBS1和KBS2突变的各种启动子区域。当KBS1或KBS2发生突变或KBS2被删除时,CBX8基因敲除和过表达分别降低和增加报告基因活性。在LGR5启动子中构建了KBS1突变和KBS2缺失的质粒,发现CBX8的敲除和过表达都不会影响报告基因的活性。这些结果表明,在CC细胞中,CBX8将KMT2b募集到KBS1和KBS2,从而通过H3K4me3促进LGR5转录。
为了鉴定CBX8与KMT2b结合的结合域,我们克隆了5个带有Flag标签的CBX8构建体,并用截短的质粒转染了DLD-1细胞。用抗-Flag抗体对细胞提取物进行IP。Flag-CB4与癌细胞中的KMT2b相互作用,表明与KMT2b相互作用需要CBX8氨基酸214和300之间的结构域。

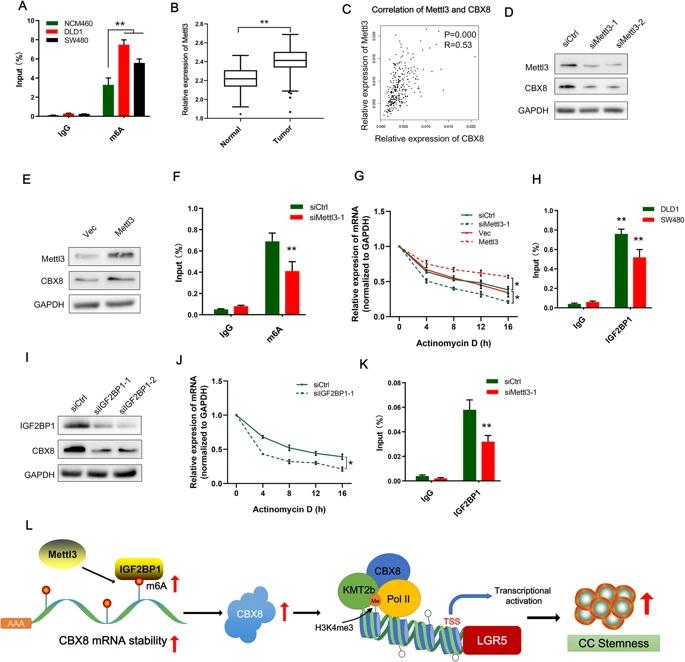
六、Mettl3诱导的m 6 A修饰参与CBX8的上调
导致CBX8异常表达的机制尚不清楚。RMBase预测显示,许多高度可信的m6A位点分布在CBX8 mRNA中,因此推测CBX8的上调是否依赖于m6A修饰。MeRIP与qRT-PCR结合显示,DLD-1和SW480细胞中m6A的富集程度明显高于正常NCM460细胞。TCGA数据库中评估了Mettl3表达以及Mettl3和CBX8表达之间的相关性。值得注意的是,Mettl3在CC组织中显着上调,并且Mettl3表达与CBX8表达正相关。敲低Mettl3明显降低了CBX8 mRNA和蛋白质水平,相反,过表达Mettl3增加了CBX8的mRNA和蛋白质表达水平。MeRIP PCR也表明,敲低Mettl3降低CBX8 mRNA的m6A甲基化水平。敲低Mettl3导致CBX8 mRNA的稳定性降低,而Mettl3过表达则可以提高CBX8 mRNA的稳定性。这些结果揭示了Mettl3通过促进CC细胞中的m6A修饰来维持CBX8 mRNA的稳定性。
使用RMBase 预测了CBX8 m 6 A位点的潜在读者,发现IGF2BP1确实在CBX8 mRNA上具有结合位点。RIP分析证实了CC细胞中IGF2BP1和CBX8 mRNA之间存在直接相互作用,敲低IGF2BP1会显着降低CBX8蛋白表达水平。敲低IGF2BP1后,CBX8 mRNA的中位半衰期明显缩短;敲低Mettl3后,IGF2BP1和CBX8 mRNA之间的相互作用受到损害。这些数据表明,IGF2BP1与CBX6 mRNA结合,以m6A依赖的方式增强其稳定性。
七、CC中Mettl3 / CBX8 / LGR5轴的临床意义
qRT-PCR和WB验证临床CC样本中CBX8表达,IHC结果证实高表达CBX8主要定位于在CC组织细胞核。化学抗性CC组织中的CBX8表达高于化学敏感的CC组织。数据库分一下预后相关性和生存曲线。IHC结果显示,化疗抗性患者CBX8,Mettl3,LGR5,CD133和CD44表达水平较高。
最后今天就看到这里,下回带大家看点别的,再见!!






