细胞核内含物加载到外泌体的机制
外泌体物质种类繁多,包括蛋白质、小RNA和基因组DNA(GDNA)。gDNA的存在表明不同的细胞内隔室有助于外泌体的装载,导致不同的外泌体亚群。然而,对gDNA和其他核内容进入外泌体(Nexo)的了解仍然很少。
近期,一篇名为“Mechanisms of nuclear content loading to exosomes”的文章在《Science Advances》上发表。

文章所述研究确定了作为基因组不稳定性标记的癌细胞微核(MN)与Nexo形成之间的关系。成像流式细胞术分析显示,10%的来自癌细胞的外泌体和<1%的来自卵巢癌患者血液和腹水的外泌体含有核内容物。在体外和体内用基因毒性药物治疗导致MN和Nexos增加。观察到多泡体前体和外泌体标记物,如Tetraspanins,直接与MN相互作用。总的来说,这项工作提供了与Nexos相关的新见解,这对癌症生物标记物的开发具有影响。
技术路线:

结果:
1.卵巢癌外泌体含有细胞核内含物
筛选了癌症基因组图谱(TCGA),以确定哪些肿瘤类型具有最高数量的染色体重复,是最不稳定的(图1A)。在所研究的25种肿瘤类型中,观察到高级别浆液性卵巢癌(HGSC)在中位倍体中排名第四,基因组高度不稳定,这与不良的临床结果相关。使用HGSC临床前模型,用低温电子显微镜(Cryo-EM)、纳米颗粒跟踪分析(NTA)和免疫印迹分析(图1,B到D)检测分离的外泌体的纯度。为了确定外泌体是否携带核蛋白,对外泌体组分进行了质谱(MS)分析。在从OVCAR-5(OVCAR-5exo)细胞分离的外泌体中,检测到一个201个核相关蛋白和17个染色体相关蛋白的HGSC细胞系,其中12.5%的被检测蛋白是核来源的(图1,E和F)。在这些发现的基础上,使用全基因组测序(WGS)来比较来自OVCAR-5细胞和外泌体的DNA之间的CNVs(图1G)。细胞和外泌体DNA之间的CNVs非常相似(图1H)。虽然一些研究表明gDNA存在于外泌体中,但包含DNA的外泌体的亚群和包含DNA的外泌体的数量尚不清楚为了解决这个问题,使用Amnis Image Stream X,MkII流式细胞仪检测如前所述的单个外泌体。采用这种方法分析Nexo,首先用CellMask质膜染色法对外泌体进行染色,然后加载到流动分析仪上。不同大小的珠子被用作设置外泌体种群的门的参考(图1I)。为了鉴定gDNA的存在并量化DNA阳性外泌体的百分比,用DRAQ5对外泌体进行染色,DRAQ5是一种优先结合双链DNA(dsDNA),浸透细胞以允许量化DNA阳性外泌体的百分比(图1I)。此外,单粒子成像流式细胞术方法允许对DNA阳性外泌体的亚群进行定量,这些外泌体也对其他外体蛋白标记呈阳性,如tetraspanins(图1I)。除了gDNA外,还检测了外泌体中Lamin A/C的存在,Lamin A/C是一种核膜蛋白,存在于我们的OVCAR5-exo MS数据中(图1,E和F)。观察到Lamin A/C也可通过流式细胞术检测到(图1J)。与gDNA相反,Lamin A/C在OVACR5-exo中没有那么丰富,但确实观察到超过50%的DNA阳性外泌体也对Lamin A/C呈阳性(图1J)。
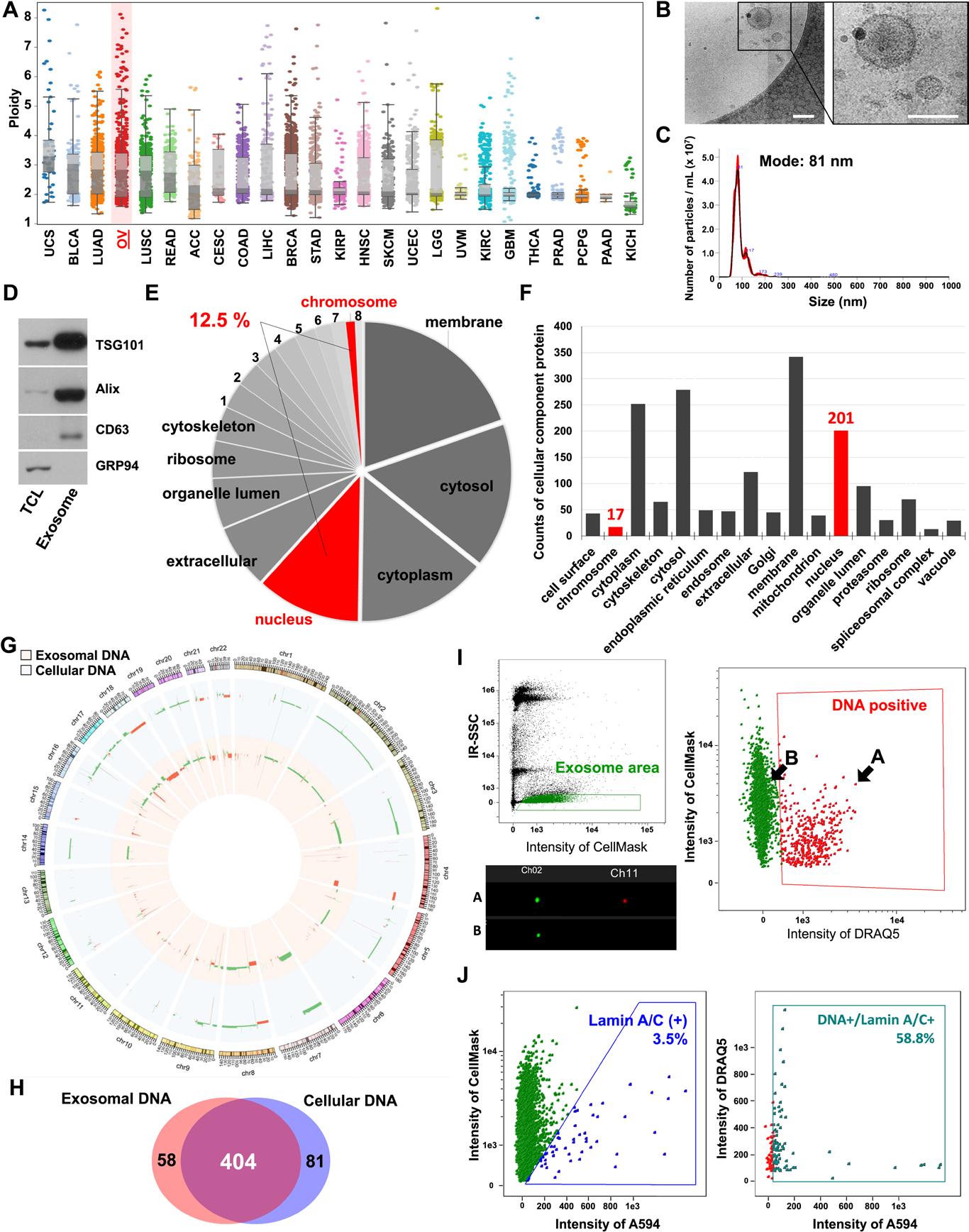
图一 卵巢癌外泌体核源性内含物的鉴定(D)TSG101、Alix和CD63用作外泌体标记,GRP94用作细胞污染的标记。Tcl,细胞总裂解物。(E)核成分以红色突出显示:1,内质网;2,内体;3,高尔基体;4,细胞表面;5,线粒体;6,蛋白酶体;7,液泡;8,剪接小体复合体。(F)x轴表示蜂窝室的类别。在染色体和细胞核中鉴定的核蛋白以红色突出显示。(G)外泌体DNA(内红圈),细胞DNA(外蓝圈。最外面的圆圈用坐标表示人类染色体(兆基)。蓝色和红色内圆内的绿色和红色直方图表示由cnvkit识别的拷贝数改变。轨道上的条形越大,拷贝数改变(对数刻度)越大。绿色条表示放大事件,红色条表示删除(I)左上:粒子显示为黑点,外泌体位于绿色区域。右图:每个点表示用CellMask Green(Ch02)染色的单个外泌体,红色的框表示用DRAQ5(Ch11)染色的DNA阳性颗粒。左下角:单独染色的外泌体的快照。(A)和(B)是存在于右图所示区域的外泌体。(A)代表DNA阳性的外泌体,(B)代表阴性的外泌体。(J)左图:每个绿点表示单个外泌体,蓝色框表示Lamin A/C阳性群体。右图:所有的点都来自DNA阳性的外泌体,绿色框表示Lamin A/C阳性的群体。
2.MN的诱导增加了携带DNA的外泌体的数量
类似于gDNA在癌源外泌体中的存在,MN也由于其固有的基因组不稳定性而在癌细胞中更为普遍。基于这一想法,调查MN的存在与nExo之间是否存在任何关系。首先确定了原代健康输卵管上皮细胞(FTE)中含有MN的细胞的基线数量,并与卵巢癌细胞系进行了比较。在原代FTE细胞中,被认为是许多HGSC的起源细胞,含有MN的细胞的盛行率为1%(图2,A和B)。相反,大约4%的卵巢癌细胞含有MN(图2,A和B)。比较健康细胞和癌细胞分泌的Nexo的数量,发现癌细胞分泌的Nexo群体明显更高(FTEexo,0.12±0.04%;OVCAR-5exo,8.26±1.62%;和OVCAR-8exo,8.25±2.61%)(图2,C和D)。这些数据表明,具有高度基因组不稳定性从而增加MN的细胞,如癌细胞,分泌更多数量的Nexos。为了进一步验证假设,用基因毒性药物topotecan(10 NM)或olaparib(20μM)处理卵巢癌细胞,以诱导MN的形成。无论使用哪一种药物治疗后,MN的数量显著增加(图2,E和F)。类似地,含有gDNA的外泌体(图2,G和H)的数量在用这些药物治疗后也增加了。这些结果表明,诱导基因组不稳定性增加了MN产量,从而增加了Nexo丰度。
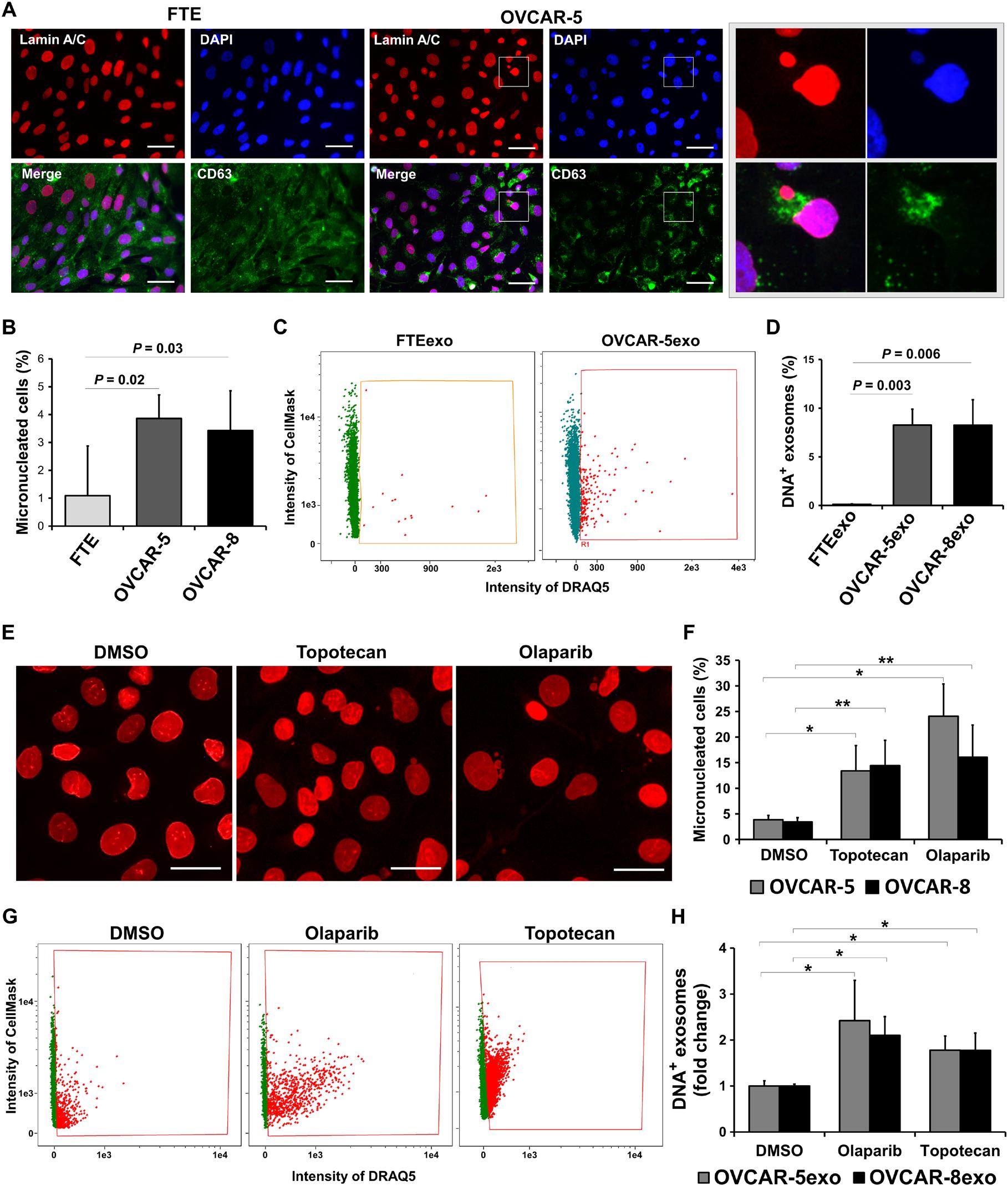
图二 促进MN的形成增加了携带DNA的外泌体。(A)插图显示右侧面板中微核OVCAR-5细胞的放大图像。(C)两个图中的框都表示DNA阳性群体。(D)FTEexo,OVCAR-5exo和OVCAR-8exo中DNA阳性外泌体群体。(E)用Lamin A/C抗体对细胞核进行IF染色。(H)用DMSO,olaparib或topotecan处理亲代细胞48小时。FTEexo、OVCAR-5exo和OVCAR-8exo分别表示来自FTE、OVCAR-5和OVCAR-8细胞的外泌体。
为了在体内验证这些发现,使用代表播散性腹膜疾病的OVCAR-5卵巢癌模型。如示意图(图3A)所示,每只荷瘤小鼠均接受最大耐受量的拓扑替康(7.5 mg/kg)治疗,48小时后euthanasia。每只小鼠的肿瘤生长通过体内成像得到确认(图3B)。为了确定拓扑替康是否可以诱导MN的形成,正如、体外观察的那样,收集肿瘤结节,切片,用H&E染色,通过强光和免疫荧光(IF)显微镜进行检查(图3,C和D)。H&E染色证实拓扑替康处理后MN的存在(图3C)。为计算MN的数量,多次拍摄肿瘤切片的IF图像,并且通过Vectra-Inform图像分析系统(PerkinElmer)系统地计数MN(图3D)。拓扑替康治疗组与赋形剂对照组相比,有增加MN阳性细胞百分比的趋势,尽管这个百分比在统计学上没有显著性(图3E)。为了测量每次治疗后Nexos产生量的差异,从各组荷瘤小鼠的血清和腹水中分离外泌体,通过冷冻-EM、NTA和CD63的Western blotting(图3,F至H)确认它们的纯度,并通过成像流式细胞术进行定量。荷瘤小鼠的血清中通常比非带瘤小鼠有更多的Nexos(P=0.008)(图3I)。将拓扑替康治疗的小鼠与赋形剂对照组相比,我们观察到腹水中Nexos的显著增加(P=0.028),但血清Nexos没有差异(图3,J和K)。这些结果表明,肿瘤产生更多的Nexo,遗传毒性药物促进体内MN的形成,增加Nexo的释放量。
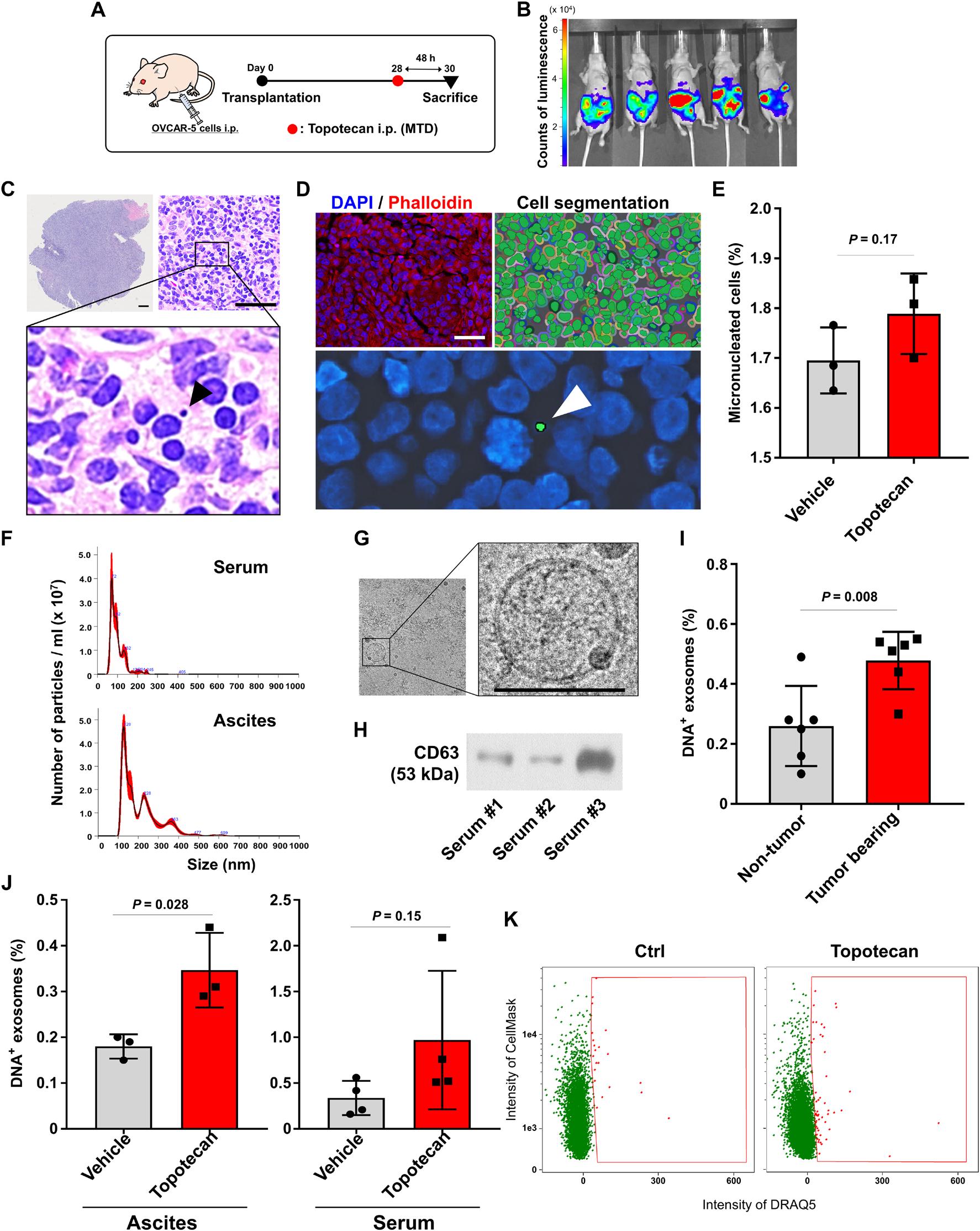
图三 基因毒性药物在卵巢癌中对Nexos的体内促进作用。(C)黑色箭头表示MN。(D)左上图:DAPI和Palloidin染色的肿瘤组织的代表性图像。右上图:使用VECTRA成像软件进行细胞分割的代表性图像。下图:检测到的MN的代表性图像,由白色箭头指示。
3.MN和nExo在活细胞中共享内含物并相互作用
接下来,比较MN和Nexos之间的相对核蛋白丰度。通过蔗糖梯度超速离心法分离OVCAR-5细胞中的MN,富集MN的组分洗涤并提交MS(图4A)。用4‘,6-二氨基-2-苯基吲哚(DAPI)染色和IF(图4A)确认MN富集。MN组分的MS分析显示OVCAR-5 MN和nExo蛋白含量之间有很大的相似性,两个细胞隔室之间有127个蛋白质重叠(图4,B和C)。这些共享的核蛋白包括Lamin A/C和组蛋白H2B以及一些外泌体标记,如热休克蛋白(图4C)。接下来,确定MN和外泌体相关蛋白是否在细胞内相互作用。外泌体标记如CD63,CD9和CD81的共聚焦成像显示这些蛋白质在卵巢癌细胞的核膜或MN内共定位(图4,D和E,以及图S4A)。为了进一步探讨这种相互作用是否发生在活细胞中,对过表达荧光标记的细胞的核蛋白和tetraspanins进行了延时成像。CD9和CD63都与OVCAR-5细胞中和MN积极相互作用(图4,F和G)。这些发现表明,MN和Nexos都有很高的核含量,并且这些结构在活细胞内积极地相互作用。
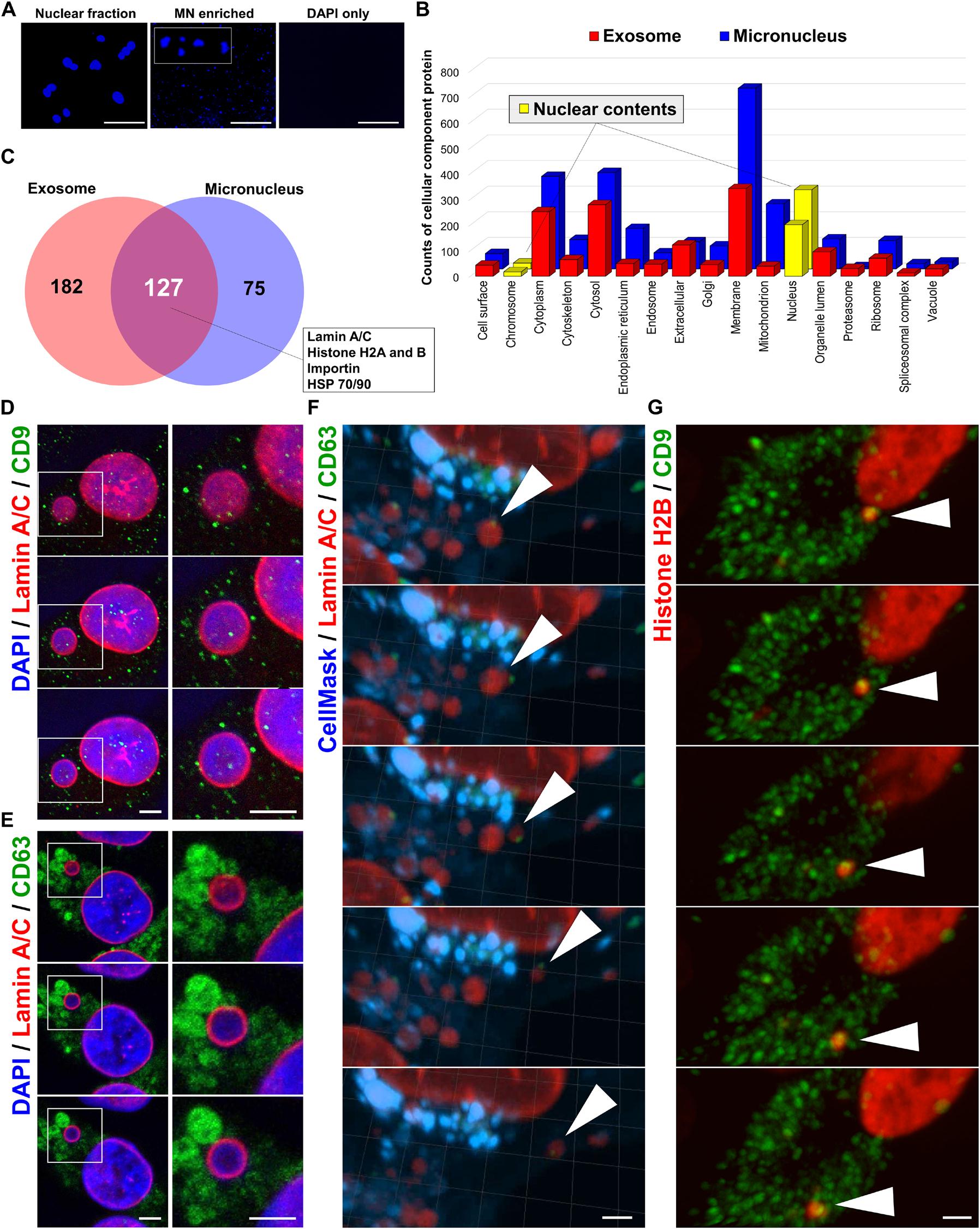
图四 MN和nExo含有相似的蛋白质内含物。(A)所有标本均取自OVCAR-5细胞,DAPI染色。中间图像中的白色框是放大的视图。(B)样品取自OVCAR-5细胞。x轴表示单元组件的类别。来自细胞核和染色体隔间的蛋白质以黄色突出显示。(C)样品取自OVCAR-5细胞。重叠的127个蛋白中包括Lamin A/C、组蛋白H2A/B、Importin和热休克蛋白(HSP)70/90。(D和E)mCherry-lamina/C-表达OVCAR-5细胞的连续共聚焦图像。DAPI染色细胞核。CD63和CD9用抗体IF染色。(F)细胞膜用CellMask深红染色。通过慢病毒感染细胞稳定表达绿色荧光蛋白(GFP)-CD63。(G)用mEmerald-CD9质粒瞬时转染细胞。
4.破碎MN物质被装载到外泌体中
已知MN的包膜是不稳定的,当其崩溃时,包括gDNA在内的MN内含物暴露在细胞质中。因此,探究这种塌陷是否可以诱导MN内容加载到外泌体中。与先前的发现一致,卵巢癌细胞的共聚焦成像显示一些MN没有被它们的核膜包围,表明MN塌陷(图5,A和B)。观察到可以作为MVBs标记物的Tetraspanin蛋白经常以部分或全部核膜塌陷包围MN(图5,A和B)。这些结果通过透射电子显微镜(TEM)得到了验证(图5,C至E)。这表明,与共聚焦观察相似,卵巢癌细胞含有塌陷的MN(图5C)。为了解决核内含物加载到外泌体背后的机制,假设塌陷的MN直接与外泌体生物合成的分子机制相互作用。外泌体最初由早期核内体的腔内囊泡形成,然后储存在MVBs中。然后,通过MVBs与质膜的融合,这些囊泡作为外泌体释放到细胞外空间。TEM显示MVBs位于MN和早期核内体附近,因此可以直接与塌陷的MN相互作用(图5,D和E)。此外,共聚焦分析显示完整和塌陷的MN均对早期内体标志物EEA1呈阳性(图5F)。这些结果表明gDNA可以以外泌体依赖或非外泌体依赖性的方式分泌,其中塌陷的MN可以与早期的核内体或自噬内涵体相互作用。为了进一步探索驱动MN内含物装载到外泌体中的分子机制,重点研究了tetraspanins,如CD63,因为它们参与外泌体/MVB物质装载。为了确定Tetraspanins对将MN内含物装载到核内体并最终进入nExos是否是必需的,用短发夹状RNA(ShRNA)敲除了卵巢癌细胞系中的CD63。在确认CD63蛋白敲除后(图5G),通过流式细胞术检测nExos数量的变化。CD63敲低的细胞比对照细胞分泌更少的nExos(图5H),这表明CD63在向nExos中装载核内含物方面起着重要作用。为了进一步探讨CD63在nExo加载中的作用,进行了免疫沉淀(IP)实验。来自OVCAR-5细胞裂解液的CD63pulldown揭示了与DNA和组蛋白H2B的联系(图5,I和J)。因此,CD63可以产生gDNA和核蛋白的复合物,并且可能对DNA在外泌体中的装载起重要作用。
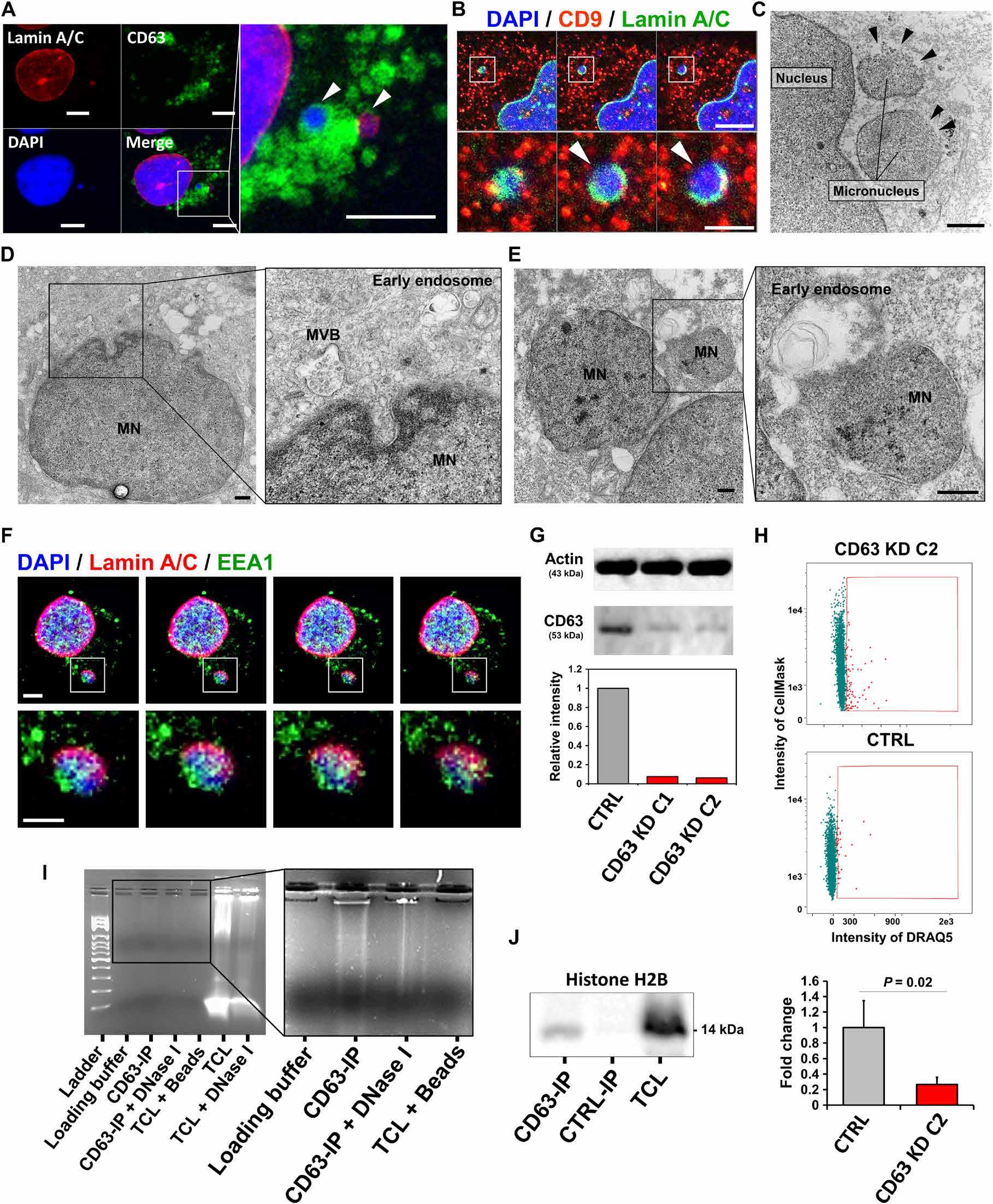
图五 破碎MN货物被装载进nExos。(B)细胞核用DAPI染色,Lamin A/C和CD9用抗体IF染色。(C至E)黑色箭头表示MN的核包膜破裂。(F)IF用抗体进行Lamin A/C和EEA1染色。(G)CTRL表示转染了扰乱shRNA序列的OVCAR-5细胞。密度分析在柱状图中定量。(I)对CD63进行IP实验的OVCAR-5细胞样品用2%琼脂糖凝胶电泳分析,并用溴化乙锭染色显示DNA。(J)CTRL-IP表示用通用磁性Co-IP试剂盒中的阴性对照免疫球蛋白G(Ig G)处理的OVCAR-5细胞(54002,活性基序)。
5.临床标本中nExo的检测
为了探讨Nexo的临床相关性,从HGSC患者的血浆和腹水中分离出外泌体,以表征它们的外泌体内含物(图6,A和B)。由于超速离心分离的人血清外切体中存在丰富的免疫球蛋白污染,采用尺寸排阻色谱对这些外泌体进行纯化,然后进行MS蛋白质组分析。MS分析表明,在患者来源的外泌体中鉴定的总蛋白中,3.2%至3.6%是核蛋白(图6,C和D)。在人类肿瘤组织中也检测到MN,分析的每个肿瘤中微核细胞的患病率为1%(图6,E和F)。使用流式细胞术,<1%的外泌体含有gDNA,这与我们的活体小鼠模型数据一致(图3I)。对晚期HGSC患者样本的WGS分析显示,在腹水来源的肿瘤和nExos中都发现了43个基因突变。这些突变的基因中有几个参与DNA修复,例如DROSHA,LIG4,MACROD2,SATB1,RASSF6和BIRC2(图6H)。此外,根据读取计数的结果,外泌体中的绝大多数DNA起源于基因组而不是线粒体,并且突变特征相似(图6I)。此外,腹水外泌体具有与原发肿瘤相似的CNV,但血浆外泌体没有(图6J)。
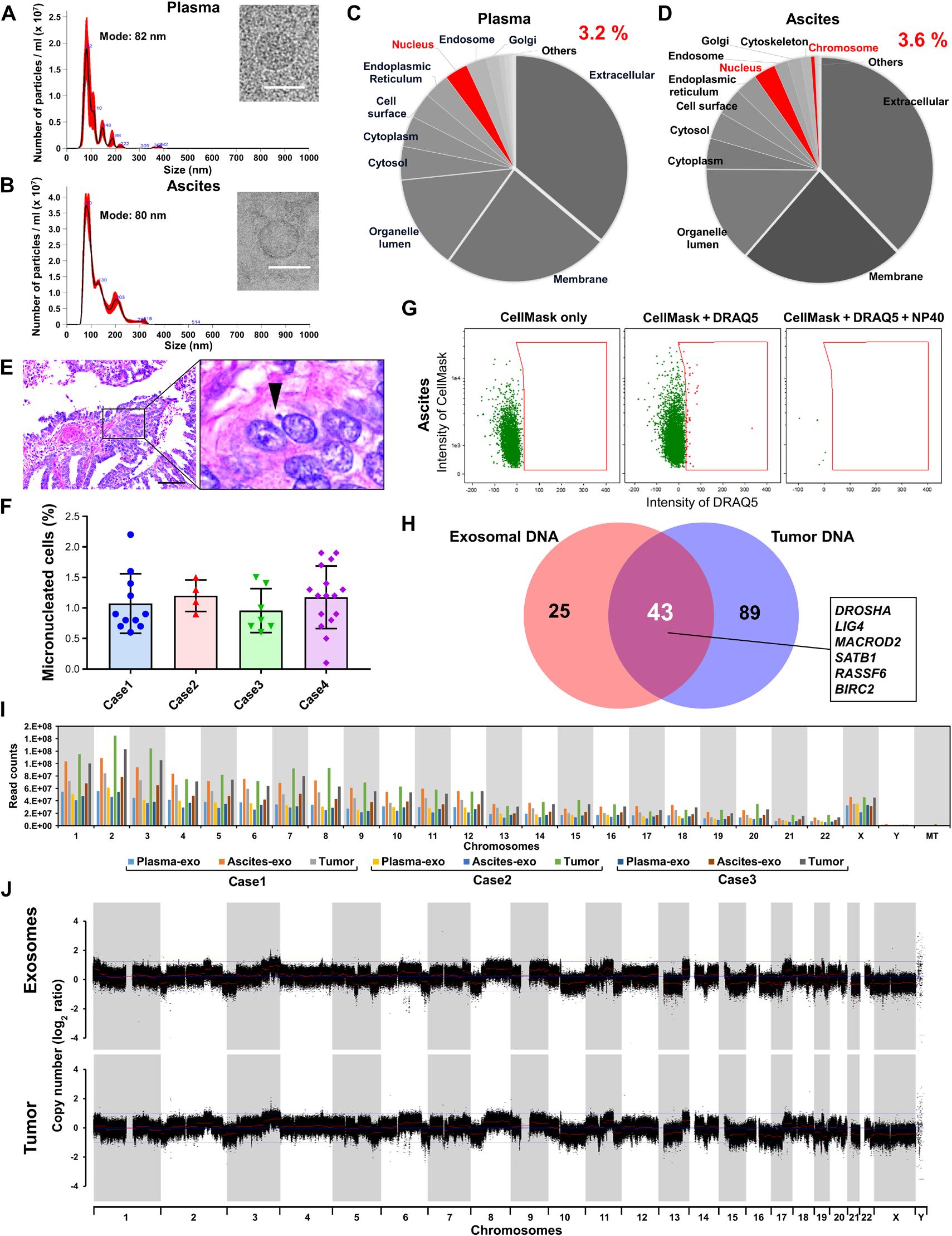
图六 临床标本中nExo 的检测。(C和D)核组分以红色高亮显示。(C)“其他”包括细胞骨架、线粒体、核糖体和液泡。(D)“其他”包括线粒体、细胞核、细胞器腔、核糖体和液泡。(E)黑色箭头表示MN。(F)每个点表示一个用于分析的视图。n=4。(H)样品取自HGSC患者。43个重叠基因中包括DROSHA、LIG4、MACROD2、SATB1、RASSF6和BIRC2。(I)所有三例患者均为晚期HGSC患者。(J)概况显示体细胞染色体获得(上)和丢失(下),以及正常的多态性。






