新认识——炎症如何改变干细胞外泌体介导的心脏修复
心血管疾病是全球发病率和死亡率的主要原因,而干细胞疗法在缺血性心脏修复和再生方面具有广阔的前景。骨髓来源的内皮祖细胞(EPC)已进入临床试验,并显示出希望而温和的结果。EPC/干细胞在心肌中的存活率低和整合度低,缺血性心脏病后炎症的长期和未解决也显着损害了EPC的表型,并可能损害了其在心肌修复中的修复功能。有证据表明,心肌梗死(MI)后几乎五分之一的患者受到严重全身性炎症并发症和更高死亡风险的影响。患者的全身性炎症的特征在于循环中促炎细胞因子TNF-α的水平较高,而抗炎细胞因子IL-10的水平较低。这些患者的EPC功能失调,细胞存活,迁移和血管生成活性降低。了解炎症刺激如何调节EPC行为对于适当及时地遏制和消除炎症从而增强基于EPC/祖细胞的心肌修复和再生至关重要。
最近的研究表明干细胞介导的心肌修复在很大程度上与旁分泌作用有关。外来体最近被鉴定为干细胞的主要旁分泌功能单位。外泌体从所有类型的细胞中分泌出来,并含有细胞特有的小RNA和蛋白质,这些物质在很大程度上决定着外泌体的功能。干细胞衍生的外泌体显示出类似于其亲代细胞本身的心脏修复和再生特性。但是,所有外泌体,即使是由相同细胞分泌的,也不是相等的。已知不同的病理生理条件和亲代细胞的刺激会改变外泌体含量并可能调节外泌体功能。我们先前使用模仿系统性炎症条件的IL-10敲除小鼠进行的研究表明,IL-10缺陷的EPC分泌的外泌体缺乏体外促进细胞存活,迁移和血管生成的能力,其货物显示出差异的蛋白质和RNA表达模式。但是,全身性炎症如何导致EPC外泌体功能障碍尚不清楚。对于外泌体操纵以及这种无细胞疗法在心血管疾病中的应用,了解外泌体功能/功能障碍的分子机制非常重要。
整联蛋白激酶(ILK)广泛分布于哺乳动物组织中,但其在心脏中的最高表达提示其在心脏功能调节中的重要作用。作为Akt和GSK3β途径的上游分子,它在细胞存活和增殖中起作用,而在心肌细胞中,它似乎是促肥大性,促纤维化,促炎和它是在心脏衰老过程中诱导的。在本研究中,我们发现ILK高度富含IL-10KO-EPC衍生的外泌体和TNFα治疗的小鼠心脏内皮细胞衍生的外泌体,表明其在外泌体介导的炎症反应中起重要作用。我们的研究探索了外泌体递送的ILK在受体细胞中NF-κB活化中的作用,以及富含ILK的外泌体如何参与炎症反应,以及外泌体中ILK的抑制是否可以挽救发炎的EPC来源的外泌体的心肌修复能力。
今年12月,Yue Y等人在Circ Res发表一篇 “Interleukin-10 Deficiency Alters Endothelial Progenitor Cell -Derived Exosome Reparative Effect on Myocardial Repair via Integrin-Linked Kinase Enrichment.”的SCI文章。这篇文献作者使用白细胞介素 10(IL-10)敲除(KO)小鼠模拟系统性炎症条件,比较了从野生型 EPC 和 IL-10KO-EPC 分离的外泌体的治疗效果和蛋白质差异。这篇文献通过质谱分析显示 WT-EPC-Exo和 IL-10KO-EPC-Exo 包含不同的蛋白质表达模式。作者确定了 ILK 通过激活 NF-κB 途径在 EPC-外来体介导的炎症反应中的重要作用。作者进一步报告,敲低发炎外泌体中的 ILK 会减弱 ILK 富集的外泌体介导的炎症反应,抑制 NF-κB 途径的活化并增强缺血性心脏中 EPC 衍生的外泌体的修复活性。
一、IL10KO EPC的外泌体在功能上是惰性的
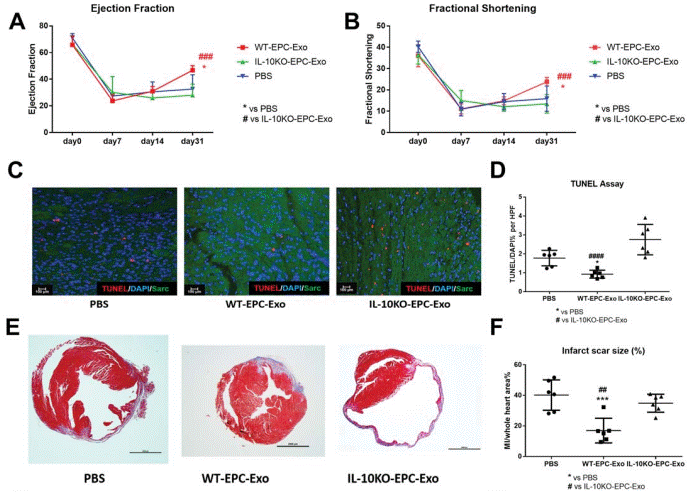
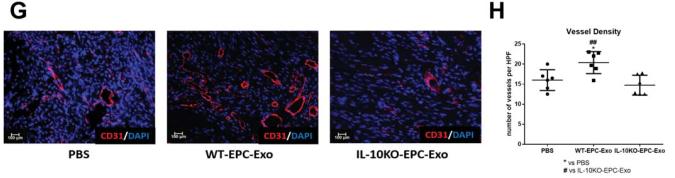
A 和 B, MI 后不同时间点的回声分析。 WT EPC-Exo 处理的小鼠的EF% 和FS %均有明显改善。IL10KO-EPC-Exo 处理的小鼠的心脏功能未显示任何改善。C 和 D,第 5天心脏样品的 TUNEL 分析用于 MI 细胞凋亡后的测量,显示 IL-10KO-EPC-Exo 处理的小鼠的凋亡细胞增强。E 和 F,在第 31 天用于心梗后疤痕测量的心脏样品的 Masson 三色染色显示,IL10-KOEPC-Exo 组的梗死面积更大。G 和 H,在第 31 天心脏进行 CD31 染色,以测量 MI 后的血管生成。
结论:与表现出修复活性的 WT EPC 外泌体相比, IL-10 缺陷型 EPC 的外泌体失去了心肌修复,血管生成和细胞存活的活性。
二、IL-10KO-EPC-Exo 和 MCEC +TNFα-Exo 中的 ILK 富集
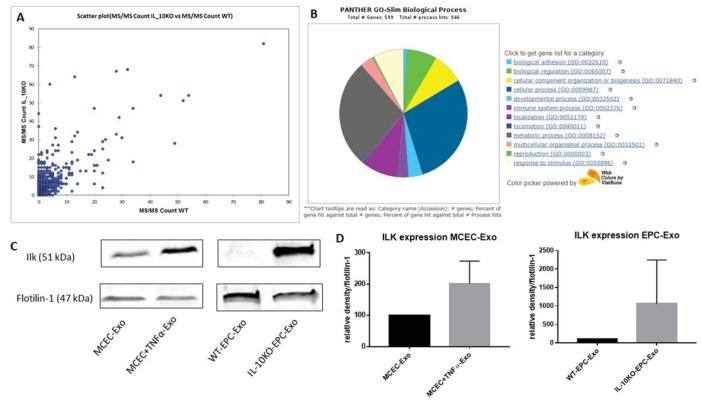
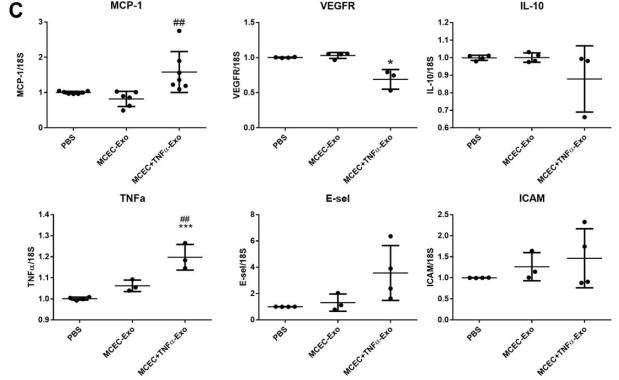
A,质谱分析的散点图显示 WT-EPC Exo 和 IL-10KO-EPC-Exo 中的蛋白质表达模式不同。 B,关于在 IL-10KO-EPC-Exo 中过表达的蛋白质的基因本体分析,用于生物过程鉴定。 C 和 D, Western 印迹分析验证了 IL-10KO-EPC-Exo 和MCEC +TNFα-Exo 中的 ILK 富集(* vs MCEC-Exo, N = 5, * p = 0.0368, #vs WT-EPC-Exo, N = 3, ## p = 0.0087) 。
结论:炎症刺激改变了细胞来源的外泌体蛋白含量,并且 ILK 通常富含发炎的外泌体,表明其在介导炎症反应中的潜在作用。
三、富含 ILK 的外泌体激活受体细胞中的 NF-κB 途径
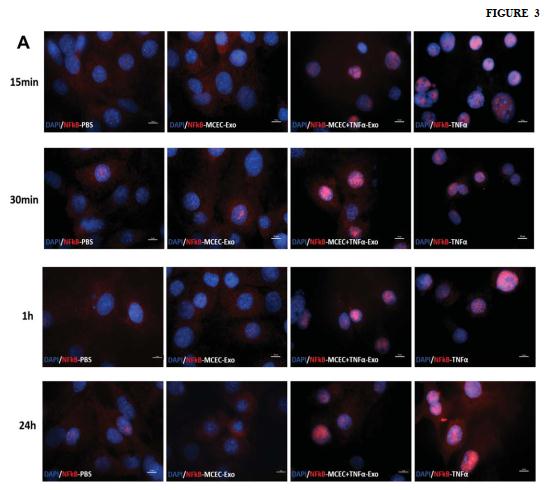
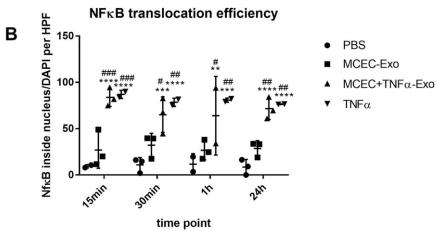
A 和 B,NF-κB 染色分析显示 MCEC +TNFα-Exo 和 TNFα处理均触发了受体 MCEC 细胞中的 NF-κB 核易位。
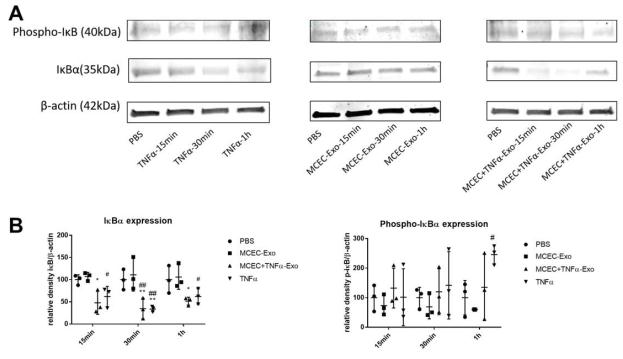
A 和 B,蛋白质印迹显示 MCEC +TNFα-Exo 和 TNFα激活的 NF-κB信号通路,降低了受体 MCEC 细胞中 IκBα的表达。(N = 3, * p = 0.0399, ** p = 0.0066,#p = 0.0308, ## p = 0.0018) C, qRT-PCR 分析显示 MCEC +TNFα-Exo 处理 24 小时触发了受体 MCEC 中的 NF-κB下游基因表达细胞。 (N=4, *p=0.0250, ***p=0.0009);* vs PBS 组#vs MCEC-Exo 组(## p = 0.0047)
结论:富含 ILK 的外泌体激活受体细胞中的 NFκB 途径,并通过增强炎症基因表达而增强了炎症反应
四、ILK 敲低外泌体显示减弱的 NF-κB 激活作用
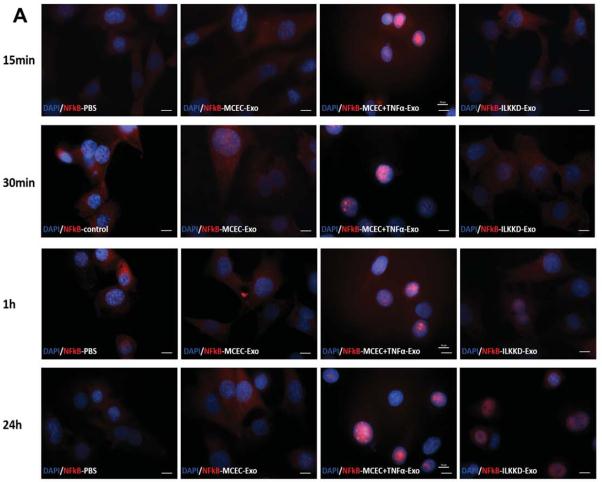
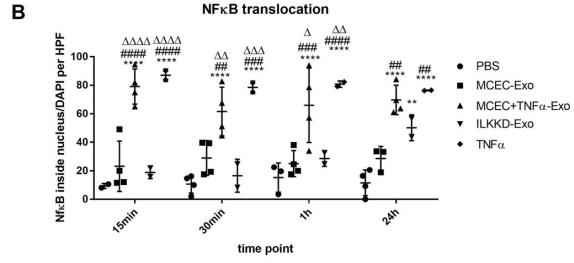
A 和 B, NF-κB 染色分析表明, ILK KD-Exo 短时治疗未激活核 NF-κB易位,但长时间治疗后被激活。
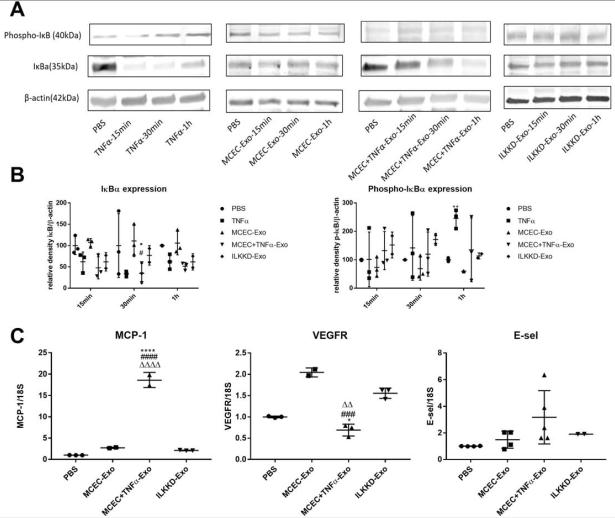
A 和 B, Western 印迹显示, ILK KD-Exo 处理可在短时间内抑制 IκBα 的降解。C,qRT-PCR 分析表明 ILK KD-Exo 处理 24h 的水平较低NFκB 下游基因的表达。
结论:富含 ILK 的外泌体通过 NFκB 激活激活受体细胞的炎症反应。在外泌体中阻断 ILK 可成功抑制受体细胞中的 NFκB 活化和炎症反应。
五、MCEC +TNFα -Exo 中的 ILK 抑制可挽救血管生成功能障碍
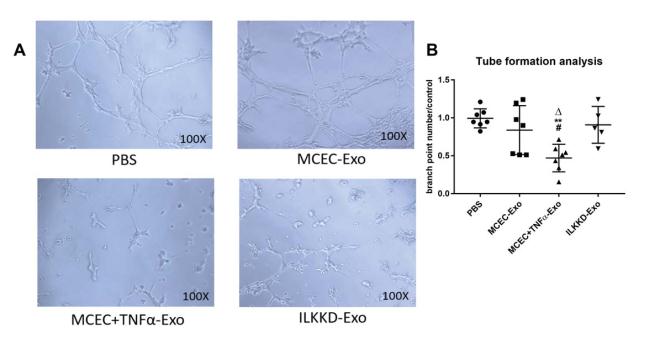
A 和 B, MCEC +TNFα -Exo 抑制了管的形成,而外泌体中的 ILK 抑制则减弱了抑制作用。
六、IL-10KO-EPC-Exo 中的 ILK 抑制可挽救心脏修复和再生功能障碍
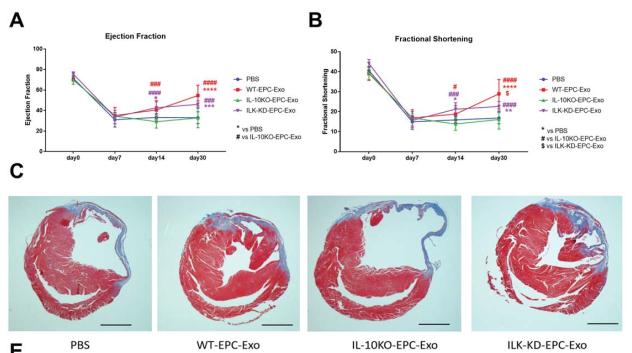
A 和 B,随后进行回声分析一个月,EF 和 FS 用于左心室心脏功能测量
结论:ILK 敲除成功地挽救了 IL-10 缺乏/炎症诱导的心肌修复中EPC 外泌体功能障碍。






