LncRNA LINRIS-结直肠癌的预后生物标志物
结肠癌(CRC)是一种侵袭性的原发性肠恶性肿瘤,在全球所有类型的癌症中,其发病率均排在第三位,而其死亡率则位居第二。 因此,寻找新的CRC治疗策略具有重要意义。长链非编码RNA(lncRNA)在癌细胞的表观遗传调控中起着不可忽略的作用。小编为大家带来最新发表于Molecular Cancer上的文章:“LncRNA LINRIS stabilizes IGF2BP2 and promotes the aerobic glycolysis in colorectal cancer”。这项研究旨在确定一种特定的lncRNA,该基因可促进结直肠癌(CRC)的进展,并可能成为潜在的治疗靶标。我们在人类CRC样本中筛选了高表达的lncRNA,并将其与匹配的邻近正常组织进行比较。RNA下拉和RNA免疫沉淀(RIP)分析证实了与LINRIS相互作用的蛋白质。在体外和体内测试了被LINRIS抑制的CRC细胞的增殖和代谢改变。

结果:
1.LINRIS在CRC中高表达,预后差
为了探索可能影响CRC进展的lincRNAs,我们将CRC期患者的肿瘤组织与配对的邻近正常组织进行RNA-seq转录组比较。基于RNA-seq分析,我筛选出7个高表达lncRNA,包括LINC00920(更名为LINRIS)(图1a)。我们发现LINRIS的高表达与CRC患者的不良总生存相关(图1b,c)。根据TCGA数据库,与正常细胞中的表达相比,大多数类型的肿瘤和CRC细胞系中LINRIS的表达上调(图1d和图1e),这些结果表明LINRIS通常起致癌基因的作用。食管鳞状细胞癌(ESCC),胃癌(GC)和胰腺导管腺癌(PDAC)的患者样本中也显示了LINRIS在消化道癌症中的致癌状态(图1f)。接下来,我们用shRNA敲除CRC细胞中的LINRIS。 使用BrdU和3D培养法比较了用LINRIS特异性shRNA(sh-1和sh-2)转染的CRC细胞与阴性对照(sh-NC),结果确定了LINRIS的促癌作用(图1g-i)。 通过RNA FISH分析,我们发现LINRIS主要位于细胞质中(图1j-l)。
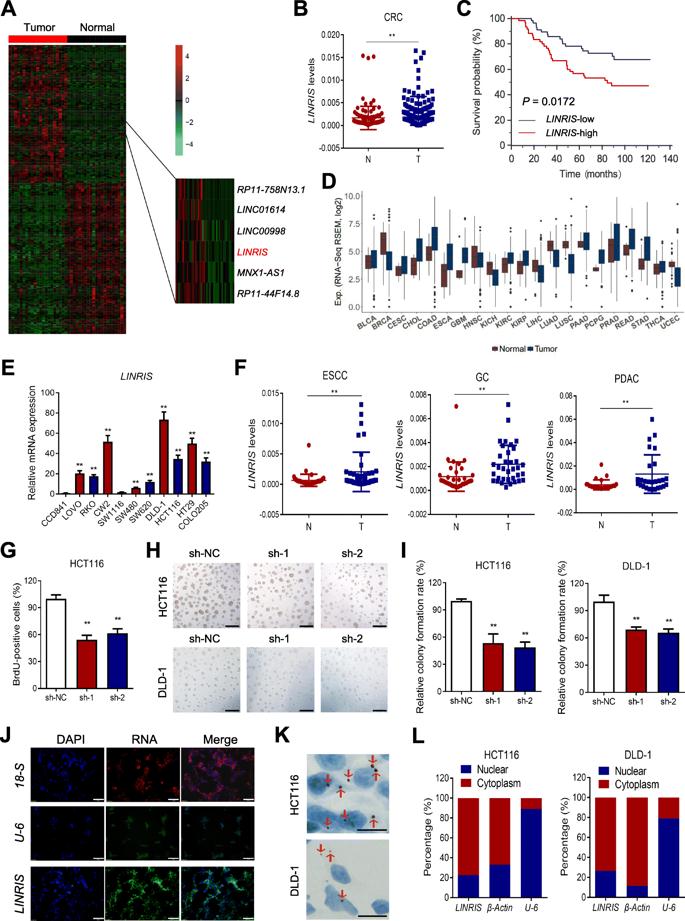
2.LINRIS与IGF2BP2相互作用并维持其表达
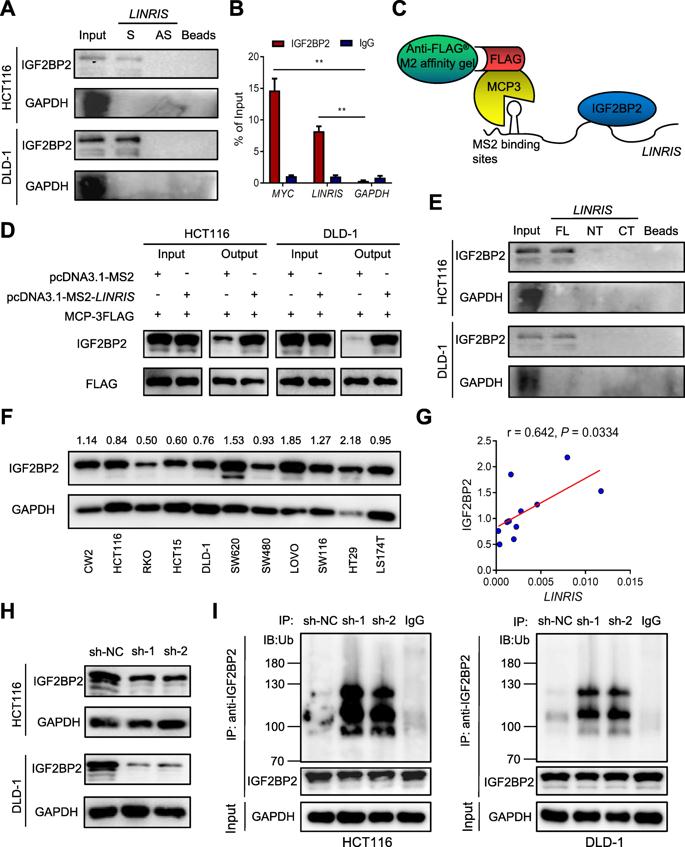
为了确定LINRIS诱导CRC细胞进程的分子机制,我们进行了RNA下拉测定和质谱分析,以探索可能与LINRIS相关的蛋白质。我们确定IGF2BP2作为我们的第一个靶标。如图2a-d所示,LINRIS可以直接结合到IGF2BP2。为了定位靶向IGF2BP2的LINRIS的结合位点,我们首先构建了两个截短的LINRIS载体并进行了RNA下拉测定,因为该lncRNA的长度仅为913 bp。但是,LINRIS的N端(1–570 nt)和C端(571–913 nt)片段都不能与IGF2BP2紧密结合(图2e)。因此,根据其二级结构,我们构建了另一个带有LINRIS 450-640 nt片段的载体。 RNA下拉分析表明该中间区域(450-640 nt)负责LINRIS和IGF2BP2之间的结合。
通过测量LINRIS和IGF2BP2在人CRC细胞系中的表达,我们发现它们之间呈正相关(图2f,g)。 HCT116和DLD-1细胞中的LINRIS敲低均显著下调了IGF2BP2的表达(图2h)。 此外,敲除LINRIS会显著增加IGF2BP2的泛素化,但会抑制IGF2BP2调节的mRNA(图2i)。 因此,我们认为IGF2BP2可能是LINRIS分子机制的关键,并且该lncRNA可能阻止了IGF2BP2的降解。
3.LINRIS保护IGF2BP2不被自噬降解
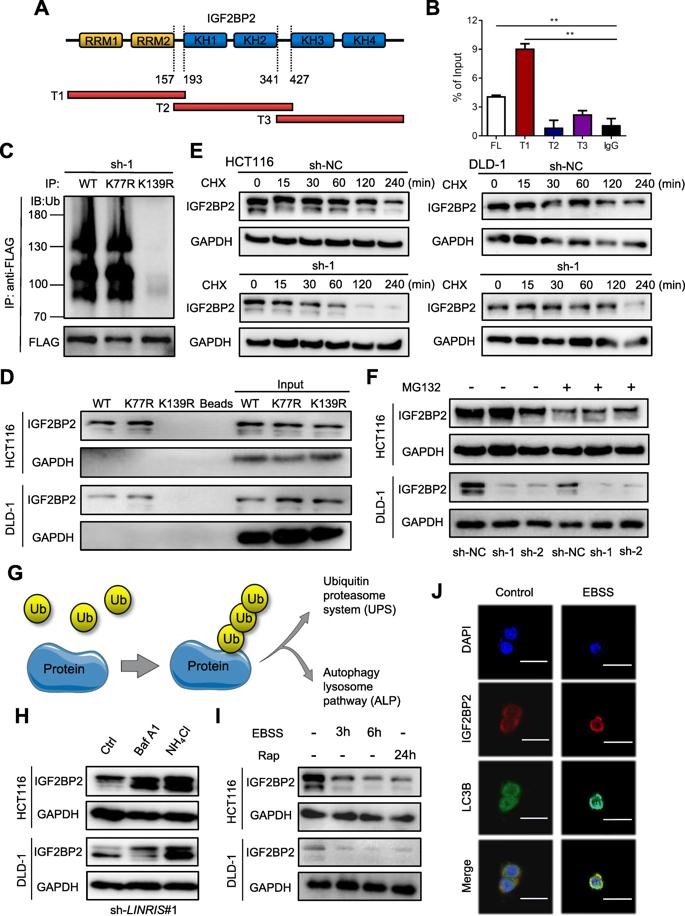
IGF2BP2由2个RNA识别基序(RRM)和4 K同源性(KH)域组成,我们建立了3个带有FLAG标签的载体,其中包含IGF2BP2的片段在非活性区彼此重叠(图3a)。 RIP分析表明LINRIS主要结合到RRM区域(图3b)。 然后,我们从CPLM数据库中获得了实验确定的IGF2BP2泛素化位点。 如图3c所示,与野生型(WT)相比,代替K77R的K139R泛素突变显著损害了IGF2BP2的泛素化。 此外,该突变还消除了RNA下拉测定法中LINRIS和IGF2BP2之间的结合(图3d),表明LINRIS通过掩盖K139抑制了IGF2BP2的泛素化。
为了阐明IGF2BP的降解模式,用蛋白合成抑制剂CHX处理LINRIS表达下调的CRC细胞,其IGF2BP2半衰期比未处理的对照细胞要短(图3e)。然而,在sh-LINRIS转染的细胞中,当用蛋白酶体抑制剂MG132处理细胞时,内源性IGF2BP2表达不会增加(图3f),这表明IGF2BP2的降解可能与比泛素-蛋白酶体途径更复杂的机制有关。
除了泛素-蛋白酶体系统(UBS),细胞蛋白在泛素化后可从自噬-溶酶体途径(ALP)降解(图3g)。如图3h所示,内吞IGF2BP2蛋白的减少被自噬抑制剂bafilomycin A1(Baf A1),NH4Cl和3-甲基腺嘌呤(3-MA)成功逆转。相反,自噬激活剂Earle的平衡盐溶液(EBSS)和雷帕霉素(Rap)降低了IGF2BP2的水平(图3i)。 EBSS处理的细胞还表现出IGF2BP2和LC3B的共定位增加(图3j)。综上所述,提示LINRIS介导的IGF2BP2降解是通过泛素化自噬途径实现的。
4.LINRIS与IGF2BP2相互作用影响MYC介导的糖酵解
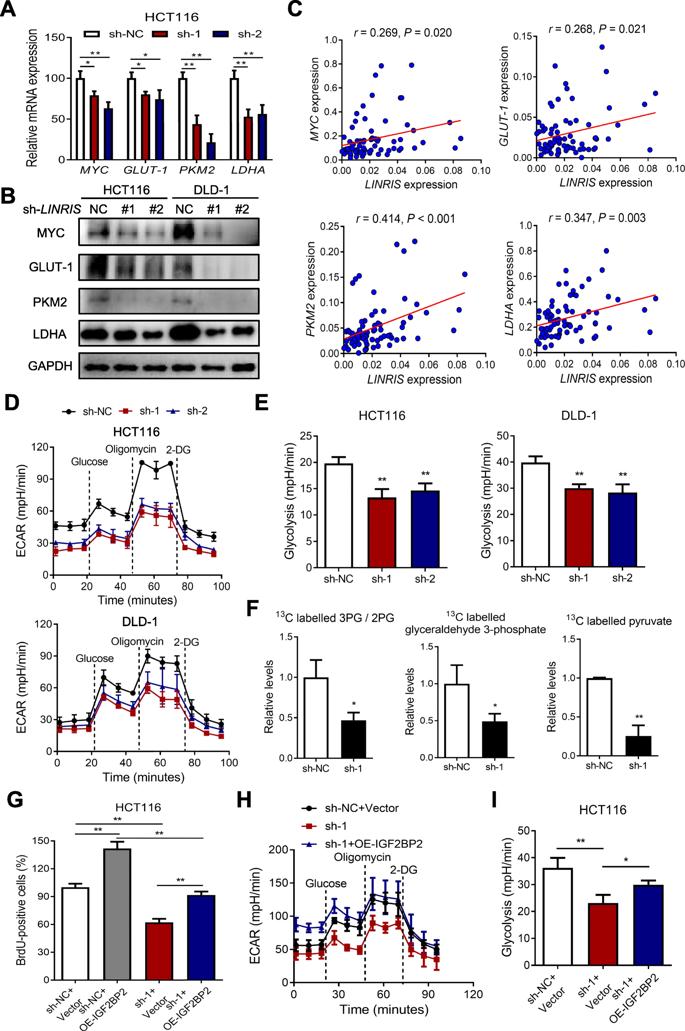
由于MYC的mRNA被IGF2BP2识别为其众所周知的下游靶点,我们研究了LINRIS与IGF2BP2相互作用时糖酵解的变化。如图4a、b所示,LINRIS被敲除后,其介导糖酵解的下游基因GLUT-1、PKM2、LDHA也表现出与MYC一致的水平下降。此外,MYC、GLUT-1、PKM2和LDHA的mRNA水平与CRC组织中的LINRIS水平呈正相关(图4c)。如图4d和e所示,沉默LINRIS可导致HCT116和DLD-1细胞糖酵解的减弱。图4f显示LINRIS基因敲除降低了一些典型的糖酵解产物。综上所述,LINRIS对于维持癌细胞的糖酵解是必要的,糖酵解可能影响CRC的增殖。此外,我们用过表达IGF2BP2的质粒转染了CRC细胞。 如图4g-i所示,在HCT116和DLD-1细胞中,在某种程度上挽救了由LINRIS敲除诱导的增殖和糖酵解受损。
5.LINRIS的抑制抑制了体内CRC的生长
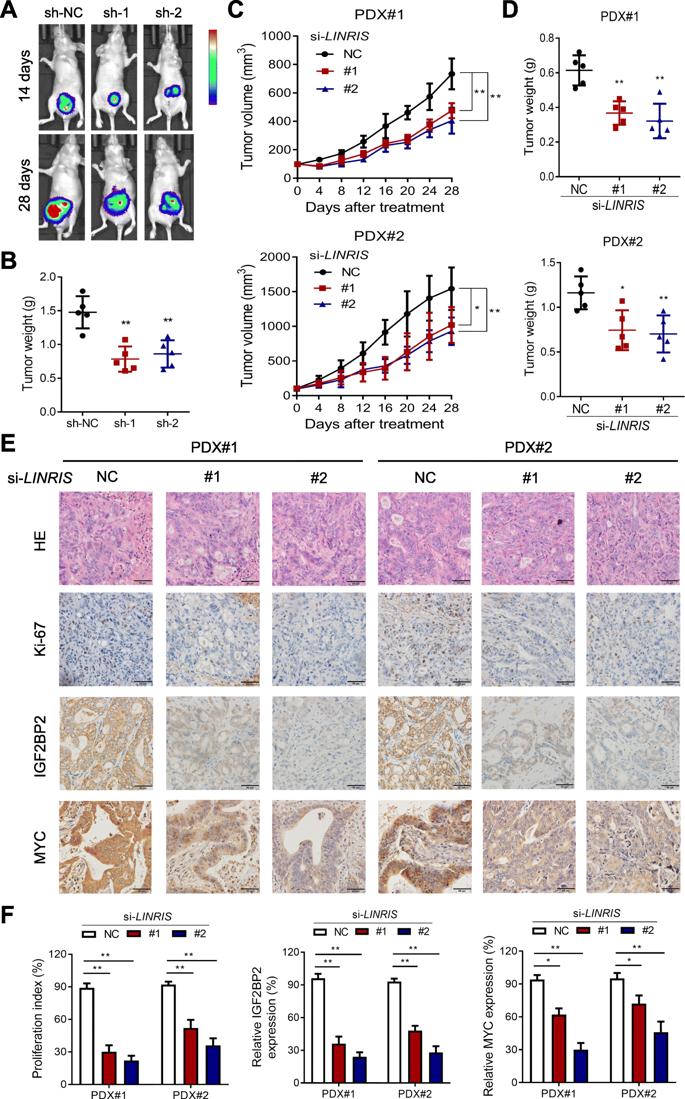
为了研究低LINRIS表达是否会抑制体内CRC肿瘤的生长,我们向BALB/c裸鼠的盲肠注射了具有或不具有LINRIS敲低的HCT116细胞(sh-NC,sh-1和sh-2)。 与具有sh-1或sh-2的细胞相比,HCT116/sh-NC细胞在4周内形成了更大,更重的原位肿瘤(图5a和b)。此外,我们用异种移植(PDX)模型测试了抗LINRIS治疗的体内作用。如图5c,d所示,通过RNAi抑制LINRIS可显着抑制肿瘤的生长。切除的肿瘤切片的IHC染色显示,随着LINRIS的耗竭,与IGF2BP2和MYC一致的Ki-67表达降低(图5e和f)。总体而言,阻塞LINRIS-IGF2BP2-MYC轴是有希望的CRC治疗方法。
6.GATA3抑制LINRIS的转录活性
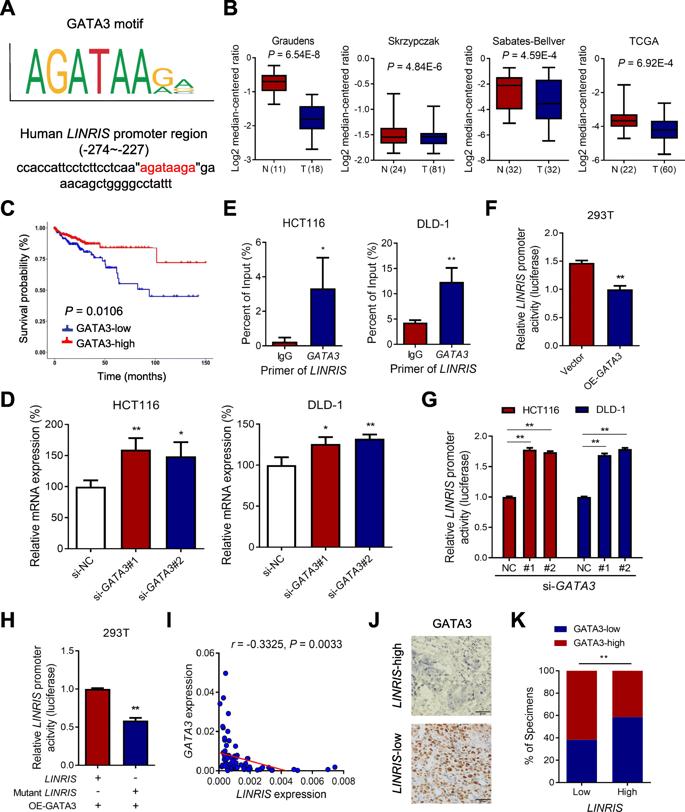
为了研究调控LINRIS转录的因素,我们使用JASPAR数据库预测了潜在的转录因子,并发现GATA3具有与LINRIS启动子结合的最大可能性(图6a)。使用Oncomine数据库分析了来自多个实验的CRC微阵列数据,该数据表明GATA3在CRC组织中的表达水平低于正常组织(图6b)。此外,根据TCGA数据库,更高的GATA3表达与CRC患者的更好预后相关(图6c)。抑制GATA3成功地解放了LINRIS的转录(图6d)。 ChIP-PCR分析显示LINRIS启动子区域被GATA3占据(图6e),荧光素酶启动子分析显示GATA3过表达抑制LINRIS活性,反之亦然(图6f,g)。此外,LINRIS启动子中GATA3结合位点的突变消除了这种转录调控(图6h)。通过分析中山大学癌症中心的人类CRC样本中LINRIS和GATA3的mRNA表达,我们还观察到它们之间呈负相关(图6i)。我们还通过RNA ISH分析测量了LINRIS的表达,并通过IHC分析测量了GATA3的表达(图6j)。如图6k所示,增加的LINRIS表达更可能伴随着GATA3表达的降低,反之亦然。总之,GATA3抑制了LINRIS的转录。
7.LINRIS-IGF2BP2-MYC轴与CRC的发生发展密切相关
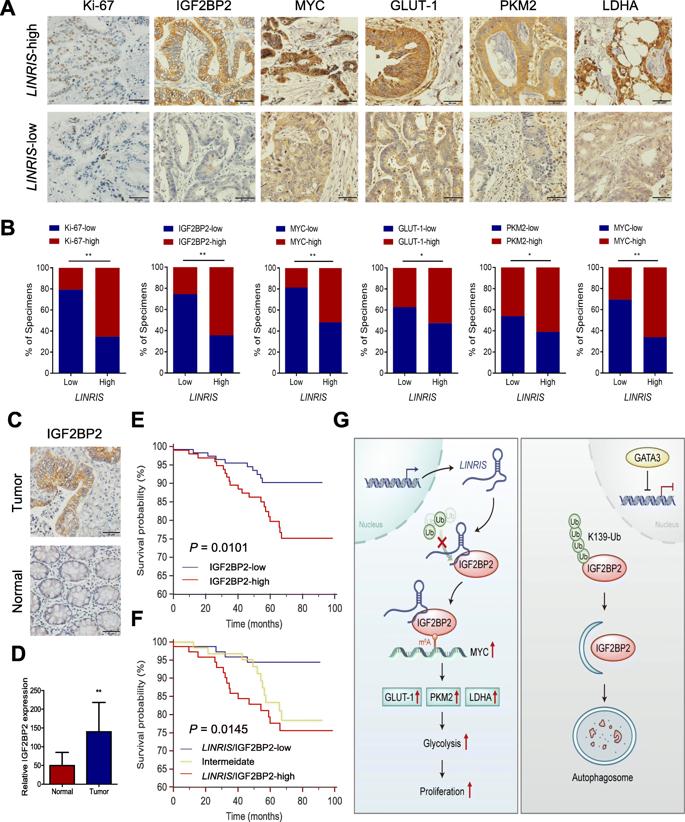
为了进一步说明LINRIS-IGF2BP2-MYC轴在CRC发育中的临床和病理学意义,我们分析LINRIS、Ki-67,IGF2BP2,MYC,GLUT-1,PKM2和LDHA的表达(图7a)。如图7b所示,高LINRIS组与Ki-67,IGF2BP2,MYC,GLUT-1,PKM2和LDHA的高表达相一致,而低LINRIS组表现出相反的结果。此外,与正常组织相比,这些患者的肿瘤组织中的IGF2BP2表达明显更高(图7c,d)。 IGF2BP2的较高表达也与CRC患者的预后不良有关(图7e)。高LINRIS / IGF2BP2组的预后较其他两组差(图7f)。综上所述,LINRIS-IGF2BP2-MYC轴深刻影响了CRC的发展和预后,并成为潜在的治疗靶点。
结论:
我们在CRC中发现了一种名为LINRIS的高表达lncRNA。LINRIS通过泛素化-自噬途径阻断IGF2BP2的降解。因此,MYC介导的糖酵解被下调,抑制了体内外CRC细胞的增殖。LINRIS-IGF2BP2-MYC轴促进CRC的进展。LINRIS是一种独立的CRC预后生物标志物。






