新发现-纳米微球治疗结肠炎
炎症性肠病(IBD)是一类发病机制尚不清楚的慢性肠道炎症性疾病,包括溃疡性结肠炎和克罗恩病。其临床表现为腹痛、腹泻和粘液脓血便等症状。近年来其发病率在我国快速增长,2015年时我国患病人数已达到35万,近十年患者人数增长24倍。由于缺乏有效的治疗药物,IBD是不可治愈的疾病。随着病情的发展可以引起肠道致残性改变,包括肠穿孔、肠梗阻和肠癌等,严重影响病人生活质量。
在炎症反应过程中,肠黏膜屏障破坏,病原微生物进入固有层,激活固有免疫和获得性免疫系统而诱发炎症反应,这种炎症反应又会进一步破坏肠上皮的组织结构,进而导致更多的病原菌进入固有层,加剧炎症反应。目前,关于溃疡性结肠炎的研究主要集中在免疫细胞过度激活的调控机制上。然而,肠道上皮在炎症反应中的功能和作用长期被人们忽视。
2019年2月16日,《Gastroenterology》(IF=20.773)杂志发表“MicroRNA-31 Reduces Inflammatory Signaling and Promotes Regeneration in Colon Epithelium, and Delivery of Mimics in Microspheres Reduces Colitis in Mice”文章,此报道首次发现了炎症信号在结肠炎中可以激活肠上皮细胞的“自我修复”机制,即受炎症信号诱导的一种短核苷酸片段microRNA—miR-31负反馈地抑制上皮细胞炎症反应同时促进上皮再生;并建立了一种适合直肠给药的miR-31纳米-微球体药物,非常显著地预防和治疗了结肠炎。
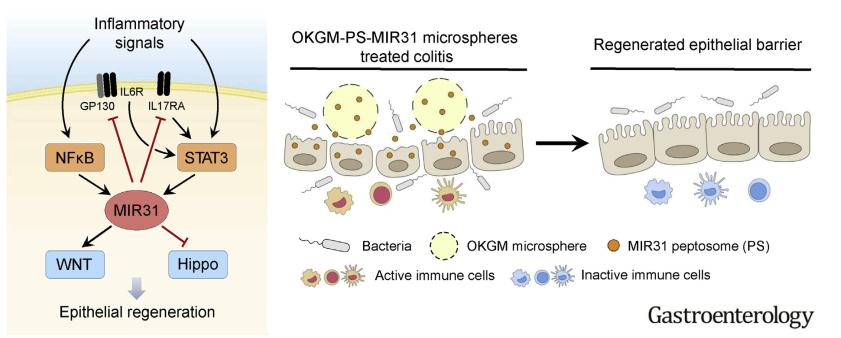
此研究路线图-促炎症因子受体IL-17R和受体结合蛋白Gp130负反馈抑制炎症反应,并通过激活WNT和抑制Hippo信号通路促进肠上皮再生过程。miR-31模拟物纳米-微球体药物可以显著促进在炎症反应中损伤上皮的修复过程。
一、MIR31在IBD发炎的黏膜中表达增加,并受STAT3和NF-kB信号通路的调节
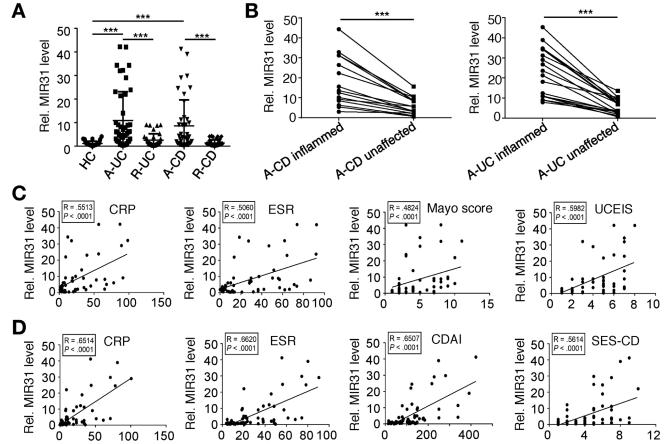
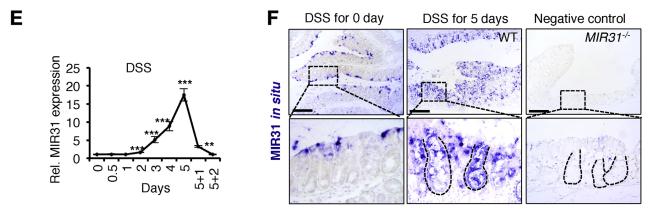
结肠炎(IBD)包括溃疡性结肠炎(UC)和克罗恩疾病(CD);葡聚糖硫酸钠(DSS)诱导小鼠实验性结肠炎;炎症性肠粘膜中MIR31表达水平与UC患者C反应蛋白,红细胞沉降率,Mayo评分和UC内镜严重程度指数以及C反应蛋白,红细胞值呈正相关。CD患者中C反应蛋白,红细胞沉降率,CD活性指数和CD的简单内镜评分值分别与MIR31表达水平呈正相关(图1C和D)。DSS治疗后发炎的结肠中MIR31的急剧上调(图1E和F)。在经过5天的脉冲后停药2天后,MIR31表达迅速下降,恢复到治疗前的基线(图1E)。综上所述,MIR31主要在结肠上皮细胞中表达。在白细胞和基质细胞中也观察到了DSS诱导的MIR31表达上调(补充图1B)。MIR31的启动子中鉴定了1个STAT3和2个NF-kB结合位点(补充图1C)。
二、MIR31的丢失会加剧炎症反应并延迟上皮再生

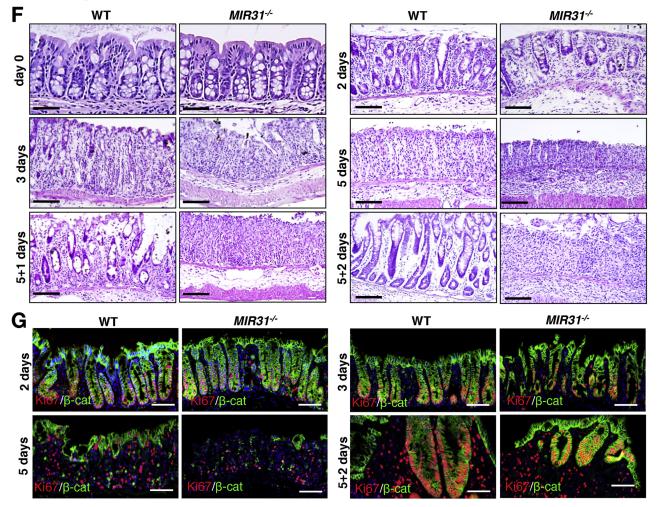
MIR31缺失对结肠的影响.补充图结果:通过同时使用MIR31种系敲除(KO)和Villin Cre驱动的结肠上皮条件性KO(cKO)小鼠(补充图2A)。与对照组相比,MIR31 KO和cKO小鼠的结肠长度没有明显改变(补充图2B)。隐窝细胞增殖,尖端细胞凋亡,或野生型(WT)和KO小鼠之间的杯状细胞数(补充图2C–I)在饮用水中施用DSS,可减轻WT和MIR31 KO小鼠的结肠炎。给予DSS 5天,然后恢复3天。 DSS治疗4天后,MIR31 /小鼠的体重减轻比野生型小鼠明显多,并且在治疗终止时体重没有恢复(图2A)。与对照相比,存活率降低(图2B),较短的结肠长度(图2C和D),较大的脾脏(图2C和D)和较高的临床疾病评分(图2E)。时程分析显示严重发炎在MIR31 /小鼠中对DSS治疗的运动反应和DSS去除后再生反应受损。
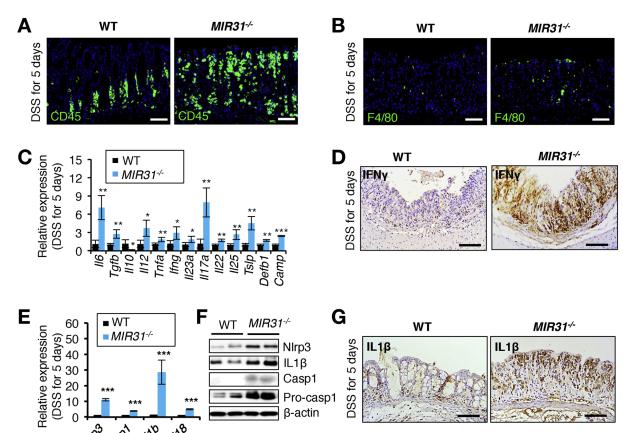

DSS治疗后MIR31 /小鼠中增强的免疫反应。我们发现增加DSS治疗的MIR31 /小鼠中白细胞和巨噬细胞的数量(图3A和B),促炎细胞因子和炎症小体成分的水平增加以及炎性抑制剂IL10的水平降低(图3C–G)。促炎NF-kB和STAT3信号通路在MIR31 /小鼠中被过度激活(图3H和I)。综上所述,MIR31的丢失导致免疫反应亢进进行DSS治疗。
三、MIR31直接抑制Il6st(编码GP130),Il7r,和Il17ra在结肠上皮细胞内

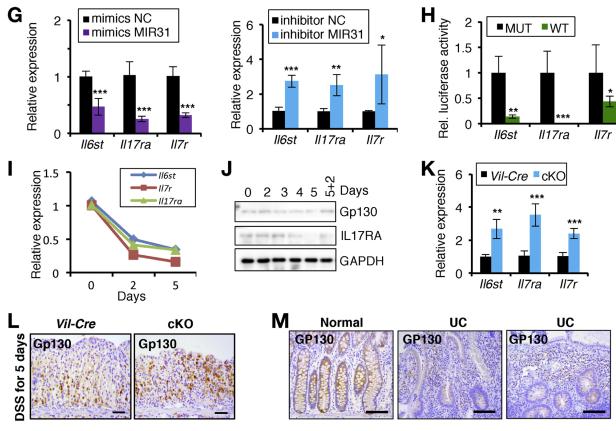
RNA和DSS处理后,MIR31 /小鼠结肠中Il6st,Il7r和Il17ra的蛋白质水平显着升高(图4A和B)。DSS治疗5天后,MIR31 /结肠中GP130 GP,IL7Rt和IL17RAt细胞的数量显着增加(图4C–F)。体外分析显示,MIR31模拟物抑制了Il6st,Il7r和Il17ra的表达,而MIR31抑制剂则促进了它们的上调(图4G),表明这些推定的靶基因受MIR31以细胞自主方式调节。 3’端UTR-荧光素酶波特试验显示,MIR31模拟物显着抑制了WT Il6st,Il7r和Il17ra 3?UTR活性,但对MIR31结合位点发生突变的报告基因没有明显影响(图4H和补充图9B)。在DSS处理过程中,Il6st,Il7r和Il17ra的表达下降(图4I和J),与MIR31水平成反比。这些MIR31靶基因的上调在cKO结肠中得到进一步证实(图4K和L)。在人UC组织中GP130表达降低(图4M)。总之, Il6st,Il7r和Il17ra的转录本是MIR31的直接靶点,并且它们的调节可能会影响MIR31在抑制肠粘膜免疫反应中的作用。
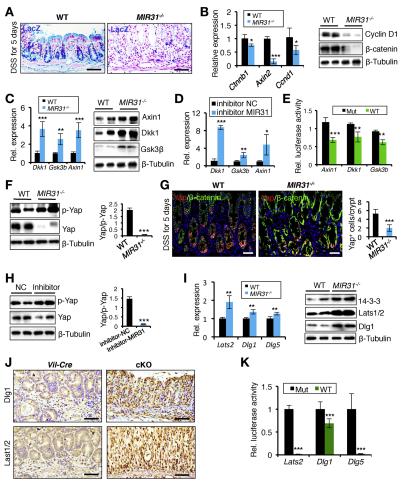
WT小鼠的结肠上皮均激活了报告基因活性,而在MIR31中其报告活性明显降低/结肠(图5A和补充图11A)。,DSS后RNA和蛋白质水平在MIR31 /小鼠结肠中均显着降低了Ctnnb1(编码b-catenin)和WNT靶基因Ccnd1(编码cyclin D1)和Axin2的表达水平治疗(图5B和补充图11B)。在5个月后MIR31 /小鼠结肠中这些Wnt拮抗剂的水平上调DSS治疗的天数(图5C和补充图11E)。在人UC样品中观察到DKK1和AXIN1减少(补充图11F)。体外测定还显示,在用MIR31抑制剂治疗时,这些假定的靶基因的表达上调(图5D)。3’UTR-荧光素酶报告基因检测结果表明,MIR31模拟物显着抑制了WT Axin1,Gsk3b和Dkk1 3?UTR活性,但对MIR31结合位点发生突变的报告基因没有明显影响(图5E和补充图9B)。总之,MIR31可以通过以下途径激活WNT信号通路。
四、基于MIR31的OKGM-PS微球递送足以缓解DSS诱导的炎症
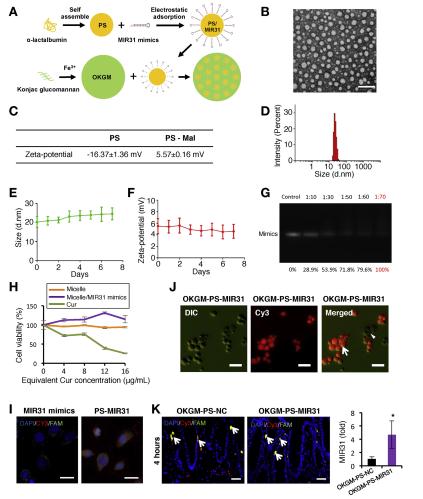
为了确定在结肠炎中用纳米粒子靶向MIR31的可行性,我们设计了一种基于蛋白质的封装微球作为MIR31模拟传递系统(图6A)。在该系统中,α-乳酸白蛋白(a-La)在Glu和Asp位点被部分水解以生成两亲性肽,可以自组装成具有许多带负电荷羧基的约20 nm肽体(PSs)22(图6B和C)。为了通过静电吸附连接MIR31模拟物,我们使用马来酰亚胺(Mal)反转PS表面的Zeta电位(图6C)。PStMal的大小(直径)和Zeta电位随时间稳定(图6D–F)。然后使用Mal将MIR31模拟物加载到a-La PS上(图6G)。载有MIR31的模拟PS(PS-MIR31)纳米颗粒具有低细胞毒性(图6H),并且能够将MIR31传递到细胞中(图6I)。为避免肠道中基于肽的纳米颗粒快速降解,我们将它们封装在微球中,该微球是通过将羧基丰富的TEMPO氧化魔芋葡甘露聚糖(OKGM)与Fe3 +OKGM-PS-MIR31)交联而形成的(图6J)。 OKGM-PS-MIR31微球的尺寸范围为10到50毫米(图6J)。然后通过灌肠施用OKGM-PS-MIR31微球以检查其体内治疗效果。OKGM-PS-MIR31可以将PS-MIR31释放到结肠上皮细胞(图6K),导致MIR31增加。
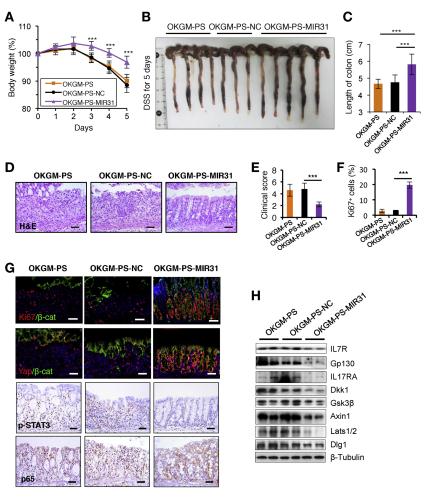
OKGM-PS-MIR31微球可以显着拯救MIR31 /小鼠的DSS结肠炎相关表型。该文献测试OKGM-PS-MIR31微球对WT小鼠中DSS诱导的结肠炎的预防作用。OKGM-PS-MIR31微球减轻了炎症,并减轻了结肠上皮的完整性,这通过增加体重,减少免疫反应,延长结肠长度和增加上皮细胞增殖来表明(图7A–G)。与之前的发现一致,OKNT-PS MIR31处理的小鼠结肠中的WNT和Hippo信号通路发生了改变(图7G和补充图16A和B),而MIR31靶基因减少了(图7H和补充图16C)。






