DNA甲基化不足影响水肿性严重急性营养不良
严重急性营养不良(SAM)每年直接或间接导致数百万的5岁以下儿童死亡。SAM有两种表型-水肿SAM(ESAM),其包括kwashiorkor and marasmic-kwashiorkor的症状,和非水肿SAM(NESAM)或消瘦的症状。NESAM通常以体重减轻和消瘦为特征,而ESAM则以双侧点性浮肿的存在为特征,并且通常具有更明显,更严重的多器官功能障碍,包括肝,造血和胃肠道功能障碍,以及皮肤和头发异常。
儿童急性ESAM没有明确的分子或遗传相关性;然而,ESAM和NESAM在1-碳循环的组成代谢物的通量具有生化差异。在稳态补料期间,尽管仍然病重,但ESAM患者在将甲硫氨酸转化为S-腺苷甲硫氨酸(SAM)时,其必需氨基酸甲硫氨酸的浓度明显降低,且甲基基团和总甲硫氨酸通量显着降低。SAM-e是细胞组分甲基化所需的甲基的主要来源,包括DNA的甲基化在有丝分裂期间。从SAM恢复后,未观察到ESAM和NESAM在1碳代谢上的这些差异,这意味着营养和饮食的恢复涉及急性病期间生化变化的逆转。虽然以前的研究表明,在个人改变DNA甲基化与严重急性营养不良的历史更普遍的,没有人比较过水肿和非水肿形式的SAM之间的DNA甲基化,特别是在急性疾病期间。由于仅在急性营养不良时才表现出两种形式的SAM的表型差异,因此在急性疾病期间发生的伴随分子变化可能潜在地突出了不同病理生理的重要驱动因素。我们假设在有丝分裂率高的细胞中,与NESAM对应者相比,患有ESAM的重症儿童的DNA甲基化程度较低,而恢复的SAM个体之间的甲基化差异则不会那么明显。考虑到DNA甲基化,基因调控和序列变异之间的相互关系,
2019年12月,Katharina V Schulze等人在nature communications发表一篇 “Edematous severe acute malnutrition is characterized by hypomethylation of DNA.”的SCI文章。在这篇文章里,作者使用450 K微阵列评估309名SAM儿童的口颊细胞的全基因组DNA甲基化。相对于NESAM,ESAM的特征是多个明显的甲基化程度较低的基因座,这在SAM恢复的成年人中未观察到。基因表达和甲基化显示正相关和负相关,表明对SAM的复杂转录反应。次甲基化基因座与营养和代谢异常有关,包括脂肪肝和糖尿病,并且似乎受到遗传变异的影响。作者的表观遗传学发现为ESAM中报道的异常1-碳代谢提供了潜在的分子联系,并支持在ESAM疾病中考虑补充甲基治疗。
整个队列位置和时间点的采样时间表概述:
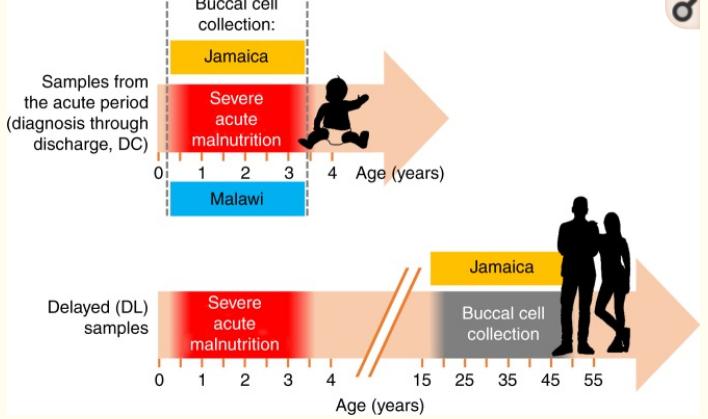
该样本来自Malawi and Jamaica-309名预期招募的急性病儿童(DC);65名来自牙Jamaica的成年SAM幸存者,他们是在在急性营养不良事件发生后16年或更长时间后招募的(DL)。
一、DNA的甲基化不足是急性ESAM的特征
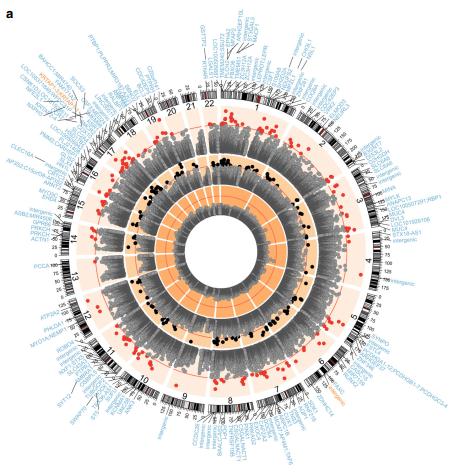
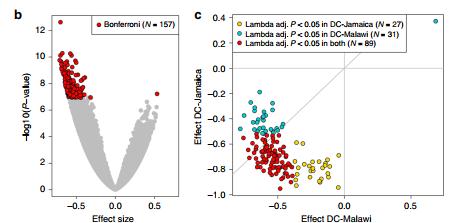
ESAM中的DNA低甲基化。a将每个基因座的基因组位置相对于其-log 10(P值)作图。从内环到最外环,分别是恢复(DL)单点,急性(DC)单点和基于DC簇的差异甲基化结果。红线表示每次分析的Bonferroni重要阈值。黑色(N = 157)和红色点(N = 166)在各自的分析中均通过了显着性阈值。绘图周围的基因符号表示甲基化显着差异的簇(外环)的10 kb之内的基因。蓝色的基因符号在ESAM中被低甲基化,橙色的基因符号被高甲基化。b所有DC单个站点之间的影响大小的火山图。C Malawi and JamaicaDC样本在N = 157个Bonferroni显着单CpG位点的效应大小和调整后的统计显着性的一致性;在每个国家/地区的分析中,有十个站点对年龄敏感,因此被忽略(方法)。所有P值均基于回归分析的t检验结果。
结果:与NESAM相比,在166个重要DMC中,除两组中共有的差异甲基化簇DMC外,其他所有分子均被甲基化。
二、低甲基化对基因表达有不同的影响
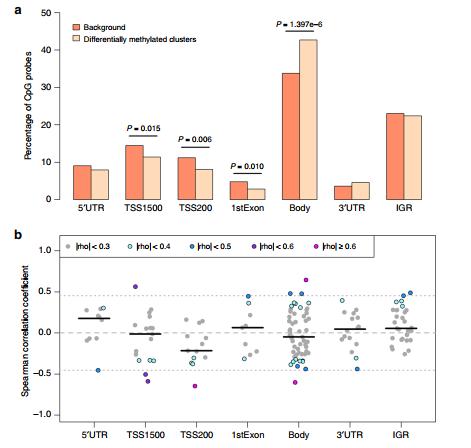
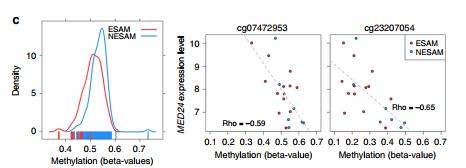
基因特征富集和表达分析。A 通过对急性营养不良儿童的分析,对显着差异甲基化簇(DMC)中的CpG探针进行了基因注释富集分析。通过耗竭或富集的超几何测试比较P值,比较 所有被测试的背景CpG探针的N = 420,500和 DMC 中N = 630 CpG探针的子集。B在另外20名患有SAM的Malawi儿童中,在重要DMC内的各个CpG探针处,平均甲基化与10 kb内高表达基因的平均表达之间的个体内相关(Spearman)。水平黑条表示中位数相关系数,虚线表示零相关性,虚线表示阈值,超过该阈值相关性达到统计显着性(算法AS 89 t检验,P <0.05)。5'UTR:5-prime非翻译区,TSS1500:距转录起始位点1500 bp以内,TSS200:距转录起始位点200 bp以内,3'UTR:3-prime非翻译区,IGR:基因间区。C .DMC重叠MED24中 SAM类型的beta值甲基化水平(左图,N ESAM = 164个样本,N NESAM = 145个样本)旁边的散点图显示了含DMC 的MED24中探针的甲基化水平与MED24的表达值之间的关系(中图和右图)。灰色虚线表示线性模型拟合,而rho值表示Spearman相关系数。
结果:DMC内的CpGs在基因体上显着富集(即编码外显子和内含子;超几何检验,P <1.4×10 -6),并且在转录起始位点(TSS)上游和第一个外显子的调节区相对减少。在其他基因区域,特别是在基因体上,CpG甲基化与基因表达显示出显着的正相关和负相关,表明对急性损伤的转录反应比原先预期的更为复杂。
三、差异甲基化基因座与营养和代谢有关
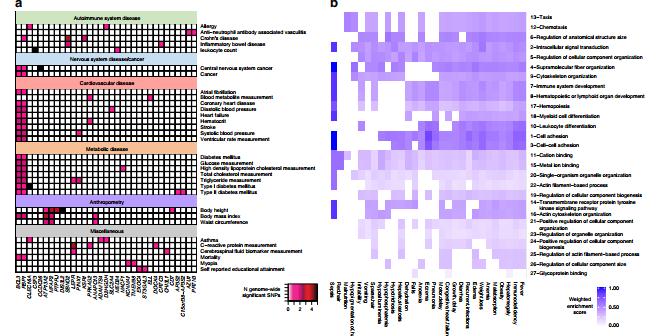
ESAM中的疾病基因富集。A垂直轴上显示了GWAS目录(方法)中的实验因子本体论(EFO),其中ESAM差异甲基化簇(DMC)中代表两个或多个基因,并根据它们共享的父EFO进行了分组。疾病和基因之间的重叠由阴影框指示。与每个框相关的颜色键代表列出的EFO的每个基因的全基因组有效SNP数。B通过研究DMC(SGO;垂直轴)和人类表型本体(HPO)中与kwashiorkor相关的表型(KGO;水平轴)丰富的基因本体的加权富集值。默认情况下,在KGO列表中找不到的SGO的值为0,在KGO列表中和两个列表的前四分位数中找到的SGO的值均为1。 SGO任期前的数字,并基于其总加权浓缩得分。作者对DMC所涵盖的单个基因的更仔细的检查揭示了一些对总体营养尤其是ESAM表型具有潜在重要性的候选基因。






