单细胞RNA测序揭示了人胚胎植入前后滋养细胞命运分化的调控机制
同济大学医学院联合美国洛杉矶加州大学分校和吉安生殖医学中心,2019年10月发表于国际杂志PLOS Biology的一篇研究“Single-cell RNA sequencing reveals regulatory mechanism for trophoblast cell-fate divergence in human peri-implantation conceptuses” (影响因子=8.386),
本实验模拟了人类受孕期胚胎从囊胚到后期早期的发育过程,通过使用体外共培养系统进行Lantation阶段,并从这些概念中分析476个个体滋养细胞的转录体。该研究揭示了调节周围环境的遗传网络,胚胎滋养层发育。在确定滋养层细胞何时发生分化时,确定T-box转录因子3 (Tbx 3)是差异的关键调节因子,细胞滋养细胞(CT)转化为合体滋养细胞(ST)。通过功能缺失验证了TBX 3在滋养层分化中的作用。最后,该研究团队证明了为研究滋养细胞在着床前发育过程中的发育和分化规律提供了有价值的研究资源。
结果一、植入胚胎发育过程中人滋养层细胞的转录组谱
将体外受精产生的概念培养到胚泡期。在胚泡期(第6.5天),转移到装有人原代EM细胞的培养皿中。在第8天,所有共培养的概念动物都从透明带中孵出,并附着在盘子的底部,并采用扁平结构,与以前的报道非常相似(图1B和1G)。
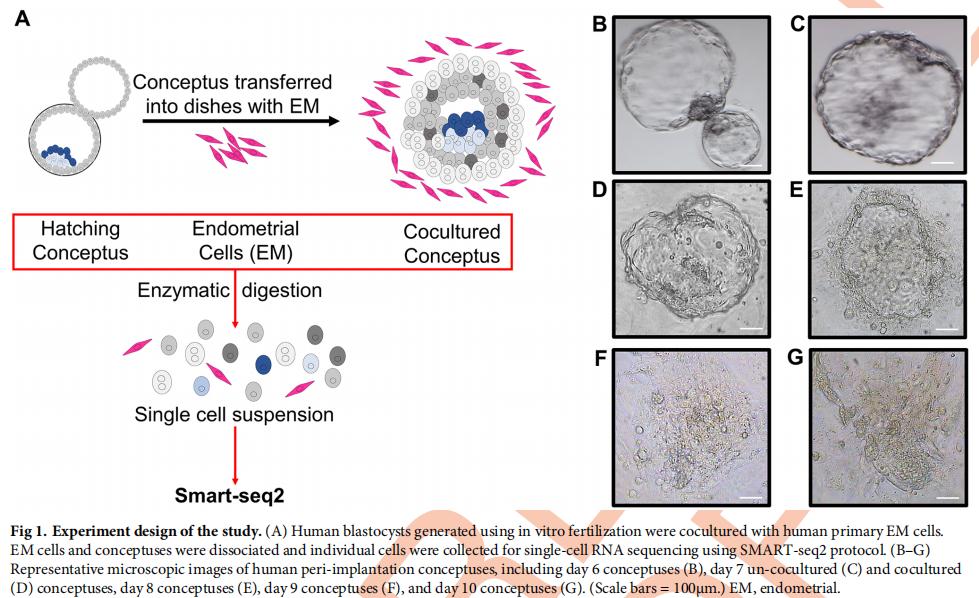
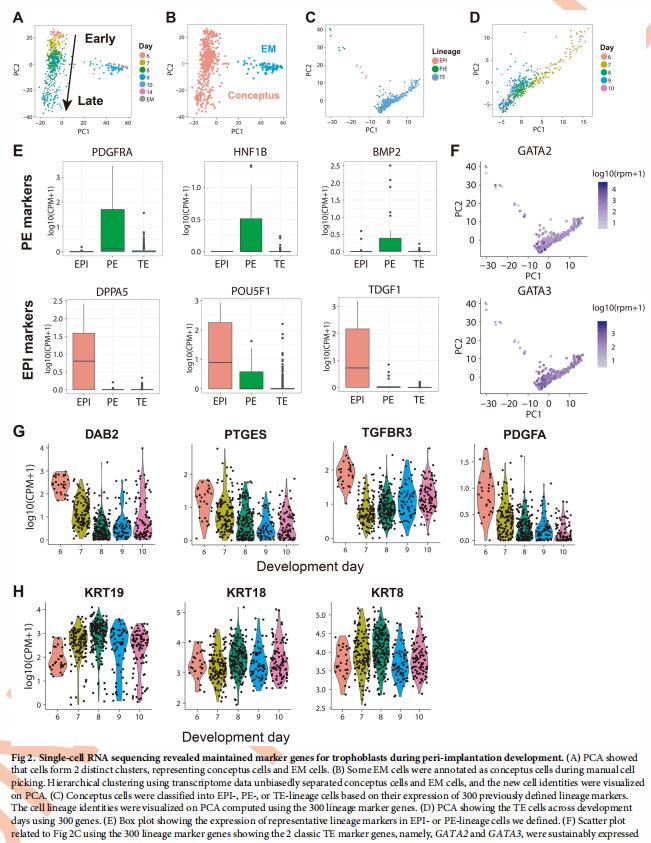
为了获得植入胚胎发育过程中人滋养层细胞的转录组谱,从第6天到第10天收获了19个概念细胞的单细胞,并补充了25个EM细胞。成功地分析了614个单细胞的转录组,主成分分析(PCA)和无偏层次聚类表明概念EM细胞和EM细胞形成2个不同的簇(图2A),并且一些EM细胞在细胞挑选过程中被错误标记为概念细胞(图2B)。
使用300个谱系标记的PCA分析显示,EPI和PE细胞与TE谱系细胞分离(图2C和2D)。此外,EPI和PE细胞与TE相比,其相应的标记基因表达更高(图2E),而特征良好的TE标记(如GATA2和GATA3)在所有TE谱系细胞中均高表达(图2F)。这些结果表明该算法忠实地将EPI和PE谱系细胞与TE谱系细胞分离。
从第6天到第10天,发现5种TE标记,即KRT19,KRT18,KRT8,GATA2和GATA3始终在TE和滋养细胞中高表达(图2F和2H)。总的来说,单细胞RNA-seq数据提供了从胚泡到植入后早期阶段体外培养的人类概念中滋养细胞的全面转录组谱分析。
二、加权基因共表达网络分析表明植入后滋养层细胞发育的遗传程序动力学
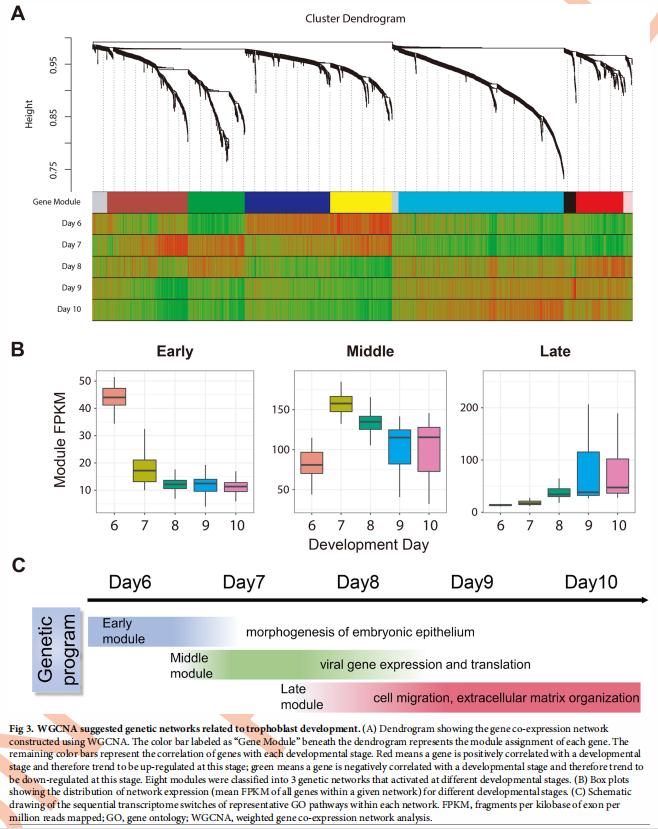
PCA显示滋养层细胞按其发育日分组(图2D)。为了系统地研究遗传程序的动力学,对2,464个基因进行了加权基因共表达网络分析(WGCNA),这些基因在不同发育阶段的滋养层细胞中可变表达。WGCNA确定了8个基因模块,每个模块都包含一组在特定发育阶段倾向于共表达的基因(图3A)。通过将模块表达与发育日联系发现这8个模块共同代表了3个遗传网络,这些网络在第6天,第7-8天和第8-10天特别上调(图3B)。GO术语(例如细胞迁移,细胞外基质组织和对缺氧的反应)富含这些基因,表明激活了滋养细胞入侵(图3C)。 为了进一步鉴定可能在这3个遗传网络中发挥关键调控作用的基因,基于WGCNA量模内基因连通性鉴定了240个中枢基因。结果发现WGCNA集线器基因可能是早期胎盘发育的潜在关键调控基因。
三、单细胞RNA测序揭示了滋养细胞分化的时机
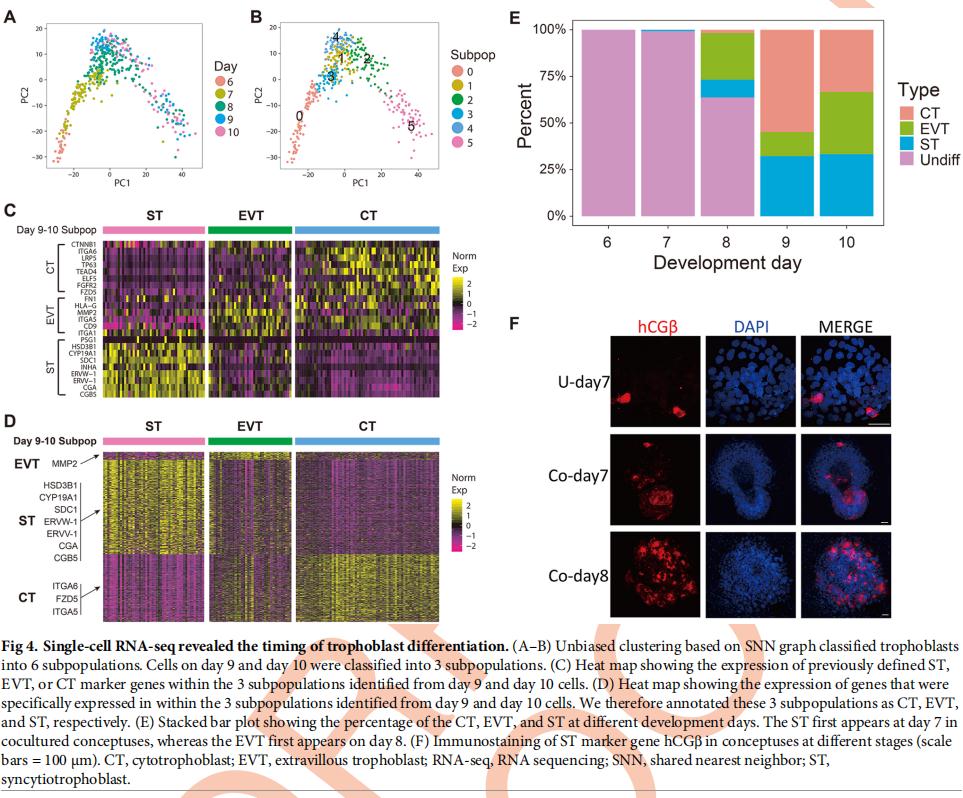
滋养层亚系(例如EVT,CT和ST)衍生自多能滋养层。为了研究多能滋养细胞首次分化为滋养细胞亚系,使用了基于共享最近邻(SNN)图的聚类算法对476个滋养层细胞进行了无偏聚类,并将它们分为6个子种群(图4A和4B)。通过检查先前定义的亚谱系标记基因的表达,发现EVT标记(ITGA5,HLA-G,FN1,MMP2,CD9和ITGA1)或ST标记(CGB5,PSG1,HSD3B1,CYP19A1,SDC1,INHA,ERVW- 1,ERVV-1和CGA在簇2或5中高度表达,而簇4共表达CT标记(ITGA6,TP63,CTNNB1,LRP5,TEAD4,ELF5,FGFR2和FZD5)和EVT标记基因相似到群集1(图4C)。通过鉴定了在簇2、4和5中特异性表达的基因。发现许多ST标记基因,例如HSD3B1,CYP19A1,SDC1,ERVW-1(Syncytin-1),ERVV-1,CGA和CGB,在簇5中特异性高表达。CT标志物,例如ITGA6和FZD5,在簇4中特异性表达。一些EVT标志基因,例如MMP2,在簇2中特异性高表达(图4D)。在第8天ST细胞变得更加丰富(168个细胞中的16个;图4E)。免疫染色显示,最早可在第7天检测到hCGβ阳性细胞,并在第8天变得更为丰富(图4F)。这些结果表明ST细胞首先在第7天后出现,并在第8天后变得更丰富。该研究发现EVT细胞在第7天的整个概念中都没有,但在第8天出现,表明EVT在第7天后产生(图4E)。结果揭示了ST和EVT在体外植入概念中出现的时间过程。
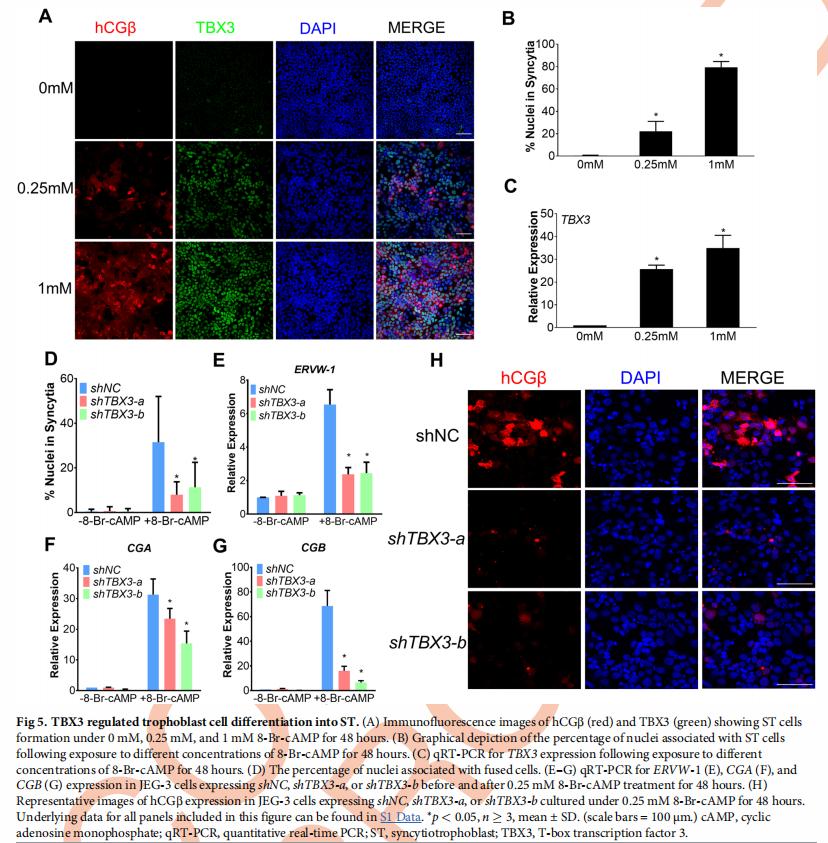
四、ST的开发需要TBX3
通过使用完善的体外滋养细胞分化系统 验证TBX3在滋养细胞分化中的功能,该系统通过用单磷酸环腺苷(cAMP)类似物8-Br-处理滋养细胞细胞系JEG-3来模拟CT到ST分化。在未经8-Br-cAMP处理的对照JEG-3细胞中,细胞融合率低于1%,并且几乎无法检测到ST标记hCGβ表达,表明在处理之前ST的生成极少(图5A和5B,0mM组)。与对照组相比,用8-Br cAMP处理48小时后,JEG-3细胞显示出大大增强的细胞融合和hCGβ,融合率与8-Br-cAMP浓度相关(图5A和5B)。值得注意的是,TBX3在对照组中未表达,但通过8-Br-cAMP处理显着上调,并且上调倍数也与8-Br-cAMP浓度相关(图5A和5C)。
TBX3敲低还显着减少了细胞融合(shTBX3-a和shTBX3-b细胞分别减少了75%±7%和64%±14%;图5D)和下调的ST标记转录,包括人绒毛膜促性腺激素亚基(CGA和CGB),Syncytin(ERVW-1)和其他HERV衍生的基因(ERVV-1和ERVV-2;图5E-5G。免疫染色显示,通过TBX3敲低,hCGβ蛋白水平降低(图5H)。综上所述,TBX3是ST形成所必需的。
五、与EM细胞共培养会影响与滋养层发育相关的基因
与EM细胞共培养7天细胞中有241个基因显着上调,而共7天细胞中有140个基因显着下调(Wilcox测试,调整后p <0.05)。 GO富集分析表明,在共7天的细胞中上调的基因与mRNA处理和翻译等术语相关,而下调的基因与包括骨骼肌组织再生和上皮细胞成熟的术语相关。通过检查DEG,发现与滋养细胞增殖,迁移和侵袭有关的基因——EIF5A。 WEE1,一种调控与滋养层细胞细胞周期进程相关的有丝分裂的基因;这些结果表明与EM细胞共培养可以影响与滋养细胞发育相关的基因的表达。
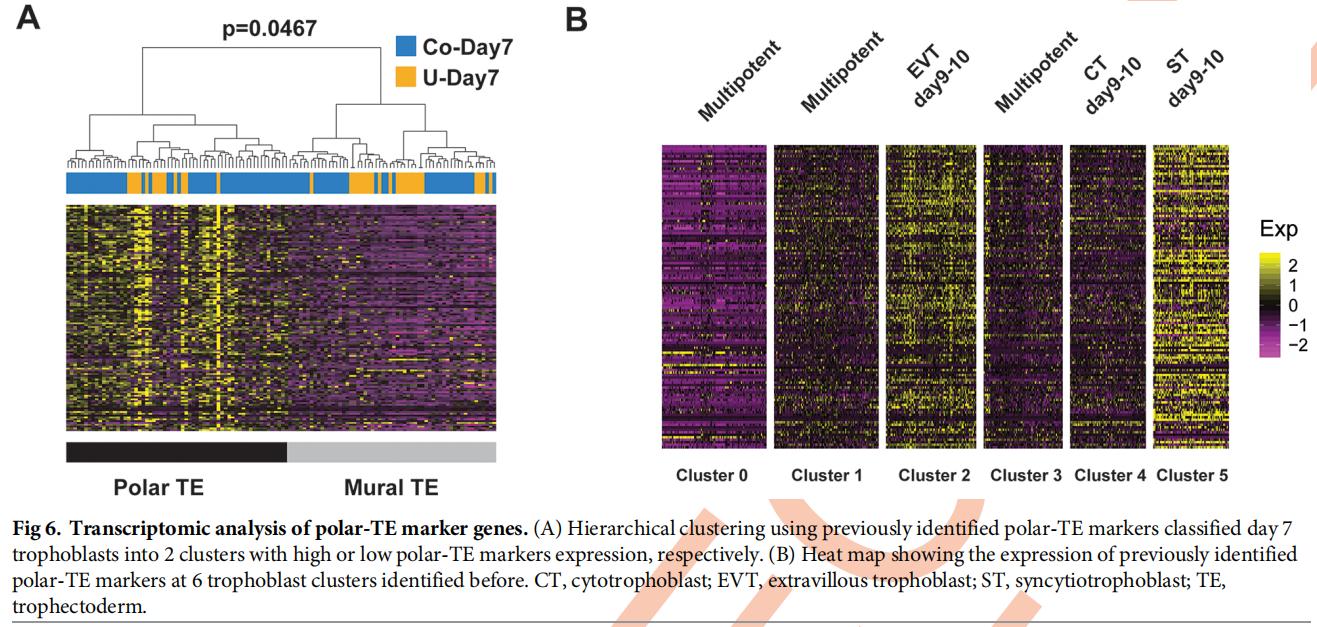
六、转录组学分析揭示了极性TE标记基因在植入后滋养层亚群中的表达模式
使用129个先前鉴定的极性TE标记进行scRNA-seq数据分层聚类,将第7天的滋养细胞牢固地分为2个亚群,这与第7天存在的极性和壁厚TE一致(图6A)。然后发现极性TE标记在第6天和第7天非共培养的细胞中均低表达,在不同发育天的CT细胞中均中等表达。有趣的是,在包括EVT和ST在内的分化的滋养细胞中,极性TE标记显着上调(图6B)。
结论:
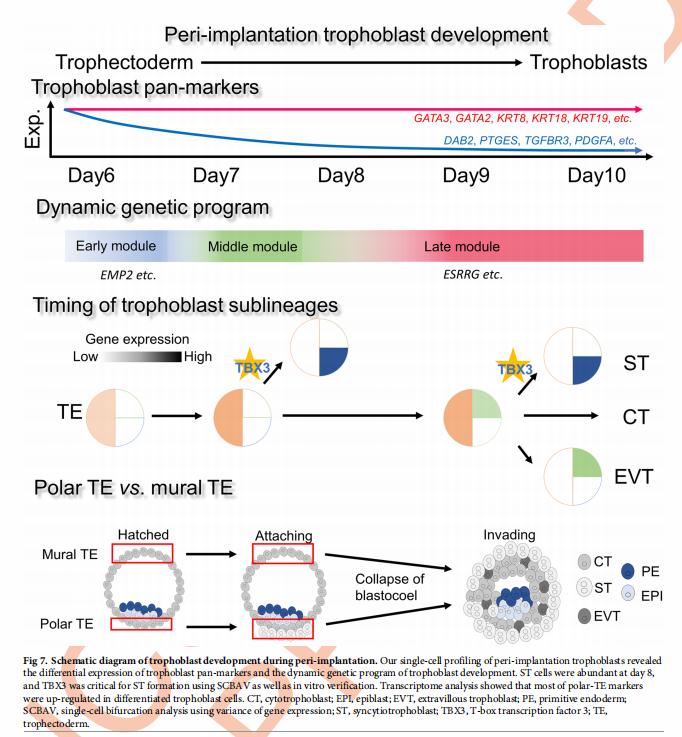
该研究建立了植入后滋养层细胞的单细胞转录组谱,发现TBX3作为人类滋养细胞分化的“必需上游”调节剂,发挥了新的作用。 为后续的研究提供了独特的资源,用于了解与早期滋养层缺陷相关的早期胎盘发育和发病机理。






