外泌体作为核酸治疗载体的突破性进展
栏目:最新研究动态
发布时间:2020-04-26
核酸疗法是一种将核酸传递至目标细胞和组织治疗疾病的疗法,在人类疾病治疗方面有巨大潜力......
核酸疗法是一种将核酸传递至目标细胞和组织治疗疾病的疗法,在人类疾病治疗方面有巨大潜力。然而,基于核酸的疗法在体内基因传递方面存在毒性、免疫原性、无法跨越血脑屏障等问题。而外泌体因能克服这些局限而有望成为核酸药物的新载体。
最近nature子刊刊登了一篇运用非遗传策略克服外泌体核酸运载局限的文章,使我们看到了外泌体作为核酸疗法载体的美好前景。

简单来说,这一技术是用质粒DNA转染细胞后,通过局部、瞬时电刺激(细胞纳米穿孔)促进携带核酸和靶向肽的外泌体释放。与其他外泌体生产策略相比,细胞纳米穿孔产生的外泌体要高出50倍,而且外泌体携带的mRNA最多能增长1000倍,即使是基础分泌低的细胞也能达到这一水平。
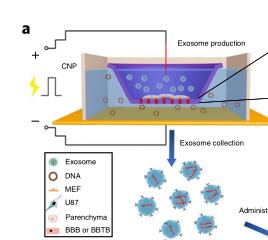
研究者在神经胶质瘤小鼠模型中验证了纳米穿孔技术生产的外泌体的功能。
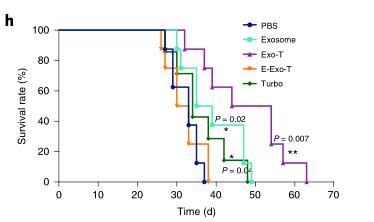
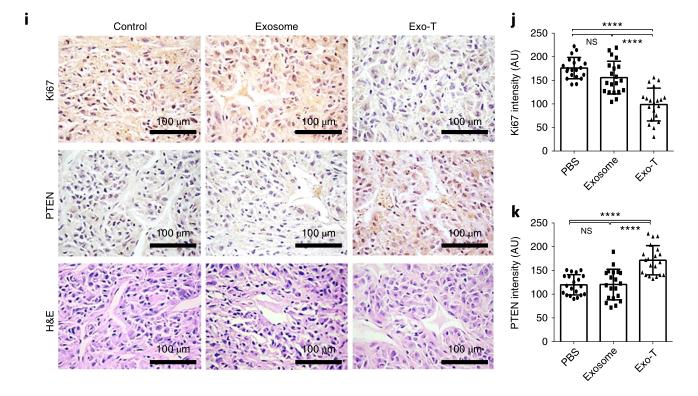
细胞纳米穿孔产生的高PTEN含量的外泌体“Exo-T”显著延长了小鼠的生存期;小鼠肿瘤组织HE染色显示,Exo-T恢复了PTEN在肿瘤组织中的表达,抑制了肿瘤组织中细胞的增殖。当然,寻找产生治疗性外泌体的最佳细胞来源、开发依托于纳米穿孔技术的可用于大规模生产的工艺仍有很长的路要走,但这一研究进一步支持了治疗性外泌体的翻译潜力,并提供了一种简单的策略来扩展其在临床应用中的用途,是外泌体治疗方向的一大突破。






