Kindlin-2通过促进MOB1的降解来抑制Hippo信号通路
Hippo信号通路在发育和癌症进展中起着关键作用。然而,本质上抑制这种途径的分子还不太为人所知。“Kindlin-2 Inhibits the Hippo Signaling Pathway by Promoting Degradation of MOB1”一文研究报道了黏着斑分子Kindlin-2通过与MOB1相互作用并降解MOB1和促进MOB 1与E3连接酶praja2之间的相互作用来抑制希波信号传导。Kindlin-2因此抑制LATS1和YAP的磷酸化,并促进YAP转位入核,在核中激活下游Hippo靶基因转录。Kindlin-2缺失激活Hippo/YAP信号并减轻单侧输尿管梗阻的Kindlin-2敲除小鼠的肾纤维化(单侧输尿管阻塞)。而且,肾纤维化患者样本中Kindlin-2水平与MOB1和磷酸化YAP呈负相关。

文章亮点:
1.Kindlin-2通过其E3连接酶praja2介导MOB1蛋白酶体降解
2.Kindlin-2通过促进MOB1的降解抑制YAP的磷酸化
3.Kindlin-2耗竭激活Hippo途径,减轻单侧输尿管阻塞诱导的肾纤维化
4.长效Kindlin-2 siRNA对单侧输尿管阻塞诱导的肾纤维化具有治疗价值
图形摘要:
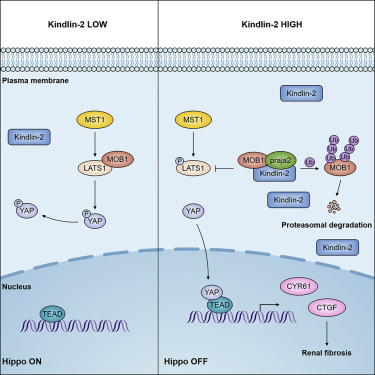
结果:
一、Kindlin-2与MOB1相互作用并抑制Hippo信号通路的激活
Kindlin-2在质谱分析中被鉴定为与MOB相互作用,表明Kindlin-2参与了Hippo信号通路。此外,内源性MOB1在HEK293T细胞中与Kindlin-2和FLAG-Kindlin-2共免疫沉淀(图1A和1B)。相反,内源性Kindlin-2在HEK293T细胞中被MOB1共免疫沉淀(图1C)。这些结果表明Kindlin-2和MOB1在活细胞中相互作用。谷胱甘肽转移酶(GST)下拉结果显示MOB1与Kindlin-2的氮端和中间区都有很强的相互作用,而与碳端的相互作用很弱。免疫荧光染色显示Kindlin-2和MOB1共定位于HK2细胞的细胞质(图1d)。上述数据表明Kindlin-2直接与MOB1相互作用。接下来确定Kindlin-2和Hippo信号通路之间是否存在调节关系(图1e和1F)。Kindlin-2过表达导致MOB1、pMOB-35、pLATS1-909和pYAP-127水平下降。然而,对经前S1、经前T1、经后T1、经前S1或经后叶无明显影响。Kindlin-2表达的减少导致MOB1、pMOB-35、pLATS1-909和pYAP-127水平的增加,这表明希波信号的激活,但是没有观察到对pMST1、MST1、LATS1或YAP的明显影响(图1E和1F)。此外,Kindlin-2过表达导致HKC和HEK293A细胞核中YAP水平升高,而Kindlin-2表达降低导致细胞核中YAP水平降低, 核中的YAP水平是根据Kindlin-2功能的获得或丧失(图1G)。qPCR显示Kindlin-2过表达促进CTGF和CYR61mRNA表达。相反,Kindlin-2的表达减少受到抑制CTGF和CYR61mRNA表达(图1H)。因此,Kindlin-2抑制MOB1的表达和磷酸化。MOB1水平的降低会抑制LATS1的完全磷酸化;YAP的去磷酸化促进其向细胞核的转移,在细胞核中它促进下游靶CYR61和CTGF的转录。该机制在中建模图1. 虽然Kindlin-2不影响YAP的水平,但Kindlin-2可能通过不同的上游机制调节Hippo/YAP信号通路。
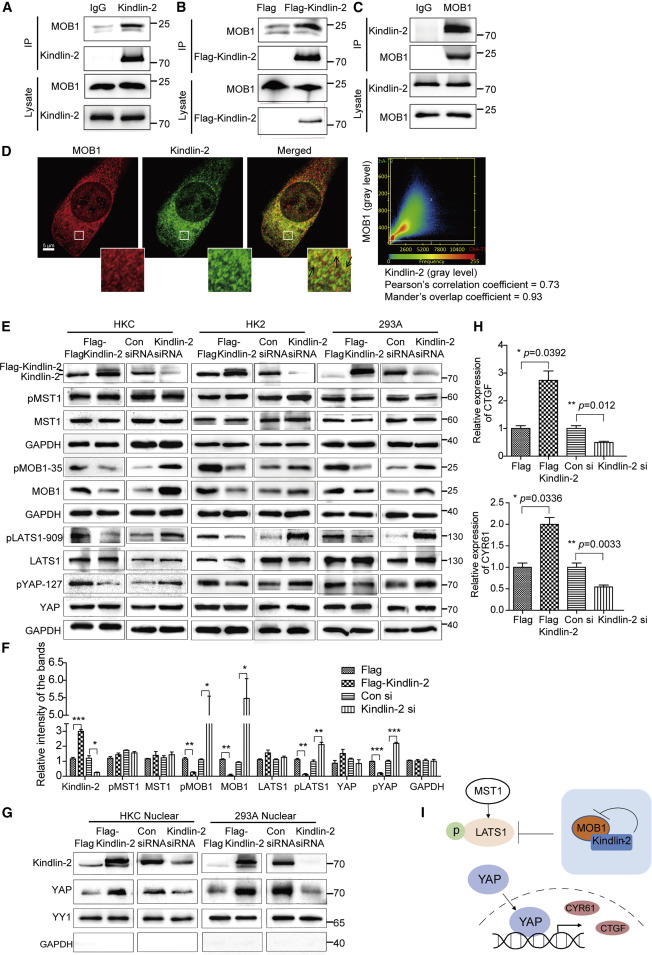
图1. Kindlin-2与MOB1相互作用并抑制Hippo(Hippo)通路的激活
二、Kindlin-2介导MOB1蛋白酶体降解
Kindlin-2不影响MOB1HEK293T或HKC细胞中的转录(图2A和2B)。探讨Kindlin-2介导MOB1降解的机制发现,在HEK293T细胞中过表达的FLAG-Kindlin-2以剂量依赖性方式显著降低内源性MOB1的蛋白水平(图2C)。此外,Kindlin-2降低MOB1水平的作用通过用MG132蛋白酶体的抑制剂 (图2D),表明Kindlin-2对MOB1降解的影响是由蛋白酶体蛋白降解途径介导的。使用Cycloheximide追踪试验测量了Kindlin-2存在或不存在时MOB1的周转率发现,与在HEK293T和HKC细胞中使用空载体相比,用Kindlin-2转染导致内源性MOB1的半衰期显著减少(图2E和2F)。与在HEK293T细胞中使用空载体时相比,用Kindlin-2小干扰核糖核酸 (siRNA) 转染导致内源性MOB1的半衰期显著增加(图2G和2H)。这些结果表明Kindlin-2通过蛋白酶体蛋白降解途径介导MOB1降解。机制模型图( 图 2I).
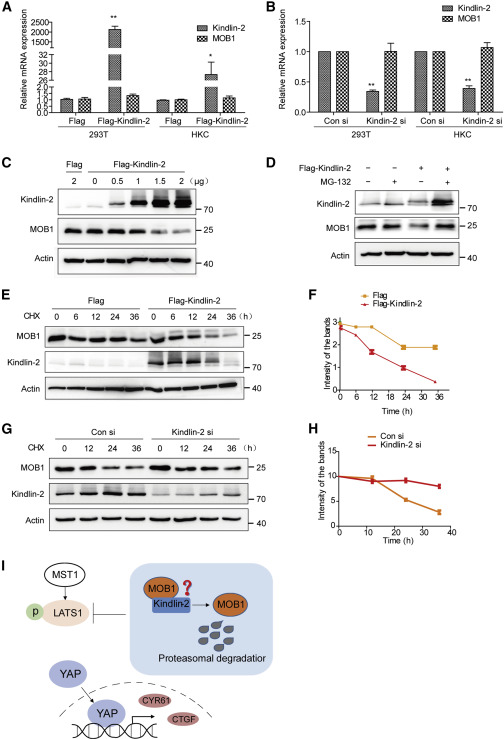
图2 Kindlin-2介导MOB1蛋白酶体降解
三、Kindlin-2通过增强MOB1与praja2的结合来介导MOB 1的降解
Kindlin-2作为衔接蛋白不能直接降解MOB1。为了确定Kindlin-2是否通过praja2降解MOB1,发现praja2与FLAG-Kindlin-2共免疫沉淀(图3A)和HEK293T细胞中内源性Kindlin-2(图3B)。为了确定Kindlin-2和praja2之间结合所涉及的蛋白质区域,合成并表达了FLAG-praja-2的四个完整或截短版本:全长praja 2(aa 1–708)、aa 1–530区域、aa 531–708区域或aa 1–630区域(图3C),外源表达的GFP-Kindlin-2与全长FLAG-praja2(1–708)和aa 1–530区(图3D)。此外,双重免疫染色显示Kindlin-2和praja2共定位于HK2细胞的细胞质(图3E)。两步共免疫沉淀(coIP)分析,确定Kindlin-2、MOB1和praja2三种分子形成复合物(图3F)。Kindlin-2过表达增加了HEK293T细胞中MOB1与抗praja2抗体共免疫沉淀的量,而Kindlin-2缺失显示了相反的作用(图3G和3H)。Kindlin-2的过表达降低了pYAP、MOB1和pMOB1的水平,而Kindlin-2的过表达和praja2的同时缺失部分挽救了pYAP、MOB1和pMOB1的水平(图3I)。Kindlin-2通过praja2介导的肾细胞MOB1降解下调YAP磷酸化。这些结果表明Kindlin-2构成了praja2和MOB1之间的桥梁,增强了它们的相互作用,促进了MOB1的降解;模型图(图3J).
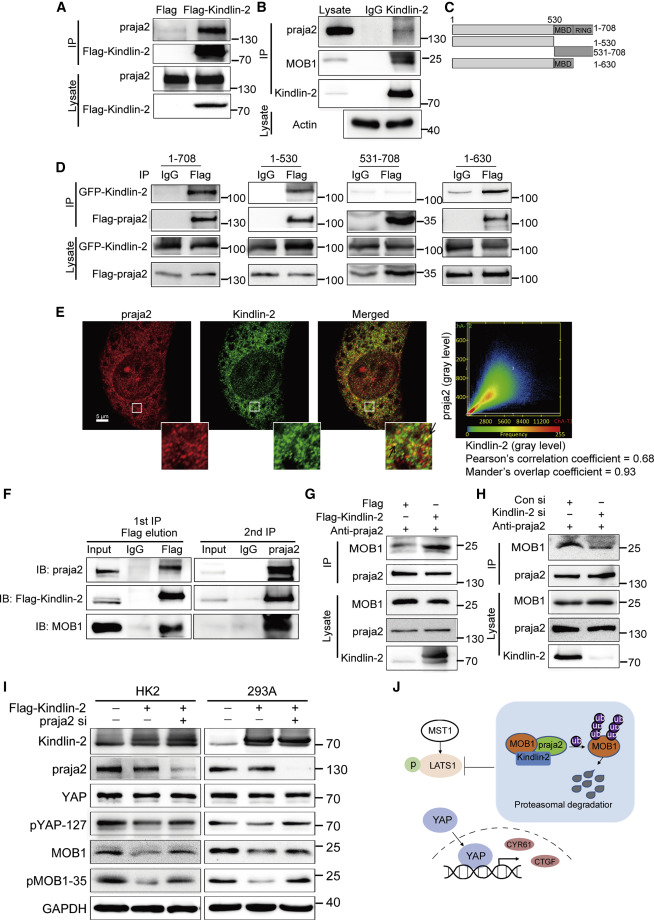
图3 Kindlin-2增强MOB1和praja2之间的相互作用
四、Kindlin-2缺失激活单侧输尿管阻塞诱导Kindlin-2敲除小鼠肾纤维化中的Hippo信号
由于Kindlin-2完全缺失的胚胎致死性,Kindlin-2敲除第一鼠标模型只能获得杂合子小鼠。基因型和Kindlin-2缺失效率被证实(图4A—4D)。Kindlin-2水平在单侧输尿管阻塞之后显著增加。此外,在单侧输尿管阻塞,Hippo信号通路与MST1、pMST1、pMOB1、LATS1、pLATS1、YAP和pYAP的上调和MOB1的下调一起被激活(图4E和4F)。然而,Kindlin-2敲除小鼠中Kindlin-2的缺失导致了Hippo信号通路的更多磷酸化和激活(伴随着pMOB1、pLATS1和pYAP的增加;p %3C 0.05),比在单侧输尿管阻塞(图4E和4F)。免疫组织化学(IHC)和免疫荧光染色表明Kindlin-2的缺失激活了Hippo途径,但不影响单侧输尿管阻塞(图4G)。此外,与野生型单侧输尿管阻塞小鼠相比,Kindlin-2敲除单侧输尿管阻塞小鼠显示肾纤维化标志物α-SMA、纤连蛋白和间充质标志物波形蛋白水平降低,但上皮标志物E-钙粘蛋白水平升高。与对侧相比,在野生型单侧输尿管阻塞小鼠中occludin和claudin-3明显下调,而在Kindlin-2敲除单侧输尿管阻塞小鼠中,这种明显的下调得到缓解。除了Hippo途径,Wnt途径在单侧输尿管阻塞之后被激活;而Kindlin-2敲除单侧输尿管阻塞小鼠与野生型单侧输尿管阻塞小鼠相比,其TCF4和β-连环蛋白水平降低(图4E和4F)。Kindlin-2的过度表达导致了上皮钙粘蛋白水平的降低,但是纤维连接蛋白、胶原蛋白ⅰ和α-形状记忆合金(图4H,左侧)。相反,Kindlin-2表达的减少恢复了这些标记物的水平(图4H,对)。Kindlin-2 siRNA转染后,我们在HKC细胞中过表达YAP。这些结果表明YAP的过度表达逆转了由Kindlin-2缺失引起的ⅰ型胶原和α-SMA的减少(图4I),提示Kindlin-2通过Hippo/YAP途径促进肾纤维化。这部分在中建模图4J.
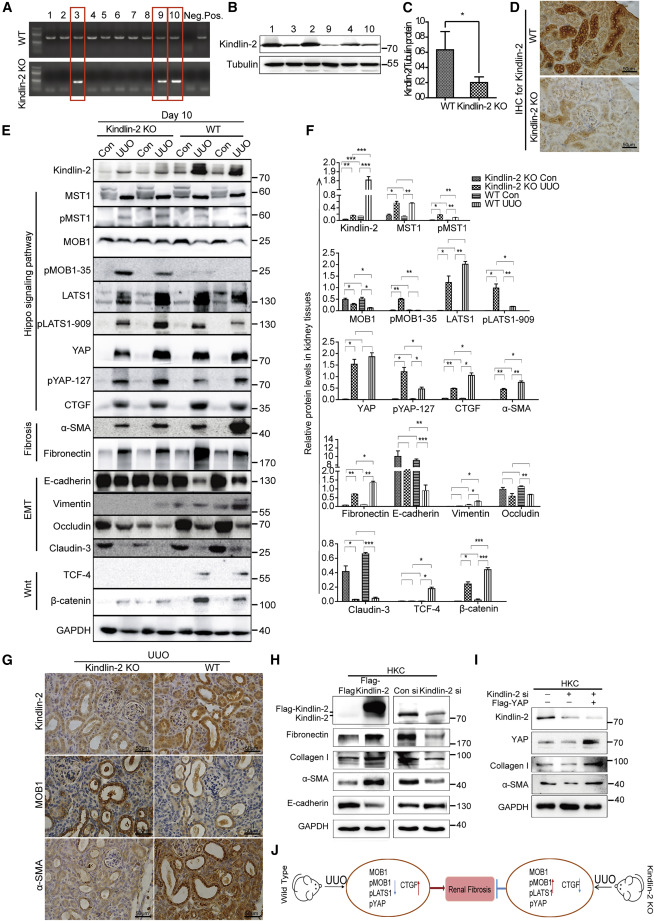
图4 Kindlin-2缺失激活Kindlin-2基因敲除小鼠单侧输尿管阻塞诱导的肾纤维化中的Hippo/YAP信号传导
五、长期siRNA诱导Kindlin-2耗竭抑制单侧输尿管阻塞小鼠模型Hippo靶基因CTGF的上调
在单侧输尿管阻塞小鼠模型中设计了两个使用长效Kindlin-2 siRNAs的治疗实验。第一个实验,我们在单侧输尿管阻塞后7天以上给野生型小鼠施用了5 nmol长效Kindlin-2 siRNA或对照siRNA(图5A).一般来说,晚期治疗组(第5组)和阴性对照组(第6组)的肾体积大于早期治疗组(第1-3组)。蛋白质印迹显示Kindlin-2被成功敲除,Kindlin-2的耗尽降低了CTGF和α-形状记忆合金水平(图5B和5C)。此外,形态学检测显示单侧输尿管阻塞肾脏(组1-5)比对照组(组6;图5D),表明用长效Kindlin-2 siRNA治疗减轻了肾纤维化,早期治疗产生了更好的结果。在第二个实验中,证明了5 nmol长效Kindlin-2 siRNA或对照siRNA对单侧输尿管阻塞后7天的野生型小鼠的作用(图5E)。蛋白质印迹显示Kindlin-2被成功耗尽,Kindlin-2的低水平导致CTGF、纤连蛋白和α-形状记忆合金的水平降低(图5F)。形态学检测显示Kindlin-2 siRNA组的单侧输尿管阻塞肾纤维化症状比对照组siRNA较轻(图5G)。基于这些发现,提出了一个工作模型,其中给予长效Kindlin-2 siRNAs通过三种主要的信号通路(图5H)。
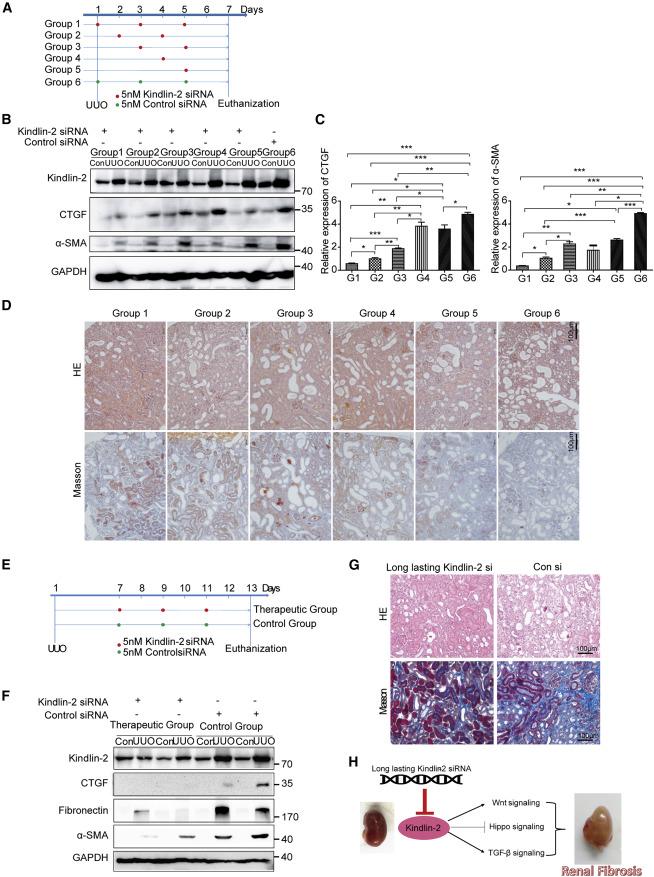
图5 长效Kindlin-2 siRNA对单侧输尿管阻塞肾纤维化的治疗作用
六、人肾纤维化标本中Kindlin-2水平与MOB1和pYAP水平呈负相关
与正常肾组织相比,肾纤维化组织中Kindlin-2、pYAP、YAP和CTGF水平较高,但MOB1水平较低(图6A和6C)。这些观察结果与单侧输尿管阻塞模型中发现的结果一致(图4E)。此外,发现肾纤维化患者肾小管中Kindlin-2水平与MOB1和pYAP水平呈负相关,总YAP水平无显著变化(图6B和6D)。在Kindlin-2水平较高的肾小管细胞核中检测到的YAP水平高于Kindlin-2水平较低的细胞核(图6B和6D)。这些数据支持Kindlin-2与MOB1和pYAP负相关,并促进人肾纤维化中YAP的核转位。对正常肾和肾透明细胞癌TCGA数据的分析揭示了以下基因表达的正相关性FERMT2和YAP下游基因CTGF和CYR61(图6E–6H)。然而,在正常肾脏TCGA数据库分析中,FERMT2与YAP没有关联(图6I)。相反,通过分析肾透明细胞癌TCGA数据库,FERMT2被发现与YAP有关(图6J)。这些结果表明Kindlin-2在生理和病理条件下通过不同的分子机制调节Hippo/YAP信号通路。此外,Hippo/YAP的目标基因,CTGF和CYR61,与FERMT2正相关在正常肾组织和肾透明细胞癌组织中。无论何种条件,Kindlin-2都能促进YAP核转位,上调Hippo靶基因。
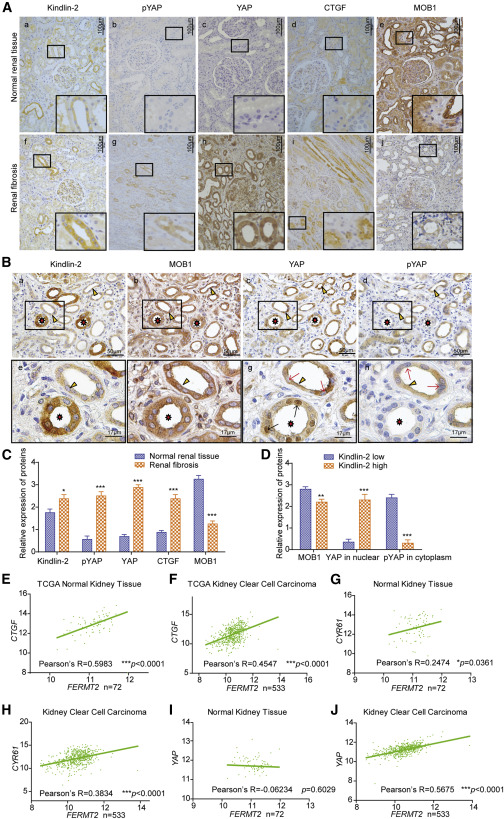
图6 Kindlin-2与人肾纤维化组织中Hippo/亚磷脂活化负相关
结论:
表明Kindlin-2 通过MOB1的降解抑制Hippo信号传导。针对Kindlin-2 的特定长效siRNA有效缓解了单侧输尿管阻塞诱导的肾纤维化,并可能成为肾纤维化的潜在疗法。






