lncRNA DRAIC治疗前列腺癌的新靶点
DRAIC是在抵抗性晚期前列腺癌中下调的1.7 kb的lncRNA。DRAIC表达的降低预示着前列腺癌和其他七种癌症的患者预后不良,而DRAIC的升高则抑制了异种移植肿瘤的生长。在此背景下作者研究了lncRNA DRAIC前列腺癌中的功能与机制,并于2020年1月发表在Cancer Research(IF:8.378)上。
主要结果如下:
1、lncRNA DRAIC在体内体外抑制肿瘤潜能
如图1,与对照(EV)相比,过表达lncRNA DRAIC(FL)显著抑制了肿瘤的侵袭和增殖以及成瘤水平。
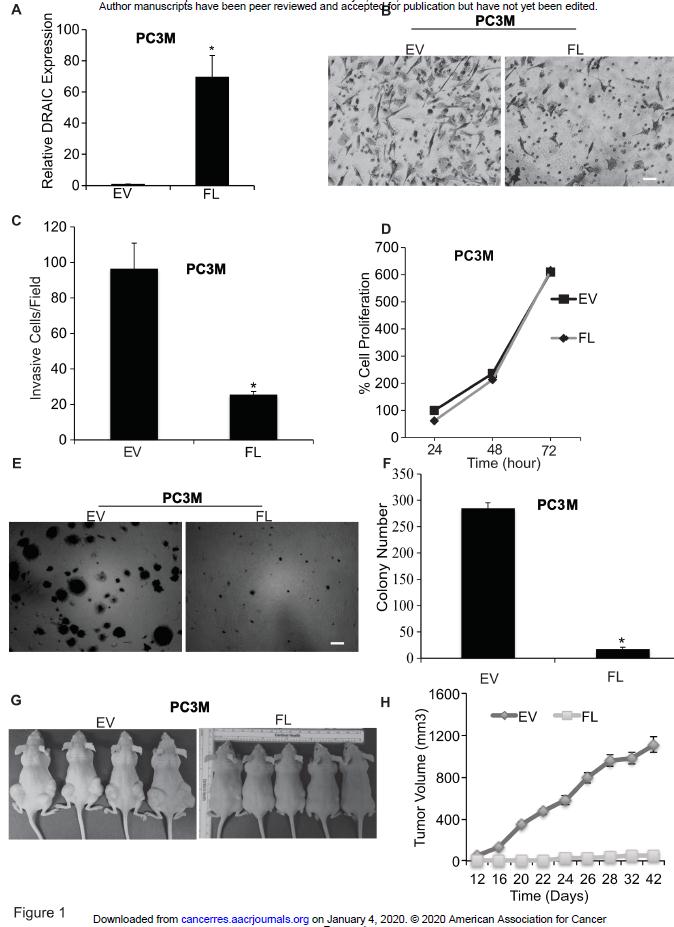
图1 lncRNA DRAIC在体内体外抑制肿瘤潜能
2、前列腺癌中DRAIC的低表达与高活性的NF-κB有关
GSEA分析显示前列腺癌中TNFα-NF-κB被显著激活(图2A),TCGA显示通过NF-κB 通路的TNFα信号的蛋白编码基因与DRAIC表达呈负相关(图2B),尤其是NF-κB通路的经典蛋白(图2C)。此外,DRAIC在IKK磷酸化IκBα中抑制NF-κB或其上游的活性(图2D-G)。
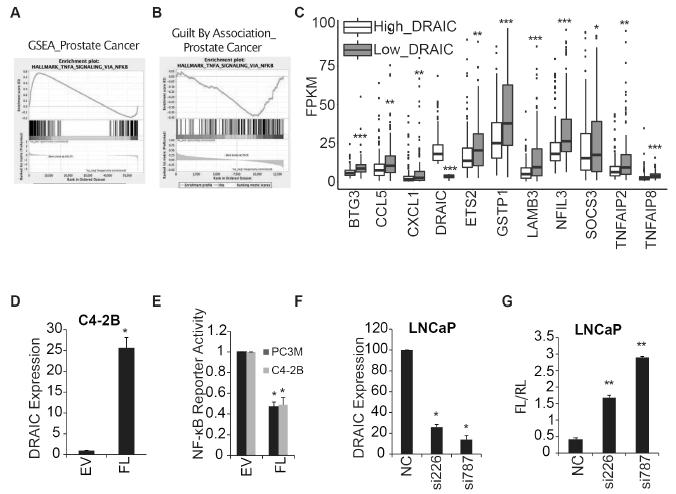
图2前列腺癌中DRAIC的低表达与高活性的NF-κB有关
为了检测DRAIC敲除后激活了哪一步,作者干扰了IκB激酶(IKK),NF-κB和IκBα的活性,如图3A,然后检测NF-κB的荧光素酶活性,如图3B-G。结果表明DRAIC的敲低激活了IKK在IκBα磷酸化处或上游的NF-κB途径。当过表达IKK(S177E / S181E)时,DRAIC过表达仍然抑制NF-κB活性(图3H,与图2E相比),这表明 DRAIC抑制了活性IKK下游的NF-κB通路。因此推断,DRAIC可能通过干扰IKK的功能来抑制NF-κB途径。
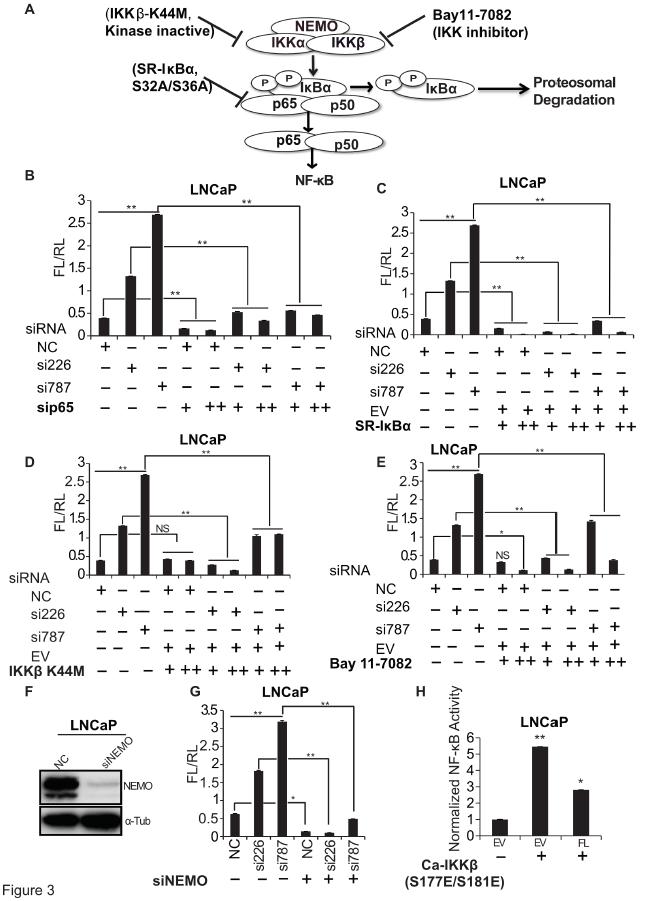
图3 DRAIC在 IKK水平抑制NF-κB通路
与DRAIC干扰IKK活性的预期一致,敲除DRAIC增加了IκBα的活性,相反,TNFα刺激过表达DRAIC则抑制由TNFα刺激引起的IκBα活性(图4A-C)。类似的,敲除DRAIC后降低了几种内源性的NF-κB响应基因,如GSTP1,MCP-1,IL-6,IL-8和TNFα,同时增加了上述基因的启动子绑定NF-κB(图4D-E)。此外,由敲除DRAIC诱导的细胞侵袭在抑制NF-κB活性后下降了(图4F-H)。以上说明,DRAIC介导的生物学功能改变是通过介导NF-κB通路活性实现的。
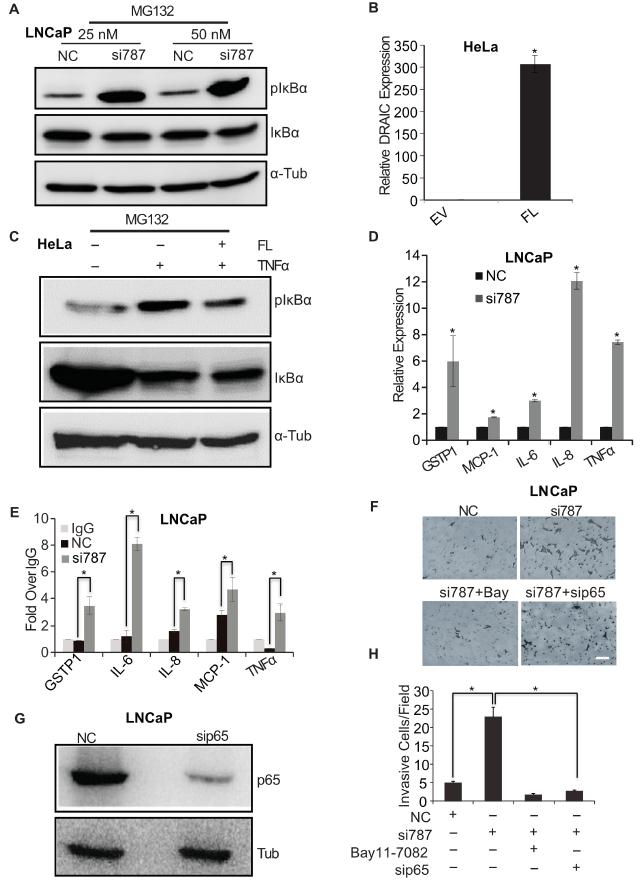
图4 DRAIC敲除增加了NF-κB通路的活性
3、使用CRISPR/Cas9敲除DRAIC外显子2-4通过激活NF-κB增加肿瘤的侵袭
虽然使用CRISPR/Cas9敲除DRAIC外显子2-4后,DRAIC外显子5的表达降低,细胞的增殖没有改变,但是IκBα活性,IKK激酶的活性和NF-κB活性都显著增加(图5A-G)。此外,肿瘤细胞的侵袭和集落形成能力也都显著提高(图5H-K),相反的,侵袭和集落形成被外源性启动子表达DRAIC抑制(图5L-O)。类似的,肿瘤细胞的侵袭和集落形成能力同样可以被NF-κB通路的IKK抑制剂BAY11-7082所抑制(图5P-S)。此外,NF-κB通路响应基因在敲除DRAIC后显著上调表达。综上结果表明,敲除DRAIC介导的细胞生物学功能改变是通过调控NF-κB活性实现的。
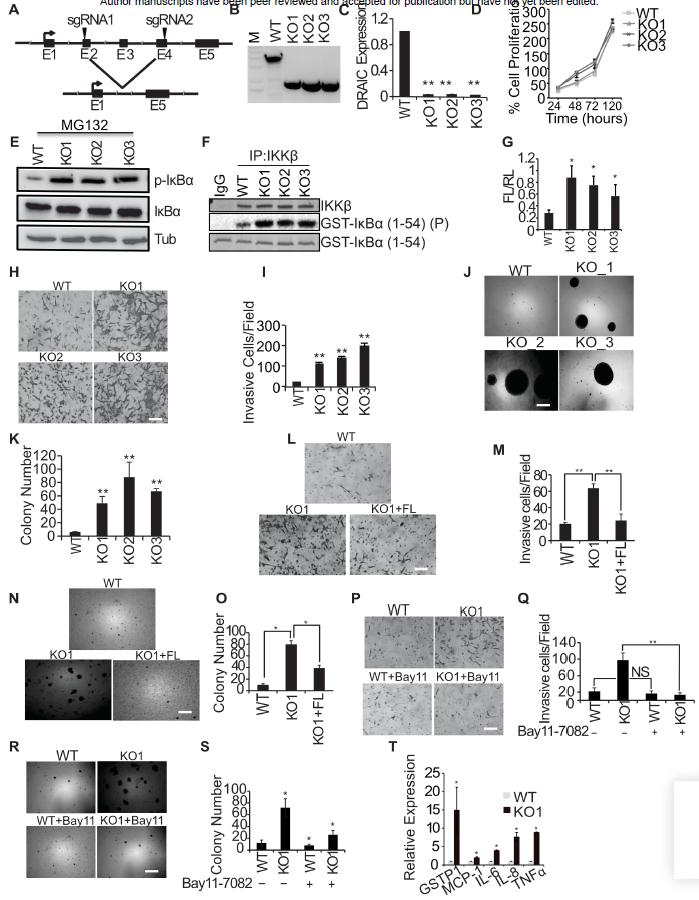
图5 DRAIC敲除通过增加NF-κB通路的活性提高了前列腺癌的致瘤性
4、DRAIC与IKK复合物相互作用,降低了复合物的完整性
RIP实验证实DRAIC与IKKα,IKKβ和NEMO相互作用,而不与p65或IκBα作用。进一步的,siRNA介导敲除IKK复合物三个亚基中的两个,然后对余下的亚基进行免疫沉淀,结果表明与DRAIC相关的所有三个亚基均独立于其他亚基(图6D)。之后,验证DRAIC是否破坏了IKK复合物的完整性。DRAIC过表达,然后对NEMO(图6E)或IKKα(图6F)免疫沉淀,表明DRAIC降低了NEMO和IKKα的结合。
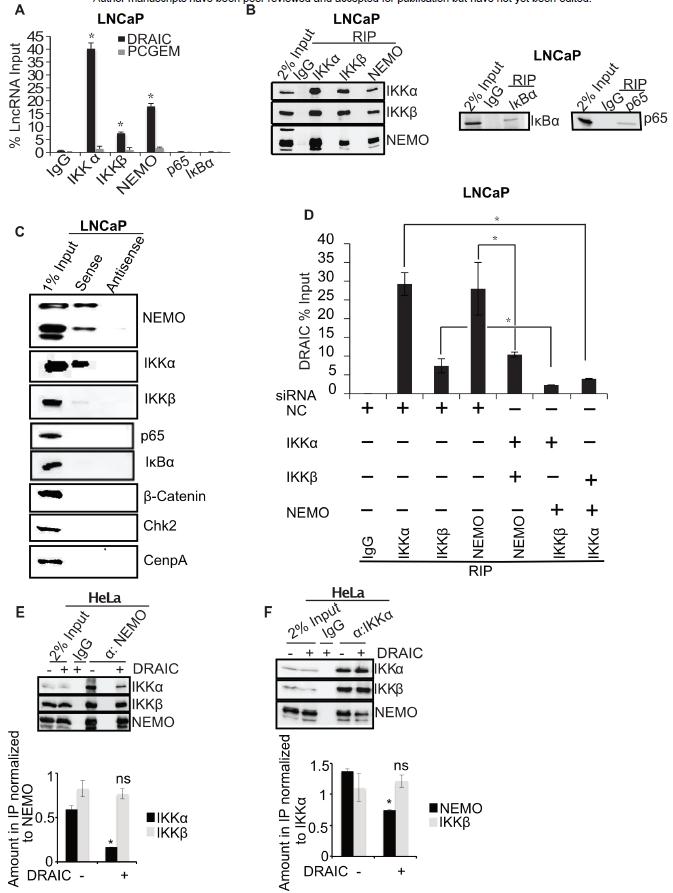
图6 DRAIC与IKK复合体相互作用
5、DRAIC外显子4-5的701-905碱基抑制侵袭和NF-κB活性
DRAIC中的缺失突变表明,与DRAIC KO中的IKKα免疫沉淀,含有外显子4-5(碱基701-1705)但不包含外显子1-3(碱基1-700)的片段与全长DRAIC的结果一样好(图7A)。当从外显子4-5中以200个核苷酸的步长进行进一步删除时,结果表明碱基701-905是与IKKα紧密相关的最小片段(图7B)。有趣的是,当在DRAIC KO细胞中表达时,外显子4-5(相对于外显子1-3)和片段701-905(相对于900-1705)最能抑制NF-κB报告活性(图7C-D)。此外,细胞侵袭和集落形成的能力也由DRAIC 701-905位点介导(图7E-H),此外,细菌产生的重组IKKα或NEMO,在体外也由DRAIC(701-905)介导(图7I)。不仅如此,体内IKKα与NEMO结合固定也由该位点调控(图7J)。
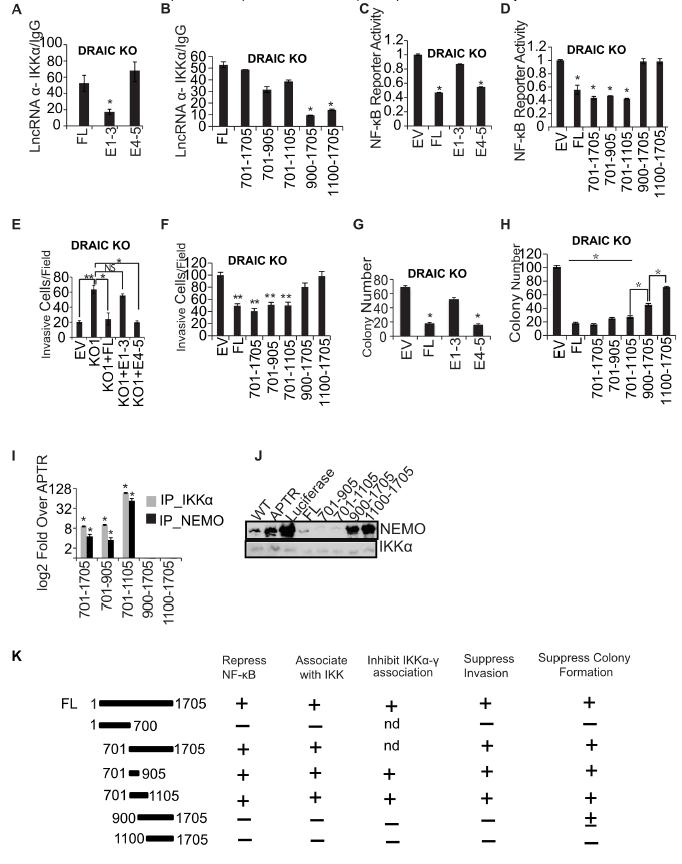
图7 E4-5的701 – 905碱基与IKK相互作用抑制侵袭和NF-κB活性
总之,本文发现lncRNA DRAIC表达降低的癌症中NF-κB靶基因表达增加。 DRAIC下调增加细胞侵袭和软琼脂集落形成;且这取决于NF-κB的激活。 DRAIC与IKK复合物的亚基相互作用,以抑制它们之间的相互作用、IκBα的磷酸化和NF-κB的激活。DRAIC的这些功能由701-905碱基片段决定。因此,DRAIC lncRNA通过干扰IKK活性,通过抑制NF-κB活化来抑制前列腺癌的进展。
参考文献:
Saha Shekhar., Kiran Manjari., Kuscu Canan., Chatrath Ajay., Wotton David., Mayo Marty W., Dutta Anindya.(2020). Long noncoding RNA DRAIC inhibits prostate cancer progression by interacting with IKK to inhibit NF-κB activation. Cancer Res., undefined(undefined), undefined. doi:10.1158/0008-5472.CAN-19-3460.






