2型糖尿病的治疗新方法—SPION-外泌体载药
BAY55-9837是一种潜在的治疗2型糖尿病(T2DM)的多肽,能够诱导葡萄糖(GLC)依赖性胰岛素分泌。但BAY55-9837的半衰期短、靶向性差、血GLC反应差,限制了其治疗效果。如何提高BAY55-9837的血液GLC反应是一个亟待解决的问题。近期一篇发表在杂志Small上的文章“SPION-Decorated Exosome Delivered BAY55-9837 Targeting the Pancreas through Magnetism to Improve the Blood GLC Response” 报道了利用工程化的外泌体载药靶向胰腺治疗2型糖尿病的研究。

在本研究中,我们展示了一种制备载有BAY55-9837的外泌体的方法,该外泌体与超顺磁性氧化铁纳米颗粒(SPIONs)相结合,具有胰岛靶向活性,并在磁力(MF)的帮助下增强血液GLC反应。载有BAY55-9837的SPION修饰的外泌体的等离子半衰期是无SPION修饰的外泌体的27倍。SIPONs的主动靶向性使外泌体获得良好的靶向性,提高BAY55-9837的血液GLC反应能力。体内研究表明,载BAY的外泌体载药能够增强胰岛靶向性,显著增加胰岛素分泌,从而减轻高血糖。慢性给予载BAY的外泌体可显著改善糖化血红蛋白和脂质。载BAY的外泌体可能是一种很有前途的T2DM肽药物载体,具有更好的血液GLC反应。
结果:
1.BAY-Exosome-SPION的特征
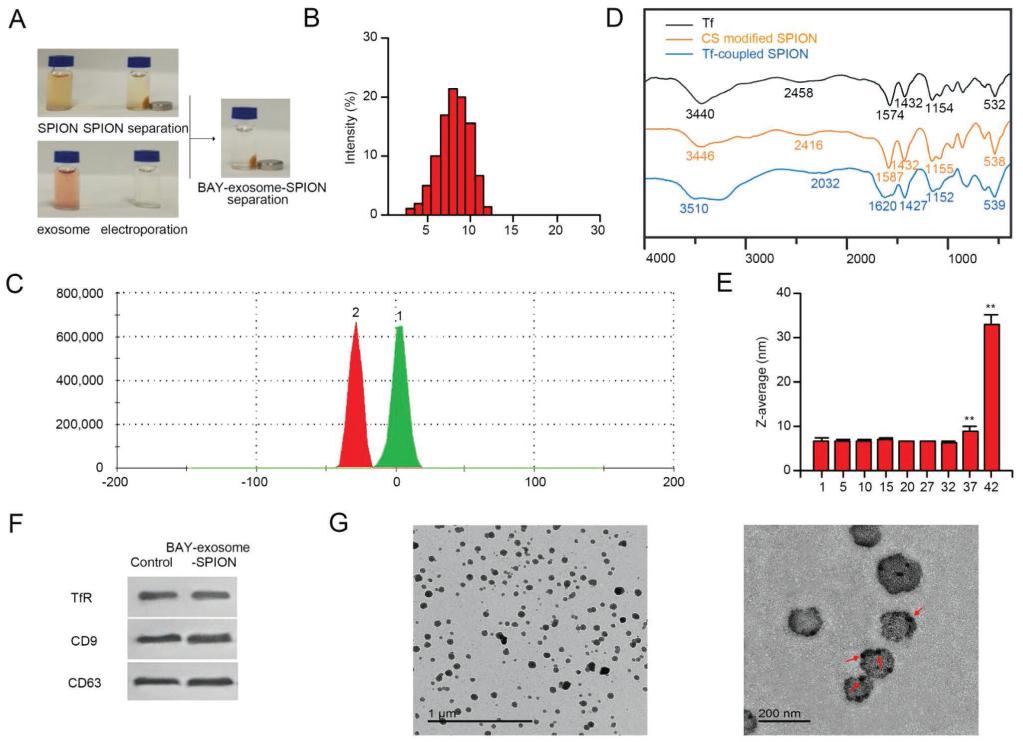
载有BAY55-9837的SPION修饰的外泌体的构建和纯化步骤如图1A所示。添加羧化壳聚糖(CS)来制备受尺寸控制的SPION。实验中所用CS修饰的SPION(CS-SPION)的尺寸分布如图1B所示。在+2.5 mV处测量离子的zeta电位,羧化CS修饰后电位降至0.28.6 mV(图1C),这可能与CS的羧基带负电荷有关。接下来,构建Tf-SPION并进行磁分离纯化。图1D为Tf、CS-SPION、Tf- SPION的FT-IR分析结果。结果表明结合过程中化学键发生了变化。在此基础上,研究了Tf-SPION的稳定性。图1E显示Tf-SPION的大小在形成后的最初几天内保持稳定。然而,Tf- SPION在形成后第37天显著增大。Tf-SPION的高稳定性为今后BAY55-9837的SPION修饰的外泌体的合成提供了支持。在合成和纯化后,通过以下实验对外泌体进行评价。Western blot分析结果显示,磁性分离获得的外泌体表达了特征性的外泌体膜蛋白CD9、CD63以及TfR,证实了外泌体与Tf-SPION的成功结合(图1F)。透射电镜显示,外泌体呈圆形形态,分布良好,平均直径约100 nm(图1G),符合文献报道的外泌体特征。
2.BAY-Exosome-SPION释放谱、药代动力学参数和靶向能力
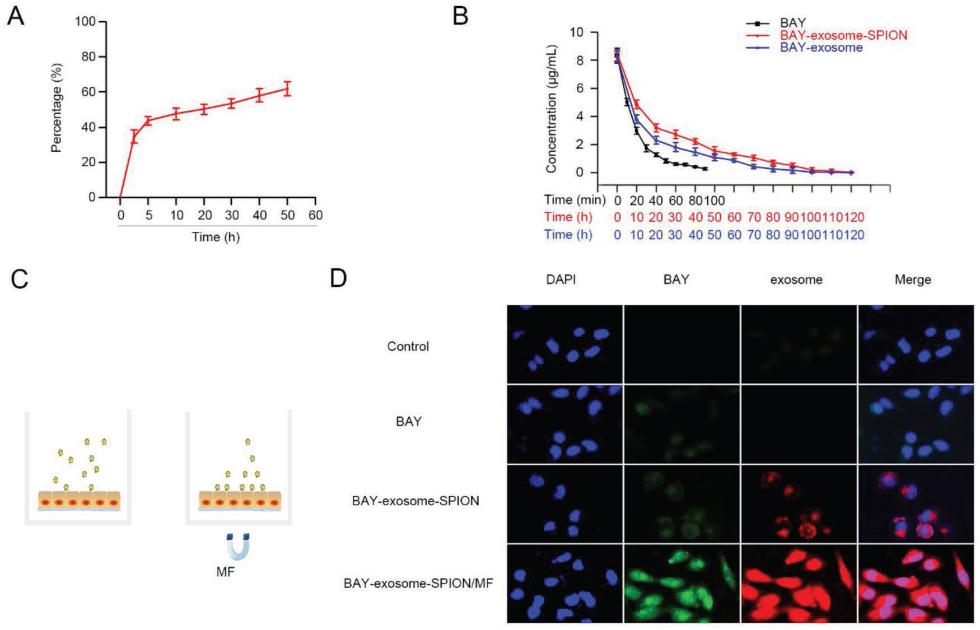
药物释放行为在生物分布、药代动力学、毒性、药物渗漏等方面起重要作用,缓释一般表现出较好的治疗活性。图2A显示了BAY55-9837从外泌体释放到培养基中的情况。前5 h外泌体释放BAY55-9837较明显,随后持续缓慢释放,60 h后累积释放量达62.0%,说明外泌体较好地保护了BAY55-9837的降解。图2B为BAY55-9837、BAY-exosome和BAY-exosome-SPION的血清清除曲线。BAY55- 9837表现出较短的寿命;然而,当负载外泌体或外泌体-SPION时,BAY55-9837可检测约120小时。治疗药物的靶向性是药物治疗的关键。图2C中的示意图显示,在MF的帮助下,螺旋修饰的外泌体倾向于在细胞表面积聚。图2D的结果证实了在MF存在的情况下,标记了红色染料的外泌体被吸引到MIN-6细胞表面,增强了BAY55-9837与其受体的细胞结合。
3.BAY-Exosome-SPION 对β-Cell的影响
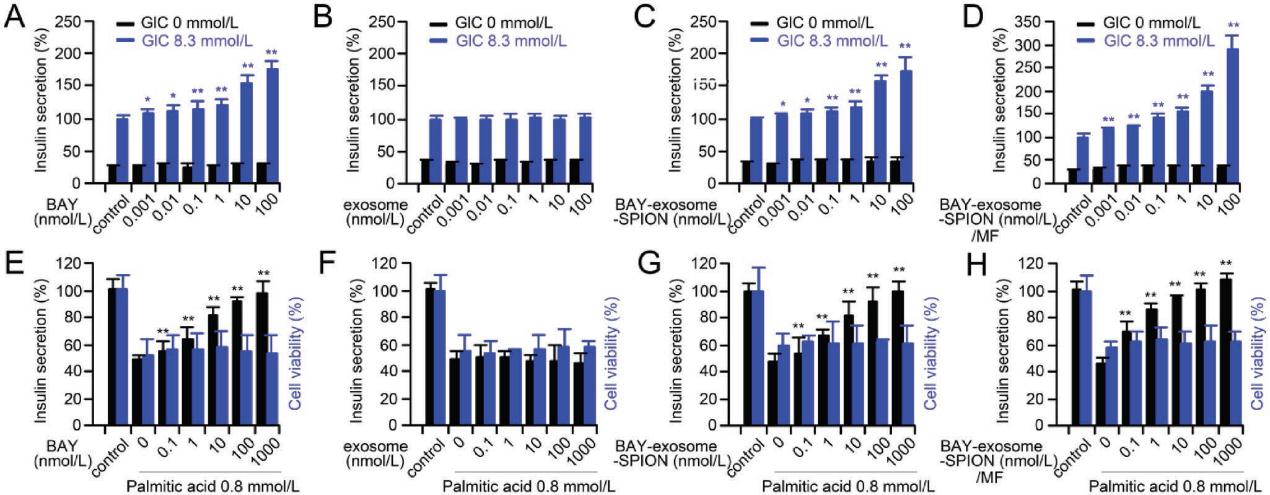
2型糖尿病的特点是外周胰岛素抵抗和胰岛β-细胞功能障碍,因此,BAY55-9837,exosome,BAY-exosome-SPION和BAY-exosome-SPION/MF的胰岛素促分泌素的影响被调查。在没有GLC的情况下,BAY55-9837,exosome,BAY-exosome-SPION和BAY-exosome-SPION/MF不能诱导胰岛素分泌。而在存在GLC的情况下,BAY55-9837,exosome,BAY-exosome-SPION和BAY-exosome-SPION/MF较对照组胰岛素分泌明显增加,符合BAY55-9837诱导胰岛素分泌的GLC依赖性(图3A,3C,3D)。与BAY55-9837或BAY-exosome-SPION相比,BAY-exosome-SPION/MF的引入使胰岛素分泌增加最大,验证了MF和exosome-SPION的应用显著增强了BAY55-9837对其受体的结合效能。然而,无论是否存在GLC,外泌体都不能诱导MIN-6细胞分泌胰岛素(图3B)。高GLC或脂肪酸水平诱导的活性氧是胰岛β细胞功能障碍的主要原因。因此,将MIN-6细胞与棕榈酸一起培养24小时,以建立氧化损伤模型。如图3E所示,在0.8 mmol L-1棕榈酸存在下,100 nmol L-1 BAY55-9837接近峰值浓度,激活了MIN-6细胞的胰岛素分泌;因此,与100 nmol L-1浓度相比,1000 nmol L.1 BAY55- 9837不能显著增加MIN-6细胞的胰岛素分泌。当BAY55-9837浓度低于100 nmol L-1时,增加BAY55-9837浓度可显著提高胰岛素分泌。因此,在BAY55- 9837、BAY-exosome-SPION和BAY-exosome-SPION /MF浓度高于100 nmol L-1时,MIN-6细胞的胰岛素分泌无明显差异(图3E,3G,3H)。此外,在0.8 mmol L-1棕榈酸和GLC存在的情况下,外泌体不能诱导MIN-6细胞产生胰岛素(图3F)。
4.BAY-Exosome-SPION对GLC诱导的胰岛素分泌信号通路的影响
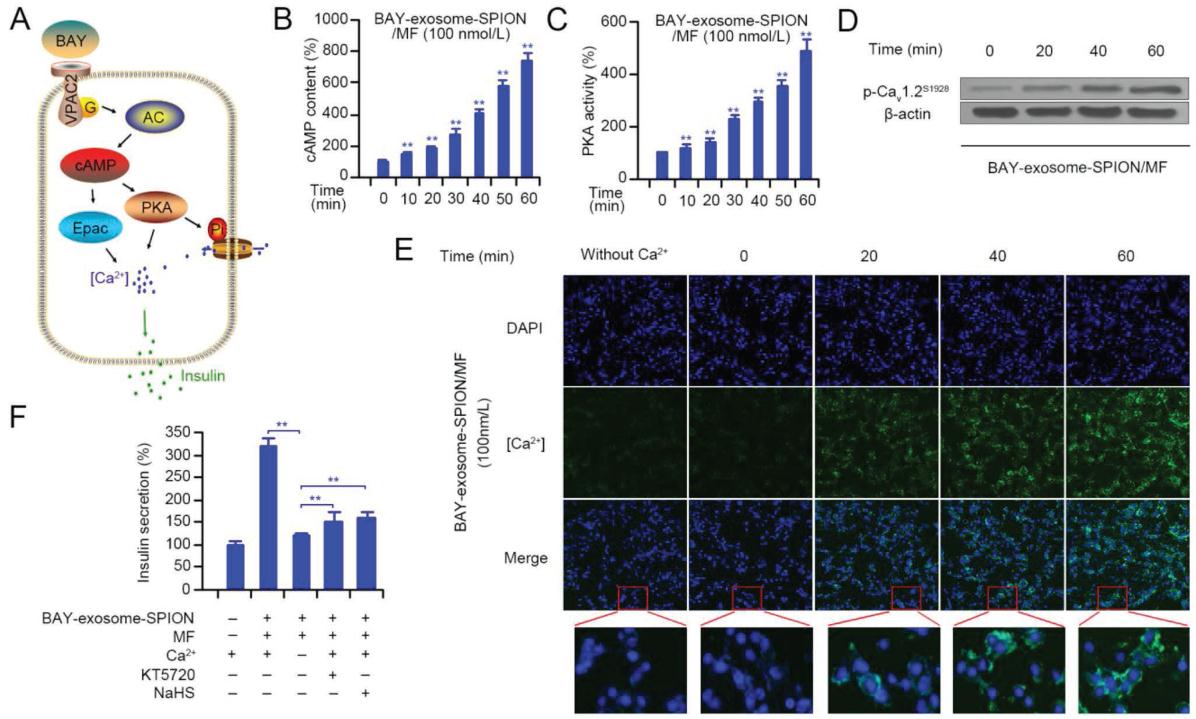
图4A总结了VPAC2介导胰岛素分泌的可能途径。AC/cAMP/PKA/Ca2+和AC/cAMP/Epac2/Ca2+信号通路是参与VPAC2介导的胰岛素分泌的两个主要信号通路。图4B、C显示,BAY-exosome-SPION/MF随时间增加cAMP含量,增强PKA活性,这表明BAY-exosome-SPION/MF在VPAC2介导的通路中诱导胰岛素分泌。最近的一项研究表明,Cav1.2的serine 1928 (Ser1928)磷酸化对调节蛋白激酶A (PKA)介导的l型Ca2+通道至关重要。如图4D所示,BAY-exosome-SPION/MF可诱导Cav1.2的Ser1928磷酸化,且随时间变化,这与PKA活性的变化一致。随后,利用Ca2+指标fluo-3 AM监测MIN-6细胞内Ca2+水平。如图4E所示,Ca2+内流在BAY-exosome- SPION/MF刺激下发生。为了进一步阐明PKA和l型钙通道在BAY-exosome-SPION诱导的胰岛素分泌中的作用,我们使用了PKA (KT5720)和l型钙通道(NaHS)抑制剂。如图4F所示,NaHS和KT5720的应用明显抑制了BAY-exosome-SPION/MF诱导的胰岛素的分泌。此外,在无Ca2+的培养基中,BAY-exosome-SPION不能诱导胰岛素分泌。因此,我们可以得出结论,在MIN-6细胞中,BAY-exosome-SPION/MF通过cAMP/PKA/Ltype Ca2+信号通路促进胰岛素分泌,这与VPAC2介导的胰岛素分泌信号通路是一致的。
5.BAY-Exosome-SPION在体内的分布
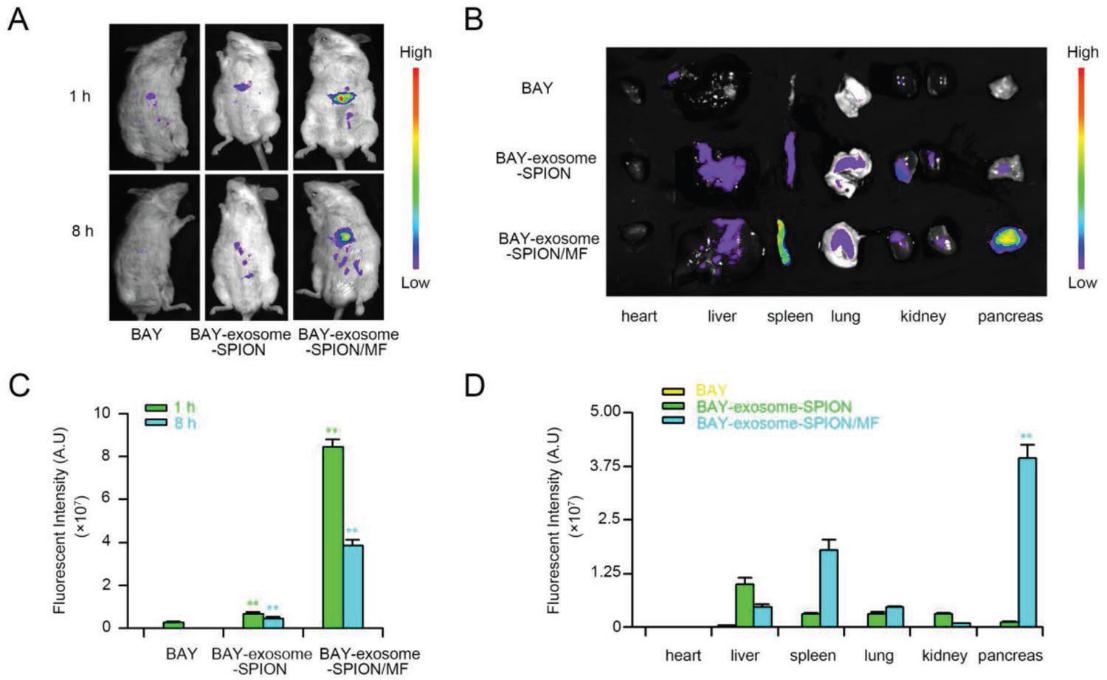
为了确定BAY-exosome-SPION/MF的靶向能力,我们利用非侵入性近红外荧光技术(NIRF)研究了Cy5.5标记的BAY55-9837或BAY-exosome-SPION在小鼠体内的生物分布。如图5A、C所示,经静脉注射1h后,在肝脏周围检测到微弱的荧光信号,经BAY55-9837处理8 h后,信号开始下降,几乎完全消失。同时,在没有MF的情况下,经BAY-exosome-SPION处理的小鼠肝脏周围8小时内可观察到微弱的荧光信号。在MF (1h)的帮助下,在静脉注射BAY-exosome-SPION后1h和8h,在胰岛和肝脏周围均观察到强烈的荧光信号,说明BAY-exosome- SPION具有明显的磁靶向性。此后,小鼠被euthanasia,并收集相关器官用于NIRF。如图5B所示,BAY55-9837处理小鼠各器官均未检测到荧光信号。而经BAY-exosome-SPION处理的小鼠各主要器官中检测到微弱的荧光信号,验证了基于外泌体的纳米给药系统作为药物载体具有保护作用和BAY55-9837的缓释能力。在BAY-exosome-SPION/MF组中,胰岛检测到强荧光信号。此外,对主要器官荧光强度的定量进行了评价。如图5D所示,与BAY-exosome-SPION组相比,MF的应用使胰岛的荧光强度增加了约11.5倍。
6.BAY-Exosome-SPION对2型糖尿病小鼠的治疗作用
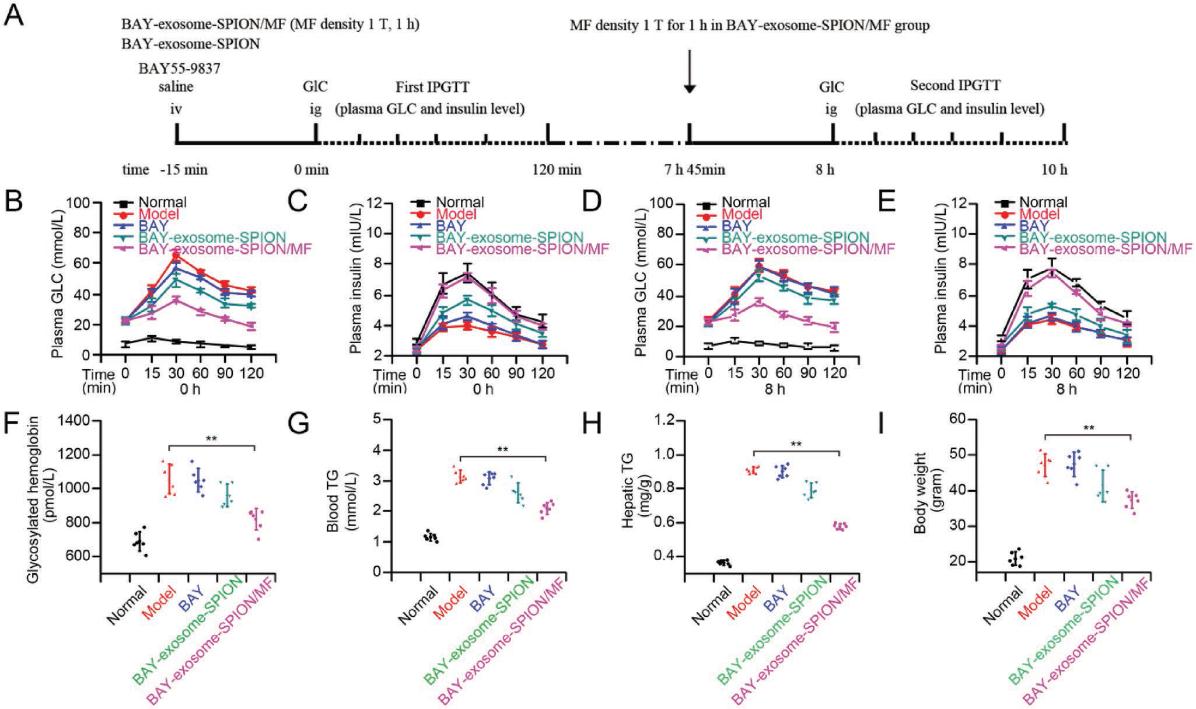
为了研究BAY-exosome-SPION / MF对GLC耐受性和胰岛素分泌的急性作用,用BAY55-9837,BAY-exosome-SPION和BAY-exosome-SPION / MF处理了db / db糖尿病小鼠,然后动态测量血液GLC和胰岛素水平(图6A)。如预期的那样,模型小鼠显示出GLC耐受性受损,同时GLC刺激的胰岛素分泌显着减少。与BAY55-9837相比,观察到BAY-exosome-SPION的GLC降低作用,并一直持续到120分钟。在存在MF的情况下使用BAY-exosome-SPION处理比使用BAY-exosome-SPION的单一处理更有效地降低了血浆GLC,这证实了MF的应用显著增加了BAY-exosome-SPION的局部浓度,因此证明了更好的血液GLC响应效果(图6B)。血浆胰岛素水平的改善与血浆GLC水平的变化相符,BAY-exosome-SPION / MF具有最佳的促进胰岛素分泌的能力,紧随其后的是BAY-exosome-SPION组,最低的是BAY55-9837组(图6C)。此外,由于外泌体延长了BAY55-9837的血浆半衰期,因此在8小时后再次进行了腹膜内GLC耐受性测试(IPGTT),以研究BAY-exosome-SPION/MF对GLC耐受性和胰岛素的影响。 图6D和图6E证明仅在BAY-exosome-SPION/MF组中检测到显著的GLC降低作用和促胰岛素能力。 与第一个IPGTT相比,BAY-exosome-SPION在降低血浆GLC水平和促进胰岛素分泌方面显示出较弱的能力,而BAY-exosome-SPION/MF在降低血浆GLC水平和促进胰岛素分泌方面具有相当的能力,表明在exosome-SPION 和MF的帮助下,BAY55-9837具有出色的GLC响应能力。为了评估BAY-exosome-SPION/MF对T2DM的慢性代谢作用,用BAY55-9837,BAY-exosome-SPION和BAY-exosome-SPION / MF处理了模型小鼠。如图6F,I所示,每天使用BAY-exosome-SPION/MF处理模型小鼠,其糖化血红蛋白和体重均显著降低。肝脏在控制碳水化合物代谢和脂质稳态方面具有重要作用,T2DM患者可观察到肝脏脂质代谢功能障碍。我们的结果显示,经BAY-exosome-SPION/MF处理后,血TG和肝TG均下降(图6G,H),表明模型小鼠的肝功能明显改善。
结论:
在本研究中,我们展示了一种制备载有BAY55-9837的SPION修饰的外泌体的方法。BAY-exosomes经电穿孔加载BAY55-9837获得成功。通过Tf-TfR相互作用将Tf-SPION偶联到BAY-exosome上,产生BAY-exosome-SPION,从而赋予BAY-exosomes超顺磁性。外泌体的保护作用使BAY55-9837具有更长的等离子半衰期,而SIPONs的主动靶向性使BAY-exosomes获得良好的靶向性。因此,在MF的帮助下,BAY-exosome-SPION能对GLC的升高做出适当的反应,从而在胰岛中积累,促进胰岛素的分泌。因此,BAY-exosome-SPION/MF被证明是改善T2DM患者血液GLC反应的一种有前途的方法。






