国自然热门领域之铁死亡
调节性细胞死亡在各种生理过程中都起着至关重要的作用,包括器官发生和体内稳态的维持。铁死亡是一种新型调节性细胞死亡,铁死亡最早是2012年由Brent R. Stockwell提出的。此前的研究发现Erastin可以特异性诱导Ras突变细胞死亡,但对其作用机制认识还不清楚。Erastin处理后的细胞没有典型的细胞凋亡特征,Brent R. Stockwell团队发现铁螯合剂可以抑制这一过程,并且另一种化合物RSL3也有类似的细胞死亡表型。与经典的细胞凋亡不同,铁死亡过程中没有细胞皱缩,染色质凝集等现象,但会出现线粒体皱缩,脂质过氧化增加。传统的细胞凋亡,细胞自噬,细胞焦亡的抑制剂不能抑制铁死亡过程,但铁离子螯合剂可以抑制这一过程,说明铁死亡是铁离子依赖的过程。

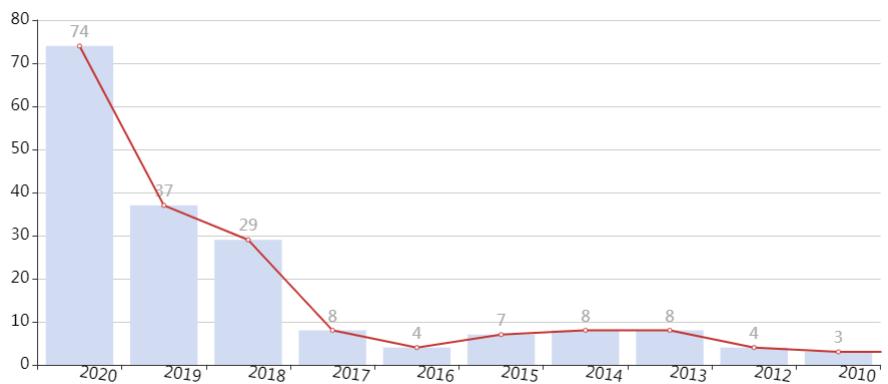
2019年铁死亡中标项目74项,较2018年增长100%。预测2020年中标项目超过100项。没有课题思路的话可以考虑一下铁死亡,估计在很长一段时间内铁丝网中标项目将会居高不下。自噬自从2017年达到顶峰之后,在国自然申请领域热度已经下来了,所以新的铁死亡值得重点关注。pubmed上发文趋势逐年上涨,且高分文献较多。截止到目前,影响因子超过十分的文章占总文章数的16.37%,五分以上文章占47.23%。2019年10月,Nature杂志在同一期连续发表了两篇铁死亡的研究论文。题名分别为:The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis;FSP1 is a glutathione-independent ferroptosis suppressor。
铁死亡的主要特征:
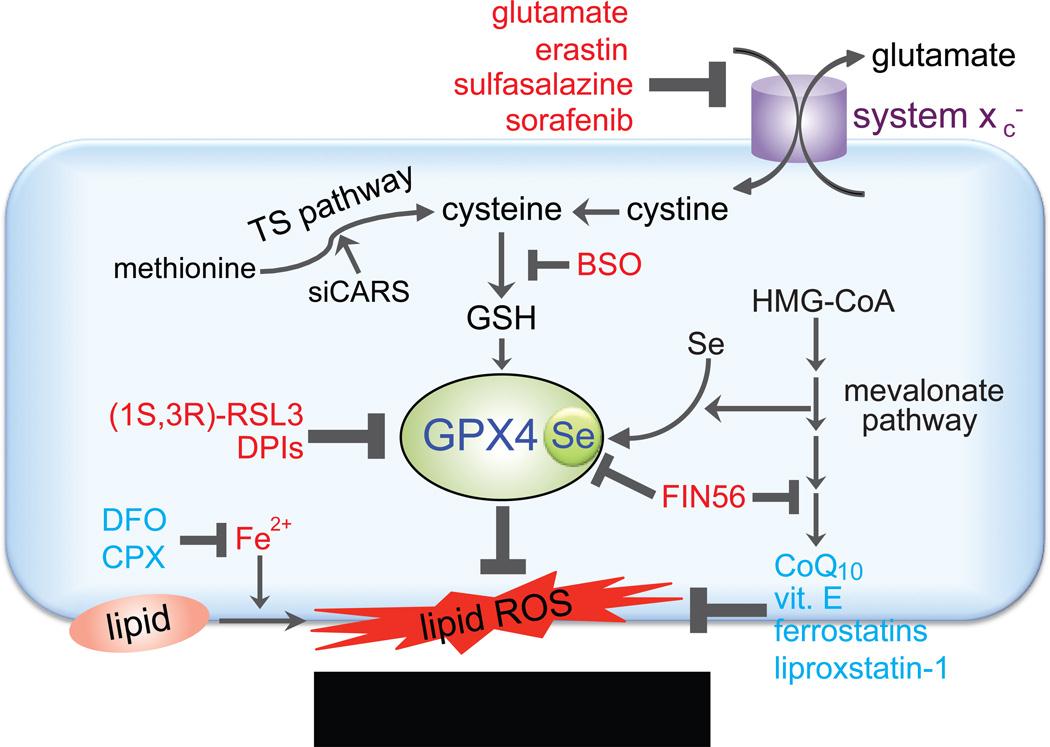
当细胞胱氨酸运输蛋白受到抑制(如Erastin),胞内谷胱甘肽(GSH)会被耗尽,最终导致谷胱甘肽过氧化物酶(GPX4)的失活,导致脂质过氧化积累,达到一定程度即可诱发细胞死亡,GPX4酶受到抑制(如RSL3)也可以直接导致这一作用。铁离子螯合剂可以抑制这一过程。发育等生理活动过程是否有铁死亡机制的参与还不是很清楚,但很多疾病均报道与铁死亡有关,包括神经退行性疾病,肿瘤,中风,脑出血,脑外伤,局部缺血再灌注损伤,肾衰竭等等均与铁死亡有密切关系。除了铁螯合剂,很多抑制或缓解脂质过氧化的药物均可抑制铁死亡的过程,包括亲脂性抗氧化剂,脂质过氧化抑制剂等等。铁死亡过程会有一些细胞形态和生化指标的变化,主要有以下特征:
(1)细胞形态方面,铁死亡会导致细胞线粒体变小,膜密度增高,嵴减少。细胞核中形态变化不明显。
(2)细胞成分方面,铁死亡表现为脂质过氧化增高,ROS升高。也有一些特征基因发生变化。
今天我们就讲到这,下次带大家看点别的,再见!!!






