Molecular Cell背靠背发文:RNase L介导的双链RNA病毒感染后转录及翻译重编程分子机制
大家好,今天小编分享的是近日在顶级分子生物学杂志Molecular Cell上背靠背发表的关于RNase L天然免疫中作用研究文章。文章信息如下:


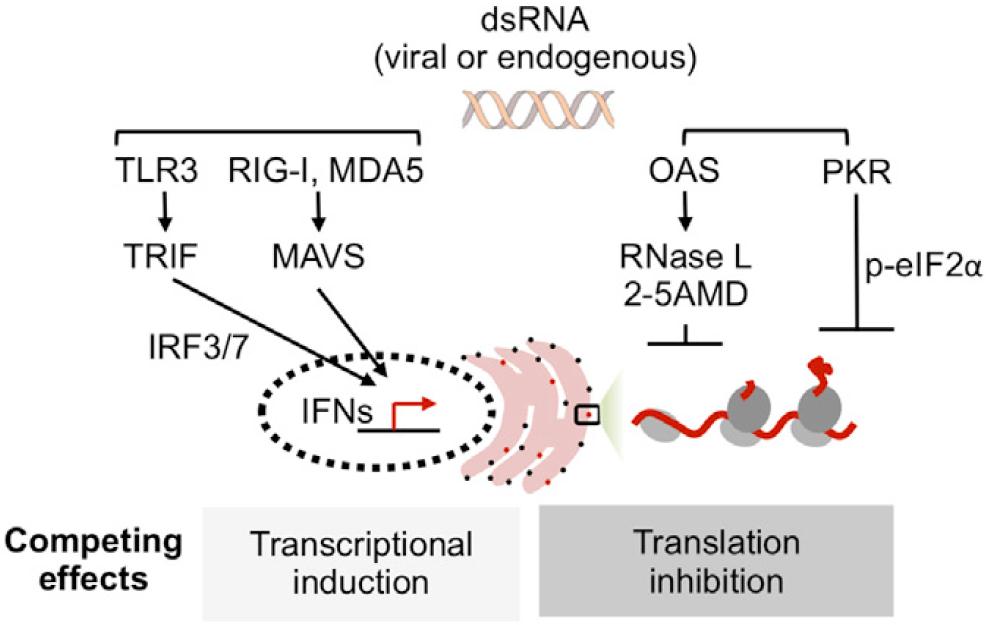
图1 研究背景通路图[1]
天然免疫是在产生抗体的适应性免疫前迅速发挥识别和清除病原体的重要防线。它通过模式识别受体识别各类型模式识别分子后激活相应信号通路和下游基因的表达达到防御和清除病原体的目的。在针对其中之一的双链RNA信号时,一方面TLR3、RIG-I、MDA5等识别后激活下游IRF3/7转录因子并转录抗病毒基因如干扰素等。另一方面,2-5A synthetases(OASs)合成2-5A;2-5A结合至RNase L的ankyrin-repeat sensor结构域后,使其发生二聚化和高度有序的低聚化,激活RNA剪切活性。激活后,在UN^N位点(分布类型广泛)切割单链RNA,导致普遍性的翻译抑制。同时,the serine-threonine kinase protein kinase R (PKR)也催化Eif2α的磷酸化抑制翻译起始。这里便出现了一个有趣的问题:为什么宿主需立即大量合成抗病毒蛋白的时候,细胞下调了整体翻译水平呢?其生物学意义和分子机制是怎样的呢?两篇文章从RNase L降解mRNA的选择性、核糖体RNA功能的角度对这一问题进行了系统研究。
两文作者都描述了双链RNA病毒感染后,翻译水平的下降的同时mRNA也出现了大量的降解。但进一步研究发现,在广谱的基础性的mRNA降解的同时,刺激诱导的抗病毒基因如ifnb1、IL-6却逃逸了RNase L的降解。
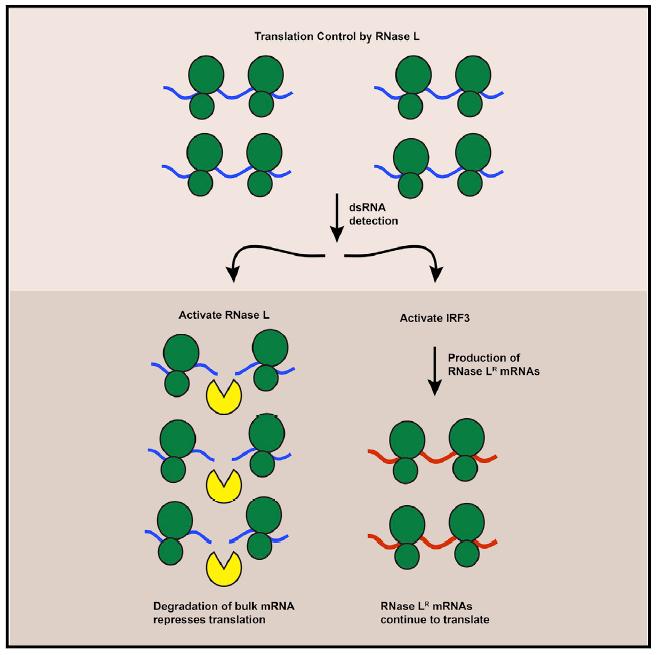
图2 文一模式图[2]
James M. Burke一文[2]中通过系统性的研究指出:RNase L能一定程度上促进抗病毒基因的转录,同时这些抗病毒基因mRNA上具有的特定RNase L抵抗信号使其在该条件下更加稳定,进而有上述现象。
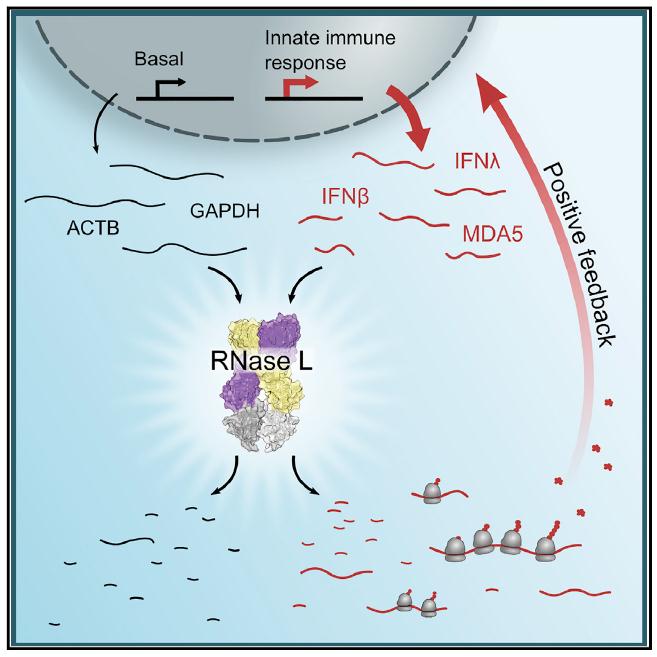
图3 文二模式图[1]
Sneha Rath一文[1]中先从翻译起始角度研究了该问题。发现:RNase L切割的核糖体RNA仍具有生物功能。作者指出,抗病毒基因mRNA并不能完全抵抗RNase L的切割,但与其他基础性的mRNA相比,它们的半衰期高2-3倍。通过对比RNase L敏感和抵抗的mRNA序列特征,作者指出GC-rich motifs数量部分影响mRNA的RNase L的抵抗性。
至此,研究人员阐明双链RNA病毒感染后IRF3/7通路、RNase L、PKR与p-Eif2α、GADD34与p-Eif2α共同介导的宿主细胞转录组重编程过程。此外,在五月初发表于cell的Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity一文[3]中,作者指出RNase L同样降解circRNA从而解除其对PKR活性的抑制进而调节天然免疫。小编在当时第一时间与大家分享了该文,也是小编的一些联想与启发。也建议感兴趣的同学详读。
参考文献:
1.Rath, S., et al., Concerted 2-5A-Mediated mRNA Decay and Transcription Reprogram Protein Synthesis in the dsRNA Response. Mol Cell, 2019. 75(6): p. 1218-1228 e6.
2.Burke, J.M., et al., RNase L Reprograms Translation by Widespread mRNA Turnover Escaped by Antiviral mRNAs. Mol Cell, 2019. 75(6): p. 1203-1217 e5.
3.Liu, C.X., et al., Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity. Cell, 2019. 177(4): p. 865-880 e21.






