系统性红斑狼疮造血干细胞和祖细胞的转录组分析
造血干细胞和祖细胞(HSPCs)是多能性细胞,可产生髓系和淋巴系。我们认为系统性红斑狼疮(SLE)免疫细胞异常可以追溯到HSPCs。HSPCs通过髓样偏移对炎症刺激作出积极反应,但这可能导致疲劳、功能下降、炎症风险增加、适应性免疫下降和心血管死亡率增加。今天小编为大家带来最新发表于Translational science杂志上的文章“Transcriptome reprogramming and myeloid skewing in haematopoietic stem and progenitor cells in systemic lupus erythematosus”。在本研究中,我们通过RNA测序、通路富集分析,构建骨髓源性HSPCs的全球基因表达图谱,通过流式细胞术检测HSPCs的细胞周期状态和凋亡状态,通过免疫荧光法检测DNA损伤情况。

结果:
1.小鼠狼疮HSPCs的转录谱表现为髓样偏倚
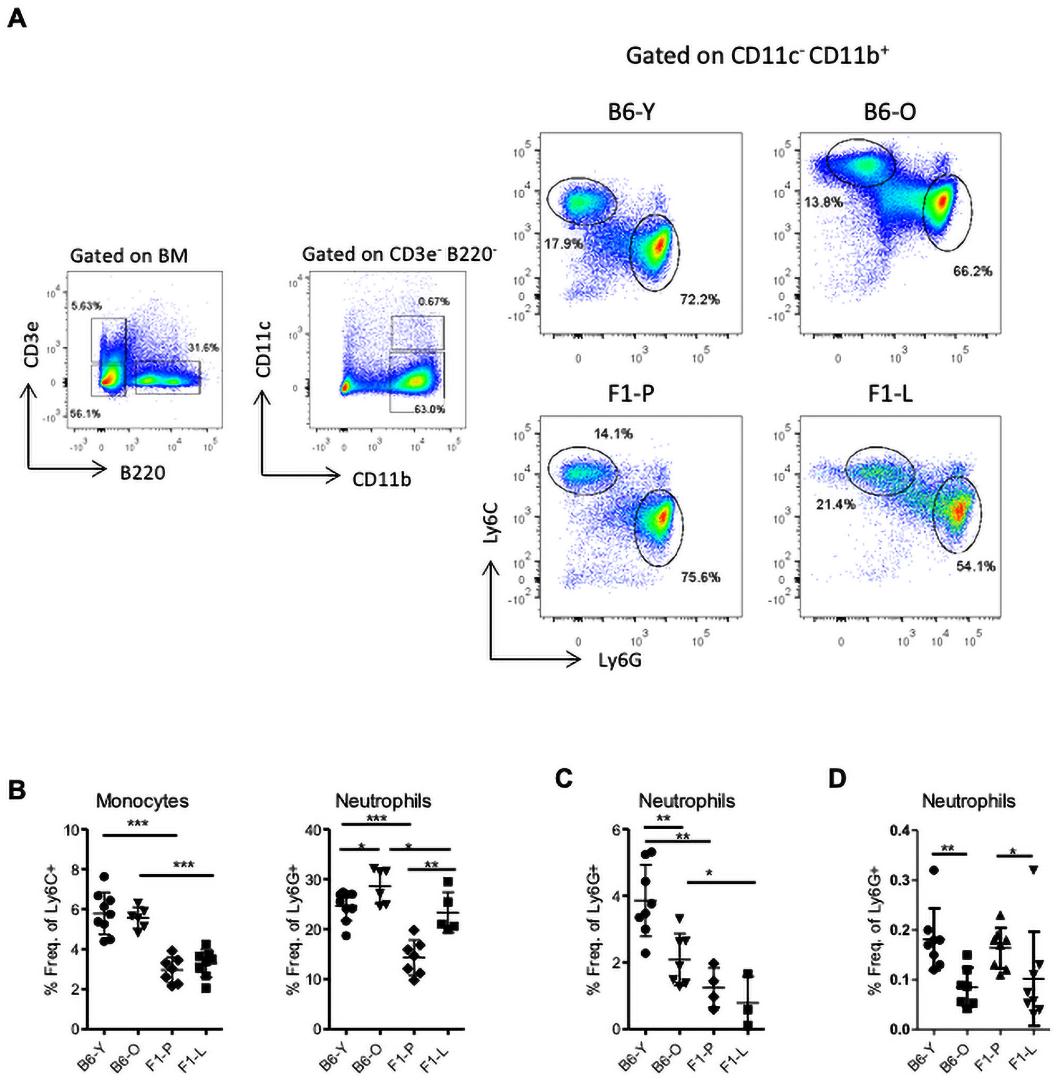
为了研究HSPCs在SLE中是否出现转录改变,我们使用小鼠模型NZBW/F1。年龄相当的雌性C57BL/6小鼠作为对照组。采用流式细胞术从NZBW/F1狼疮和C57BL/6对照小鼠髓样中筛选HSPCs,并在LSK室中进行基因分析(图1A)。共鉴定了F1-P和F1-L小鼠之间的758个差异表达基因(图1B)。在F1-L小鼠中,基因集富集分析显示与炎症反应、先天免疫反应激活和血小板脱颗粒相关的信号呈正相关(图1C)。值得注意的是,F1-L小鼠中LSK表现出较强的增殖和较强的髓特征(图1D)。IFN相关基因(Gbp6和Ciita)在F1-L LSK中上调,表现出强I型IFN信号,这是活性SLE的一个标志(图1D)。总之,这些转录组学数据表明,F1-L LSK向髓系/粒细胞系的增殖和分化增强。
2.小鼠狼疮HSPCs细胞的活性增殖和复制应激
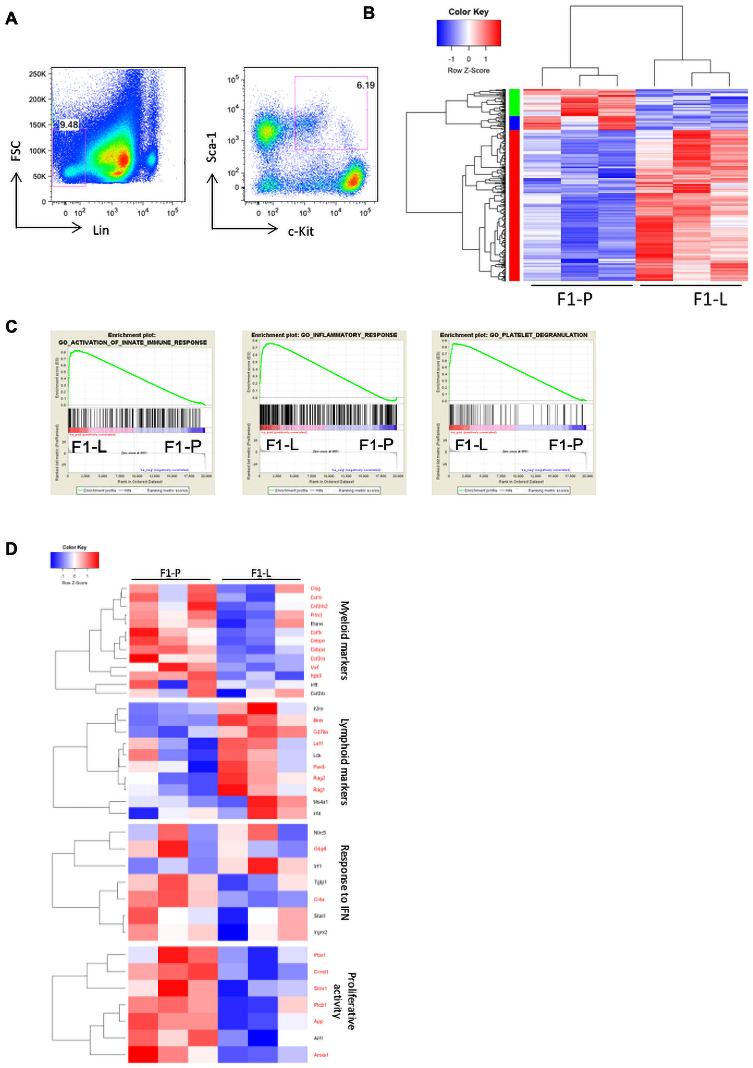
为了验证转录组数据,我们分析了髓样LSK腔室及其亚群。与F1-P相比,F1-L小鼠的LSK增加了近两倍(图2A,B)。在LSK室,F1-L小鼠中,短期造血干细胞和多能祖细胞的频率更高(图2A,C)。在稳定状态下,HSPCs相对静止,维持一个低数量的循环细胞,这些细胞将分化为成熟的血细胞。狼疮LSK细胞周期分析显示,与B6-O对照组相比,在G0期,F1-L LSK细胞增殖增加,数量减少(图2D)。此外,与B6相比,狼疮LSK表现出更多的双链DNA断裂(图2E),这表明狼疮小鼠的LSK处于复制应激状态。
3.狼疮疾病进展中CMPs的分化停滞
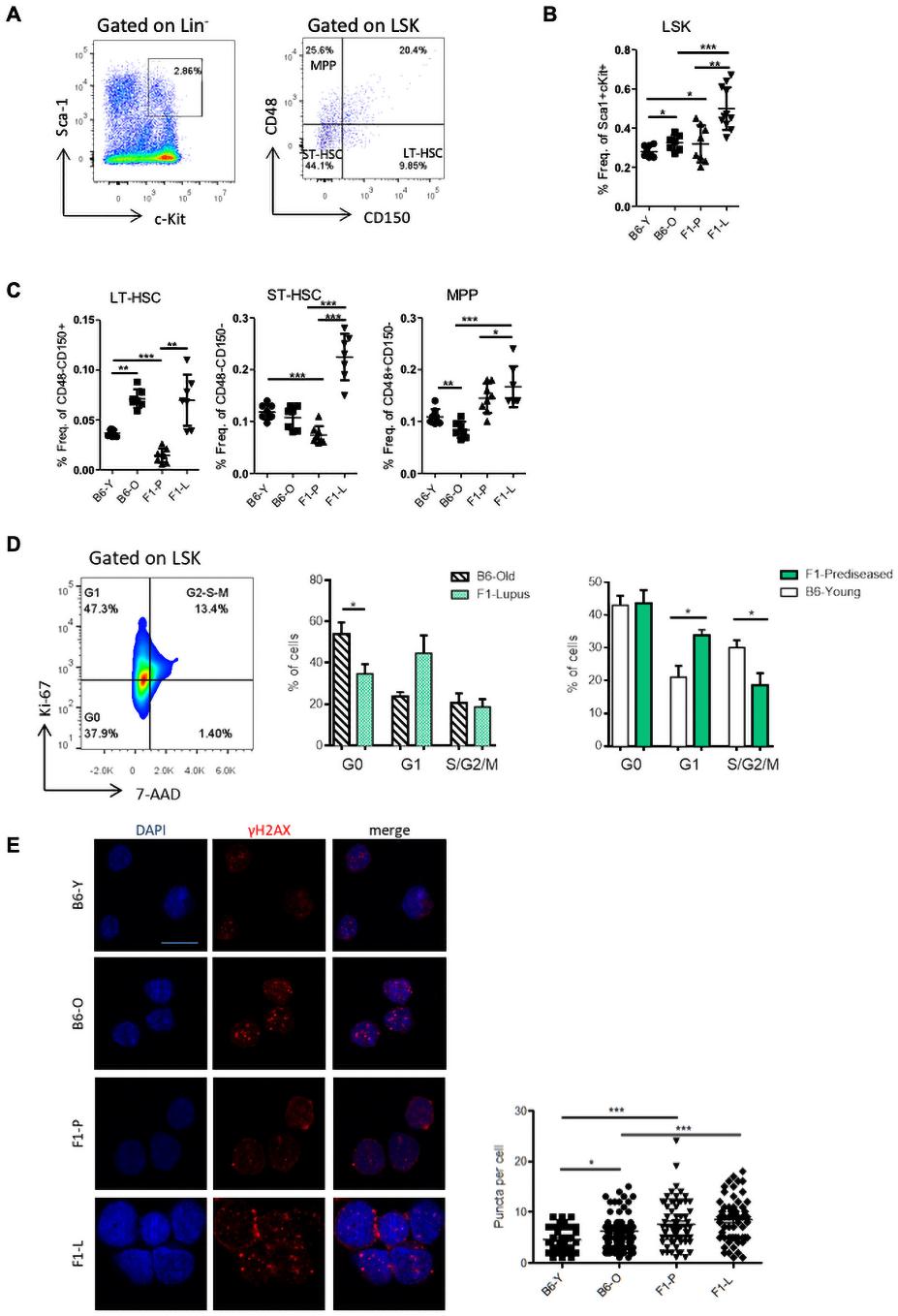
为了描述LSK期后的造血分化,我们对每个谱系的祖细胞进行了描述。F1-L组CMPs增加2.5倍,而与F1-P组相比,GMPs减少2倍(图3A)。接着,为了进一步研究骨髓分化的调控,我们进行了转录分析。721个DEGs中的大部分在F1-L CMPs中下调(图3B)。另外,髓样标志物下调,而增殖标志物无差异表达(图3C)。DEGs参与了与髓磷脂介导免疫、粒细胞激活、中性粒细胞迁移和补体激活相关的通路。因此,我们检查了特异性粒细胞标记的表达(图3D)。在F1-L CMPs中,IL-1家族的趋化因子和调节因子被下调。主要调节因子如Cebpe,Cebpd,Csf3r和Csf2rα在CMPs F1-L阶段被抑制(图3 D)。总的来说,这些结果提示骨髓祖细胞水平的分化停滞。
4.狼疮BM中中性粒细胞增多
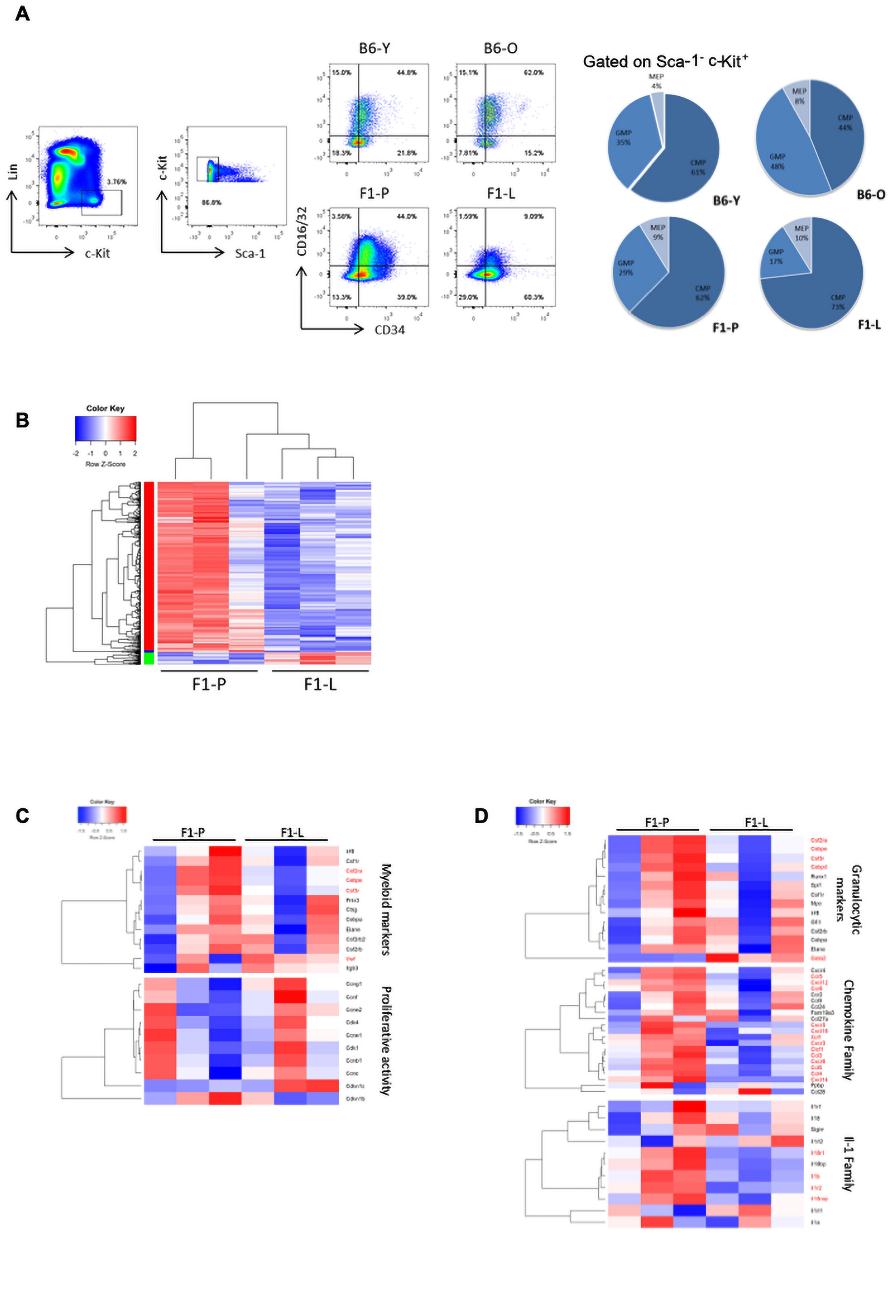
鉴于分化停滞,我们假设终末分化细胞可能会减少。然而,与F1-P相比,F1-L小鼠的中性粒细胞增加了1.6倍,而BM的单核细胞水平与之相当(图4A,B)。衰老比对照组小鼠中性粒细胞增加1.16倍。与之相反,F1-L小鼠血液和脾脏中性粒细胞明显减少(图4C,D)。
5.人SLE CD34+转录组表现为活跃的增殖和髓样偏移
接下来,我们研究是否可以追踪人类疾病中的狼疮LSK信号。为此,我们从女性SLE和HC患者的BM中纯化CD34+细胞。我们在SLE和HC患者中鉴定出2364个DEGs,其中包含832个上调基因和1532个下调基因(图5A)。SLE患者淋巴样标志物表达下调,而髓样标志物在患者体内表达变化较大(图5B)。此外,系统性红斑狼疮CD34+细胞表现出增强扩散,而GSEA与ATR在复制应激、细胞周期和DNA依赖的DNA复制下的激活呈正相关(图5C)。针对增强扩散,γ-H2AX评估检查CD34+细胞是否存在增殖压力。结果表明,SLE HSPCs表现出更多的双链DNA断裂(图5D)。亚组分析显示,严重和中度SLE患者髓样标志物存在变化(图5E)。值得注意的是,与中度疾病患者相比,重度SLE患者粒细胞生成特异性标志物如CEBPZ、CEBPD、GATA2的表达增加(图5E),这与我们在小鼠狼疮LSK中的发现一致。GSEA与细胞因子-细胞因子受体相互作用和严重SLE患者的运动的正调节呈正相关(图5F)。利用上调的基因对严重SLE患者进行富集分析,发现粒细胞和中性粒细胞的趋化和迁移过度(图5G)。总之,与HC相比,HSPCs在SLE患者中被激活和增殖,在重症患者中有明显的转录分化。
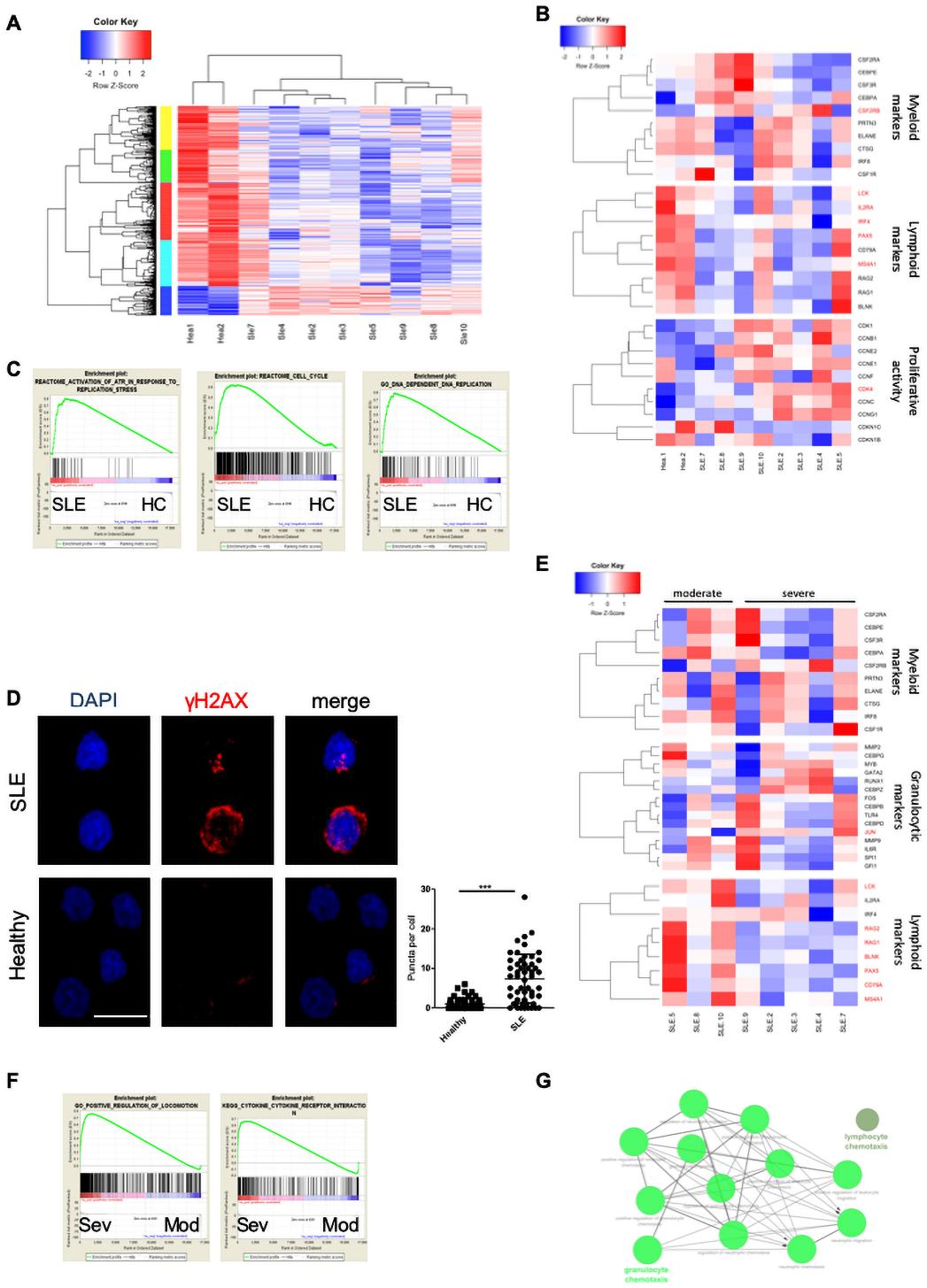
6.人类狼疮CD34+与小鼠狼疮CMP转录组的比较显示了在祖细胞期阻滞的共同特征
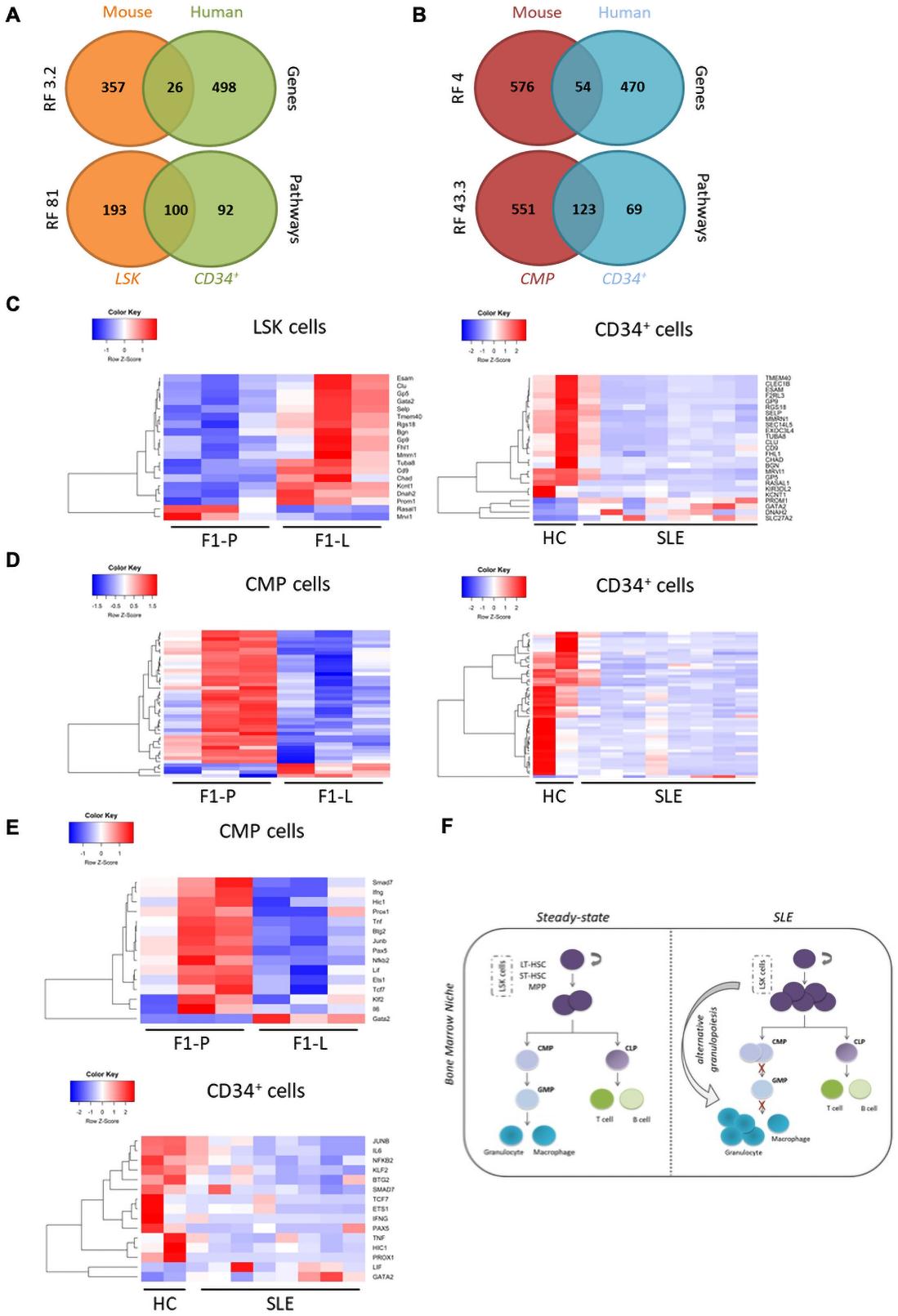
接下来,我们将人类CD34+转录组与LSK和CMP数据进行比较。我们发现LSK DEGs和CMPs DEGs与人类CD34+ DEGs存在显著重叠(图6A,B)。在人类SLE患者中,小鼠LSK和人类CD34+细胞共享的DEGs大部分下调,而在小鼠狼疮患者中没有下调(图6C)。然而,小鼠CMPs与人类CD34+细胞间的共同DEGs表达存在共性(图6D)。因此,SLE CD34+转录组特征更容易让人联想到小鼠狼疮CMPs而不是小鼠狼疮LSK。使用RNEA,我们发现狼疮CMPs和CD34+ SLE细胞中有15个被抑制的调节因子。其中,有重大疾病特定效应器如IFNγ和il - 6等,以及干细胞稳态分化平衡的调节因子如Ets1和Pax5(图6 E)。总的来说,狼疮患者的CD34+细胞在小鼠狼疮CMPs的转录谱中表现出更多的共性。
结论:
系统性红斑狼疮的免疫细胞异常可以追溯到来源骨髓的HSPCs。HSPCs的启动和异常的骨髓生成调节可能导致炎症和耀斑的风险。






