TAF1-急性髓系白血病的治疗靶点
TAF1在参与细胞周期和凋亡的基因表达中起着关键作用。研究表明赖氨酸43(K43)在AE上被p300乙酰化在AE诱导的白血病中起关键作用,并且TAF1优先与乙酰化的AE肽相互作用。那么小编给大家介绍一篇发表于nature communications上的文章“TAF1 plays a critical role in AML1-ETO driven leukemogenesis”,让大家具体了解TAF1在白血病发生中的作用。

结果:
1.AE表达细胞的增殖需要TAF1
为了阐明TAF1在AE表达细胞增殖中的作用,我们使用了两种不同的TAF1 shRNA来降低Kasumi-1和SKNO-1两种AML细胞系中TAF1的表达。通过TAF1的敲低抑制了这些细胞的增殖,表明TAF1对这些细胞的生长至关重要。另外,我们在不表达AE的K562白血病细胞系和CD34+ CB细胞中敲除TAF1。发现这两种细胞中TAF1表达的减少与Kasumi-1细胞的减少相当;然而,降低TAF1的表达对这些细胞的增殖几乎没有影响(图1a-d)。因此,TAF1在AE表达细胞的生长中起着特殊的作用。为了评估TAF1对细胞增殖的影响,我们使用BrdU标记细胞并使用流式细胞术测量细胞周期。TAF1的敲低降低了Kasumi-1细胞在S期的比例,但对K562细胞和CD34+细胞在S期的比例没有影响(图1e-h),因此,TAF1对AE表达细胞的增殖尤为重要。
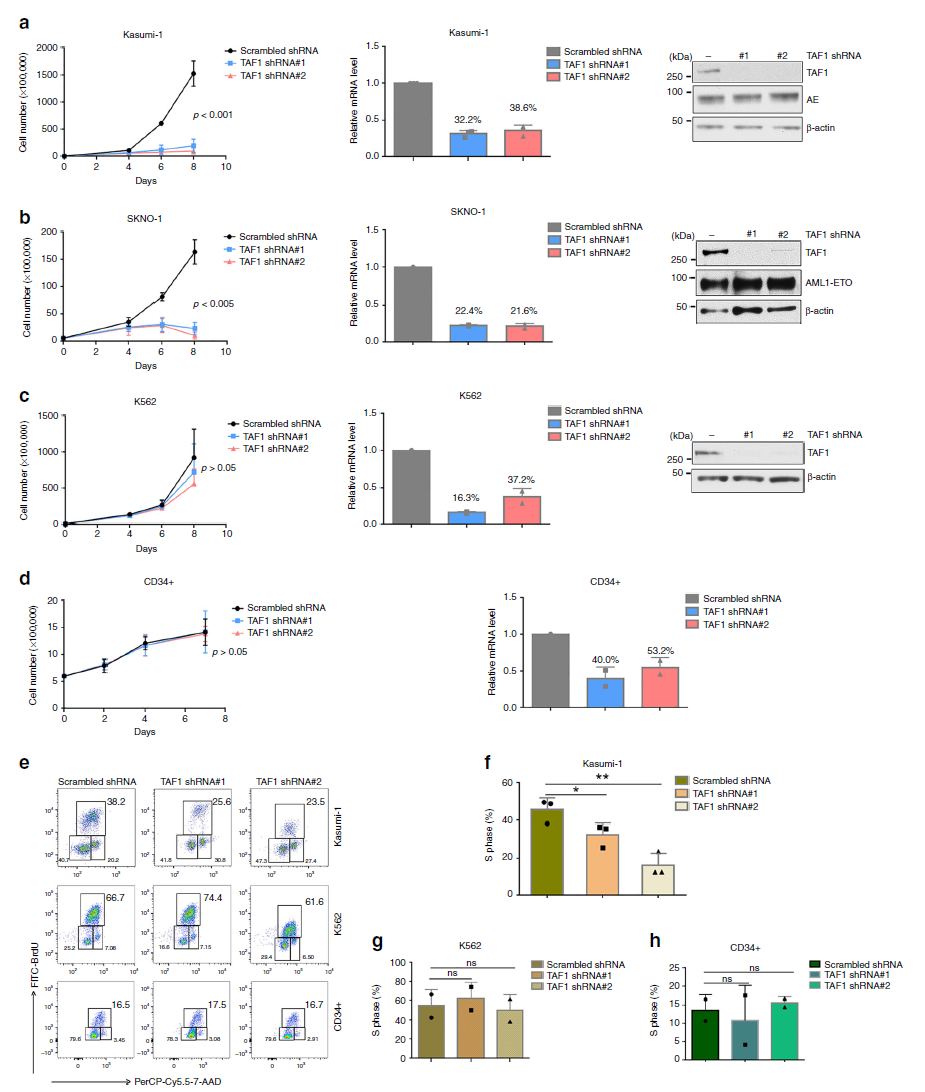
2.TAF1的敲低促进髓细胞分化,损害自我更新
我们检测了人类细胞中Mac-1(CD11b)的表达以及小鼠细胞中Mac-1和Gr-1的表达,发现在两种情况下,AE引起的髓细胞分化阻滞被TAF1敲低部分缓解。相比之下,TAF1敲低对无AE细胞的骨髓分化或这些标志物的表达影响不大(图2a,b)。综上所述,TAF1参与了髓细胞分化的阻滞。连续重复菌落形成测定和鹅卵石区域形成测定(CAFC)实验表明TAF1敲低明显抑制了AE驱动的序列复制能力和CAFC形成(图2c-e)。这些结果表明,TAF1促进AE诱导的HSPC自我更新。
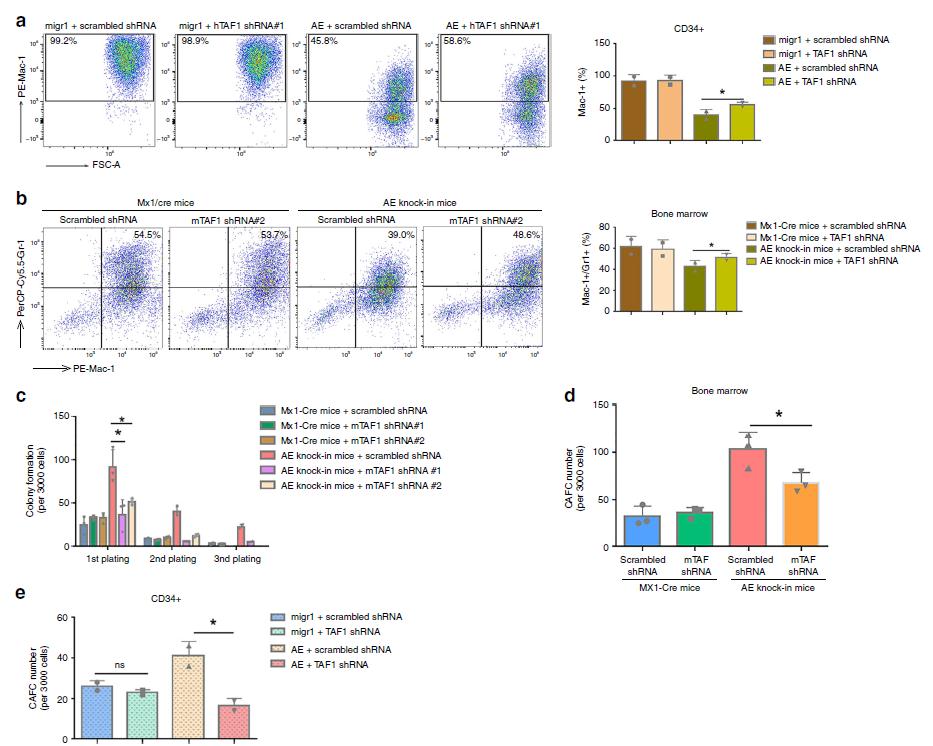
3.TAF1敲低抑制AE9a+细胞的增殖和自我更新
为了确定TAF1敲低对表达AE9a的白血病细胞的影响,我们开发了AE9a+荧光素酶+细胞系,并使用如图3a所示的次级脾白血病细胞。结果表明,TAF1的缺失损害了AE9a+白血病细胞的生长(图3b,c)。连续重复菌落形成测定和鹅卵石区域形成测定(CAFC)实验表明TAF1敲低降低了白血病细胞的集落形成,减少了鹅卵石样区形成细胞(CAFCs)的数量(图3d,e),说明TAF1对于维持AE9a+白血病干细胞的自我更新和频率至关重要。
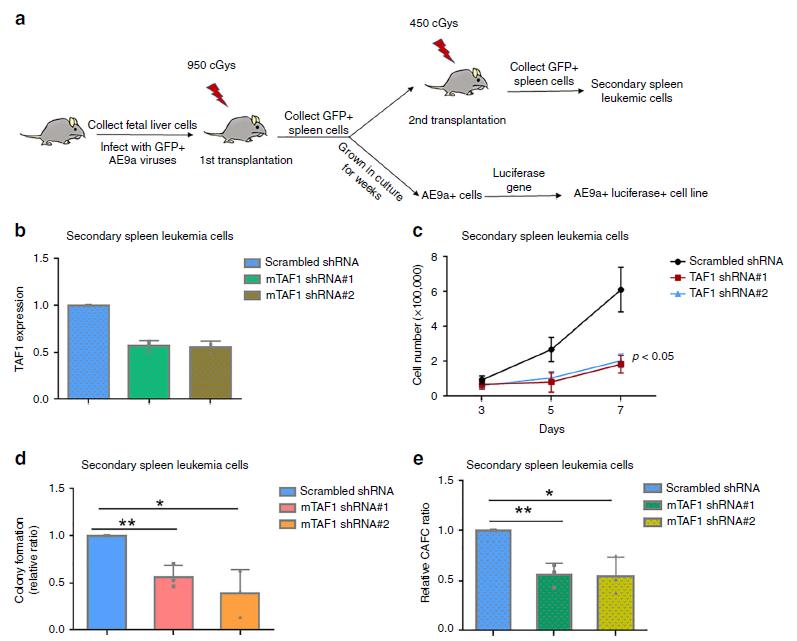
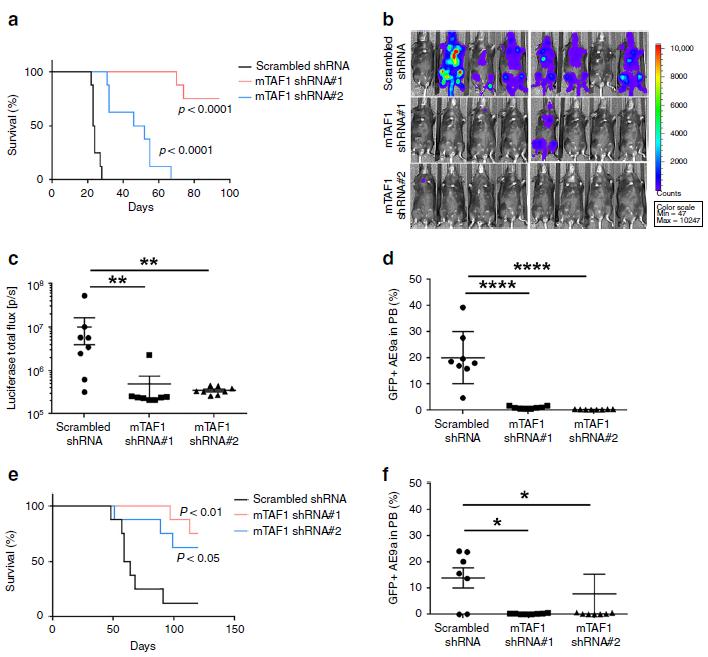
4.TAF1在AE9a诱导的白血病发生中起关键作用
为了确定TAF1是否参与AE9a驱动的体内白血病发生,我们使用两种不同的TAF1定向shRNA敲除AE9a+荧光素酶+小鼠骨髓细胞系中的TAF1。注射TAF1 敲低的AE9a+细胞的小鼠存活时间明显长于注射表达野生型TAF1水平的AE9a+细胞的小鼠(图4a),这表明TAF1在白血病发展中起关键作用。进一步,我们使用IVIS成像系统检测小鼠AE9a+白血病细胞的生长。发现接受TAF1 敲低的AE9a+荧光素酶+细胞的小鼠中只有1/16检测到荧光素酶信号(图4b,c)。为了进一步证明TAF1缺失会影响小鼠白血病细胞的生长,我们使用流式细胞术对注射3周后外周血中标记为AE9a+荧光素酶+的GFP细胞数量进行了量化,发现TAF1 敲低的GFP+细胞数量明显减少(图4d)。我们也注射了AE9a+白血病细胞,接受TAF1 敲低的细胞的小鼠存活时间更长,外周血中GFP+ AE9a+细胞明显减少(图4e,f)。总之,这些数据表明TAF1在AE9a诱导的白血病发生中起关键作用,并可能成为抗白血病治疗的潜在靶点。
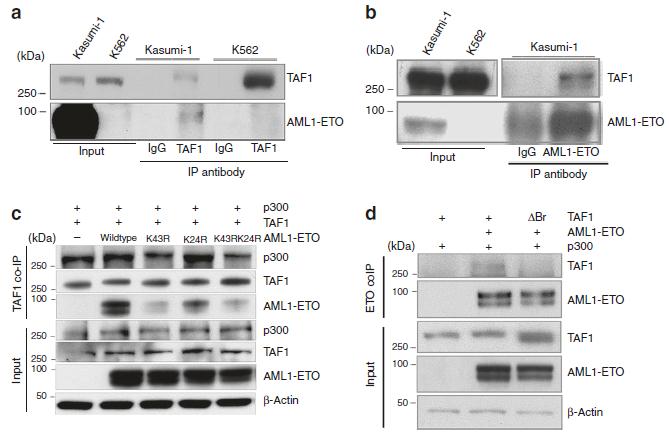
5.TAF1与AE相关
为了确定内源性TAF1蛋白是否与白血病细胞中的全长AE相关,我们使用抗TAF1和抗ETO抗体进行了互惠共免疫沉淀。如图5a, b所示,我们在Kasumi-1细胞中检测到TAF1与AE的物理相互作用。之后我们使用Kasumi-1细胞进行TAF1免疫沉淀后的质谱分析,并证实TAF1不仅结合AE,CBFβ,p300,还结合AE代数余子式SIN3A和HDAC1等(表1)。由于赖氨酸43(K43)在AE上的乙酰化对AE驱动的白血病是至关重要的,我们检查了TAF1与AE结合是否需要赖氨酸43 (K43)的乙酰化。如图5c所示,AE中赖氨酸-43突变为精氨酸,阻断了AE与TAF1的相互作用。因此,赖氨酸-43乙酰化对AE与TAF1的相互作用至关重要。为了确定TAF1中的溴域是否对识别AE上的K43乙酰化起关键作用,我们删除了TAF1的两个溴域,发现这消除了TAF1与AE的关联(图5d)。因此,TAF1通过其溴域与AE上的乙酰化赖氨酸-43结合。
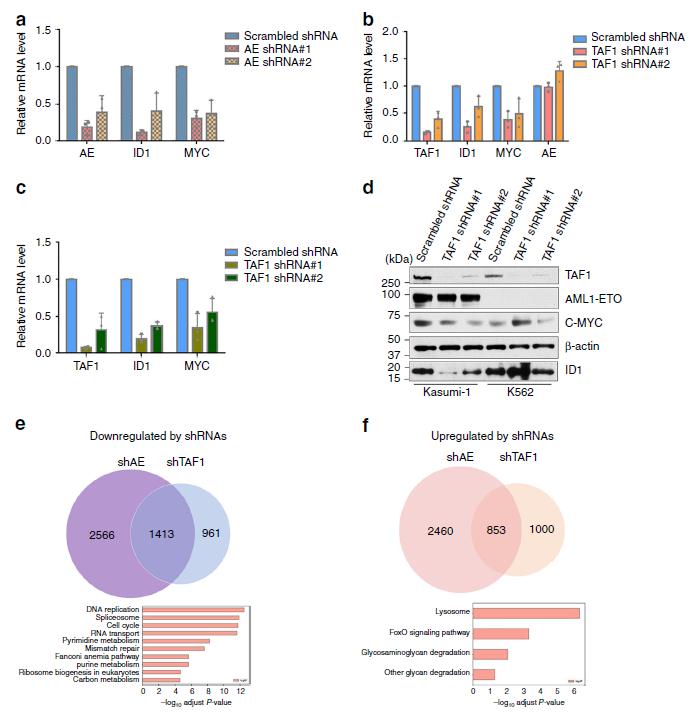
6.AE靶基因的表达受TAF1缺失的影响
鉴于TAF1在介导AML细胞AE作用中的重要性,我们探讨了TAF1的敲低如何影响AE调控的基因表达。ID1和MYC是AE激活基因,我们证实它们在Kasumi-1细胞中被AE敲低下调表达(图6a)。接下来,我们发现TAF1在不降低AE表达水平的情况下也显著降低了这些基因的表达(图6b,d)。我们还利用AE9a+小鼠细胞系,发现TAF1的缺失会影响ID1和MYC的表达(图6c)。另外我们发现36%的AE激活基因因TAF1敲低而下调(图6e)。KEGG分析表明,这些基因参与了DNA复制、RNA剪接、RNA运输、细胞周期、核苷酸代谢和核糖体生物发生。令人惊讶的是,TAF1敲低也上调了许多基因,其中26%的基因在AE敲低后上调(图6f)。显然,TAF1对于AE激活基因和被抑制基因的一个子集的表达至关重要,这暗示了TAF1在调节AE靶基因表达方面的独特作用。
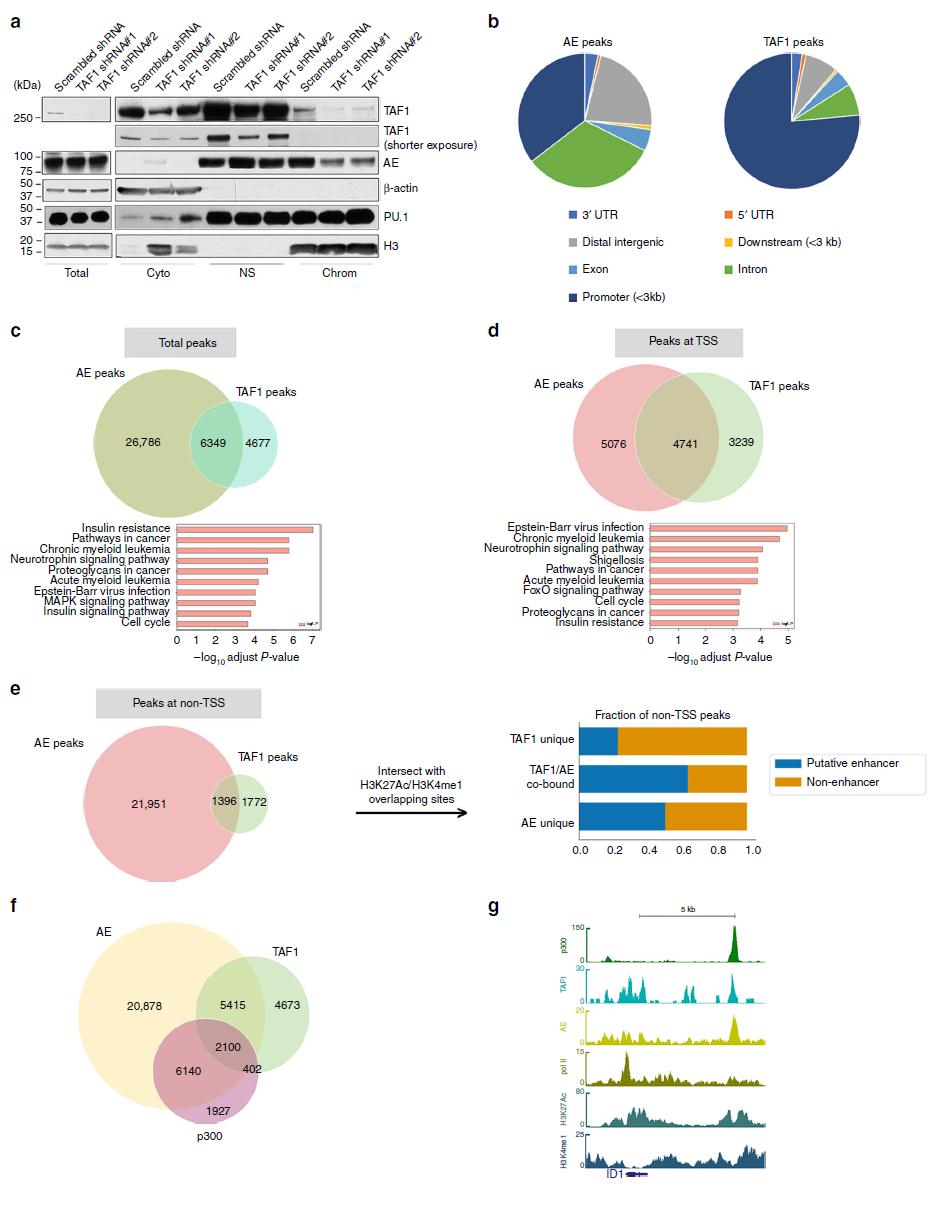
7.TAF1是AE与染色质结合的关键
为了评估TAF1在AE染色质沉积中的作用,我们生成了含有或不含TAF1敲低的Kasumi-1细胞亚细胞组分。如图7a所示,TAF1敲低对AE在染色质上结合的影响具有特异性。为了研究TAF1和AE在整个基因组中是否共定位于AE靶基因,我们在Kasumi-1细胞中使用抗AML1-ETO抗体和抗TAF1抗体进行ChIP-seq。如图7b所示,AE峰广泛分布于远端基因间区、启动子区和内含子,而TAF1峰大部分位于启动子区,这可能反映了TAF1在PIC中的作用。此外我们发现58%的TAF1峰与AE峰重叠,而19%的AE峰与TAF1峰重叠(图7c)。KEGG分析表明,重叠的峰值与急性和慢性髓系白血病相关的基因和癌症中的通路相邻。大部分重叠AE和TAF1峰位于转录起始位点(附近(图7d)。然而,从TSS(非TSS)可以看到大量的重叠峰(图7e)。非TSS的TAF1/AE重叠峰约60%位于假定的增强子上。这说明了TAF1/AE复合物在这些通路中的重要性。鉴于p300的乙酰化作用对TAF1和AE的相互作用至关重要,我们研究了p300是否与TAF1和AE共享空间。如图7f所示,28%的AE/TAF1共存区域也有p300结合,如ID1基因的增强子(图7g)。总之,这些数据表明,TAF1与AE在启动子和增强子区域的结合对AE靶基因的一个子集的表达至关重要,这些AE靶基因与细胞周期和白血病有关。
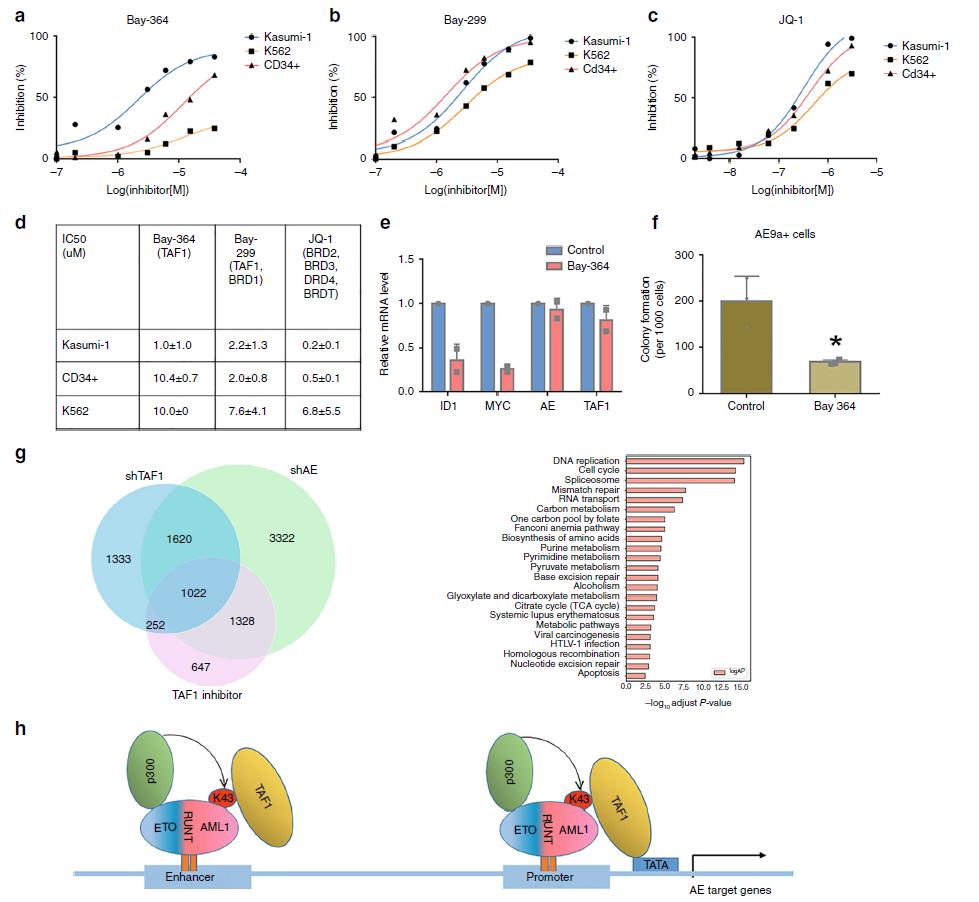
8.TAF1抑制降低了表达AE的细胞的增殖
鉴于TAF1在AE细胞增殖中的重要作用,我们检测了bay364和bay299对Kasumi-1、K562和CD34+细胞生长的影响。如图8a,d所示,与CD34+细胞或K562细胞相比,Kasumi-1细胞对bay364处理更敏感,其生长受到的影响最小。与此相反,bay299可抑制Kasumi-1细胞的生长,但对CD34+细胞和K562细胞有类似的作用(图8b, d)。JQ-1比bay364更能抑制Kasumi-1细胞的生长(图8c);然而,它对Kasumi-1细胞和CD34+细胞有类似的作用。接下来,我们使用经bay364或vehicle处理3天的Kasumi-1细胞检测bay364对AE介导的基因表达的影响。bay364可降低ID1和MYC的表达,但不影响AE的表达,与TAF1敲低作用相似(图8e)。为了评估第二个TAF1 结构域在控制TAF1和AE调控基因中的重要性,我们将TAF1敲低和AE敲低实验的RNA-seq数据与Kasumi-1细胞的RNA-seq数据进行了比较。总的来说,由TAF1敲低和AE敲低鉴定的39%的AE和TAF1调节的基因也受TAF1溴域抑制剂的控制。这些基因在细胞周期、DNA复制、代谢和凋亡中发挥作用(图8g)。此外,bay364处理显著影响AE9a+细胞的集落形成(图8f)。综上所述,通过调节AE靶基因的一个关键子集,第二个TAF1结构域似乎对AE表达细胞的生存和集落形成具有选择性的重要性。
结论:
在本研究中,我们证实TAF1与白血病细胞AE相关,TAF1的KD的下调破坏了自身的更新,促进了AML细胞的髓样分化和凋亡,从而阻碍了白血病细胞的生长。此外,TAF1的缺失降低了AE与染色质的联系及其调控AE激活基因和抑制基因表达的能力。总之,这些结果揭示了TAF1在AE驱动的白血病发生中的独特作用, TAF1有可能成为表达急性骨髓性白血病的治疗靶点。






