不同类型的T细胞的团队合作通过免疫疗法促进肿瘤破坏
免疫细胞,通常也叫CD8 T细胞,它可以靶向破坏癌细胞,因而有望用于临床治疗。但是这个作用过程并不清楚。Alspach et al在大鼠实验中发现了另一种免疫细胞,又称为CD4 T细胞辅助因子,它在免疫治疗后辅助CD8 T细胞靶向肿瘤发挥着重要作用。本文于今年11月发表于Nature (IF:43)上。
肿瘤细胞的突变会产生异常蛋白,这些异常蛋白的片段(称为新抗原)主要与组织相容性复合体(MHC)分子在细胞表面结合。如果一个新抗原被CD8 T细胞识别,则可以靶向,并杀死任何表达新抗原的肿瘤细胞。然而,这种细胞毒性反应可以被阻断,例如通过肿瘤周围的免疫抑制环境。免疫治疗中免疫检查点阻断或免疫检查点治疗可以抵消这些问题,使CD8 T细胞对肿瘤产生有效的免疫反应。最近的研究表明CD4 T细胞可能在肿瘤靶向免疫反应中起关键作用。
Alspach和他的同事们试图找出最低限度的免疫刺激新抗原需求来驱动小鼠进行免疫治疗后的有效免疫反应。作者研究设计了一种免疫系统通常不响应的肿瘤小鼠,并对其进行了改造以表达新抗原。使用计算预测方法鉴定出被CD8 T细胞识别的新抗原mLAMA4,被CD4 T细胞识别的命名为mITGB1的新抗原。在没有免疫疗法的情况下,这两种新抗原在肿瘤中单独或一起表达不足以引发针对肿瘤的有效免疫应答。 但是,如果两种新抗原均在接受免疫治疗的动物中表达,则肿瘤会消退。
为了检查这种反应是否仅取决于新抗原的量,而不是两种免疫细胞都需要新抗原识别,作者设计了小鼠肿瘤以表达两种不同的新抗原,这些新抗原可以被CD8 T细胞识别,而不能被CD4细胞识别。这些肿瘤对免疫疗法没有反应,表明成功的免疫反应取决于需要存在新抗原触发CD4和CD8 T细胞反应。
作者的分析表明,对mITGB1作出反应的CD4 T细胞具有一种称为T1型辅助细胞的CD4 T细胞的特征,可以增加CD8 T细胞的数量和杀伤活性。作者证实,与仅表达mLAMA4的动物相比,如果肿瘤同时表达mLAMA4和mITGB1,则确实导致CD8 T细胞数量和细胞毒活性增加。
Alspach及其同事还表明,如果先对即将死亡的肿瘤细胞进行疫苗接种,然后再植入表达mLAMA4和mITGB1的正在生长的肿瘤,那么如果疫苗中含有表达mLAMA4和mITGB1的肿瘤细胞,则移植的肿瘤将被最有效地排斥。
为了确定CD4 T细胞是否除了疫苗接种过程中增强CD8 T细胞的启动作用以外,还研究了在肿瘤部位是否需要mITGB1来进行主动的免疫反应。他们在小鼠的一侧植入了表达mLAMA4和mITGB1的肿瘤,又在相反的一侧植入了仅表达mLAMA4的肿瘤,并用免疫疗法对其进行了治疗(图1)。正如预期的那样,表达mLAMA4和mITGB1的肿瘤被免疫系统靶向并消退,但仅表达mLAMA4的肿瘤继续缓慢生长。与表达mLAMA4和mITGB1的肿瘤相比,正在生长的肿瘤被较少的CD4 T细胞和较少的能够识别mLAMA4的CD8 T细胞浸润。
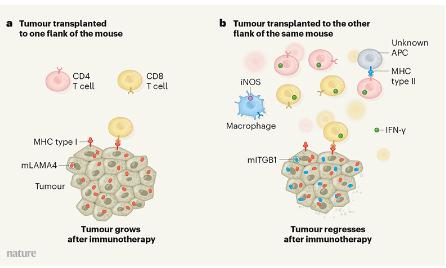
图1T细胞协同驱动免疫治疗的有效抗肿瘤反应
这些结果强调了肿瘤表达的新抗原是被CD4和CD8T细胞识别以产生对免疫疗法的有效反应。总之,这些数据表明,CD4T细胞不仅有助于启动CD8T细胞,而且还可以在肿瘤部位与CD8T细胞协同作用,从而在免疫治疗期间维持有效的抗肿瘤应答。但这种协作的机制尚待确定,作者认为,干扰素-γ(IFN-γ)是一种称为细胞因子的免疫信号蛋白,可能是实现这种合作的必要成分。 IFN-γ由CD8 T细胞和CD4辅助T细胞产生,可帮助应对免疫抑制性肿瘤环境。驱动iNOS表达,还需要CD8 T细胞,这提示这三种类型的细胞之间存在相互作用。与这些发现一致的是,先前的研究表明,CD4 T细胞中由IFN-γ触发的巨噬细胞活化导致肿瘤生长受到抑制。
作者研究的肿瘤细胞表达向CD8 T细胞呈递新抗原的I型MHC分子,但不表达向CD4 T细胞呈递新抗原的II型MHC分子。在该系统中,鉴定向CD4 T细胞呈递新抗原(例如mITGB1)的免疫细胞应该是未来研究的主题。该过程可能涉及捕获死亡后肿瘤细胞中的物质并将其呈递给II型MHC分子的抗原呈递免疫细胞,例如巨噬细胞或树突状细胞。确实,树突状细胞是维持IFN-γ依赖性免疫治疗反应所必需的。
作者研究的肿瘤细胞表达向CD8 T细胞呈递新抗原的I型MHC分子,但不表达向CD4 T细胞呈递新抗原的II型MHC分子。在该系统中鉴定向CD4 T细胞呈递新抗原(例如mITGB1)的免疫细胞应该是未来研究的主题。可能涉及捕获死亡肿瘤细胞中的物质并将其呈递给II型MHC分子的抗原呈递免疫细胞,例如巨噬细胞或树突状细胞。确实,树突状细胞是维持IFN-γ依赖性免疫治疗反应所必需的。
未来的研究可以调查是否应开发针对CD4和CD8 T细胞的免疫疗法以用于临床。长期以来,了解和利用CD4 T细胞应答进行免疫疗法的障碍一直是难以识别触发此类应答的新抗原,以及需要有足够的工具来监测这些应答。 Alspach及其同事的工作以及其他的工作表明,这种情况正在改变。






