一种骨肉瘤肺部转移的理想生物标志物--血浆EV-miRNA
导语
细胞外囊泡(EVs)已经成为细胞间通讯的新型介质,能够稳定转移治疗性microRNAs (miRNAs),因此,EVs作为一种用于癌症治疗的miRNA传递系统具有巨大的潜力。此外,随着含有mirna的EV被分泌到循环中,血浆EV中包含的mirna可能成为疾病的理想生物标志物。本文将描述一种潜在的肿瘤抑制因子miRNA, miR-101,并探讨通过EVs传递miR-101用于转移性骨肉瘤体内治疗的潜力,以及血浆EV-packaged miR-101 (EV-miR-101)水平预测骨肉瘤转移的潜在价值。
技术路线
1.通过原位杂交(ISH)研究miR-101在骨肉瘤中的表达与骨肉瘤进展的关系
2.利用体内模型进一步研究了miR-101的潜在抑制作用
3.利用预测软件分析,采用定量逆转录聚合酶链反应(qRT-PCR)、western blotting和双荧光素酶分析探讨miR-101在骨肉瘤中的作用机制。
4.将脂肪组织来源的间充质基质细胞(AD-MSCs)与慢病毒颗粒转导,获得富含mir -101的EV。
5.采用Transwell实验和骨肉瘤肺转移模型观察富mir -101的EVs对骨肉瘤侵袭性和转移的影响。
6.应用qRT-PCR检测骨肉瘤患者和健康对照组血浆EV-miR-101水平。
研究结果:
1.miR-101的下调与骨肉瘤患者的转移进展和不良预后相关
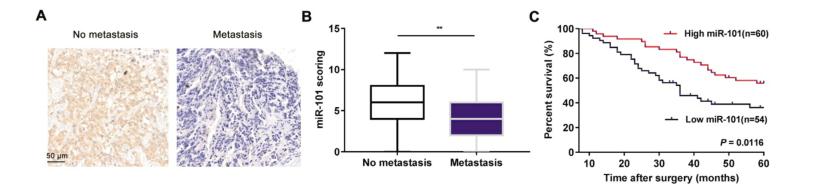
探讨miR-101在骨肉瘤转移中的作用,进行了原位杂交(in situ hybridization, ISH)来评估miR-101的表达。数据显示,miR-101在转移性骨肉瘤标本中的表达明显低于非转移性骨肉瘤标本。根据骨肉瘤标本中miR-101表达的ISH分数,114例骨肉瘤患者被分为高miR-101表达组和低miR-101表达组。如表所示,与高miR-101表达组相比,低miR-101表达组转移率更高,临床分期更晚。此外,低miR-101表达组的总生存时间也比高miR-101表达组短。总之,miR-101表达下降预示预后不良,可能是与骨肉瘤转移的刺激有关。
2.在体内模型中,miR-101对骨肉瘤转移具有抑制作用
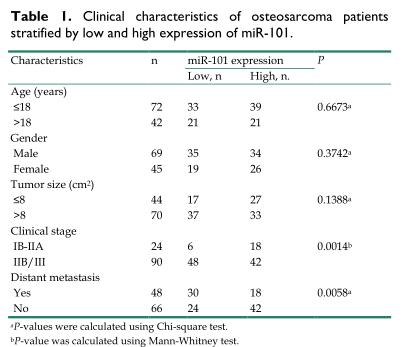
探讨miR-101是否能抑制体内肺转移,通过慢病毒载体介导的转导构建稳定表达miR-101的骨肉瘤细胞系,并通过定量逆转录聚合酶链反应(qRT-PCR)检测其转导效率。建立体内骨肉瘤转移模型,sosp - 9607细胞表达mir – 101。病毒颗粒通过尾静脉注入裸鼠实验。7周后处死小鼠,结果显示,与注射了nc转导细胞系的小鼠相比,注射了SOSP-9607-101或Saos-2-101细胞的小鼠与注射了nc转导细胞系的小鼠相比,转移性肺结节明显减少,肺重量明显降低。此外,为了排除miR-101对细胞增殖的影响,这可能影响体内肺转移的形成,我们使用CCK-8法评估慢病毒载体介导转导后的SOSP-9607-101和Saos-2-101细胞的增殖,并与NC细胞进行比较。结果miR-101的表达对这些骨肉瘤细胞的增殖几乎没有影响。
3.BCl6是miR-101在骨肉瘤细胞中的直接靶标
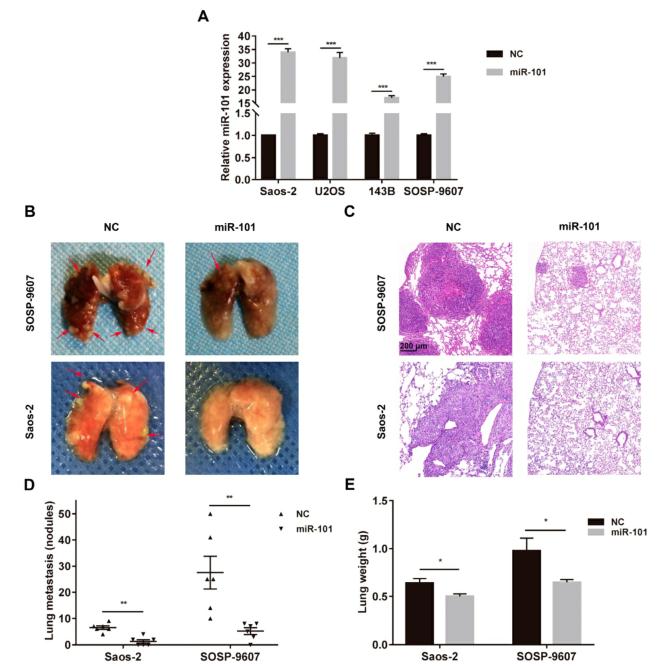
鉴于mir - 101之间的序列同源性和3翻译区(3 UTR) BCL6, 相对于数控同行, mir - 101表达升高的影响BCL6 mRNA和蛋白表达。此外,进行了双荧光素酶报告基因实验,结果显示,miR-101表达的升高显著抑制了143B细胞和Saos-2细胞中野生型BCL6 3 UTR报告基因的荧光素酶活性,但未抑制突变型报告基因的活性。qRT-PCR分析15对匹配的骨肉瘤组织和相邻正常组织中BCL6的表达,发现骨肉瘤组织中BCL6 mRNA水平较相邻正常组织升高。在15例骨肉瘤标本中,研究了miR-101和BCL6表达的相关性,结果显示,miR-101表达与BCL6 mRNA表达呈负相关。与miR-101的作用相比,BCL6显著增强骨肉瘤细胞的侵袭和迁移,BCL6的异位表达拯救了miR-101对骨肉瘤细胞侵袭和迁移的抑制。总之,这些数据表明,miR-101通过直接靶向BCL6来抑制细胞的侵袭和迁移。
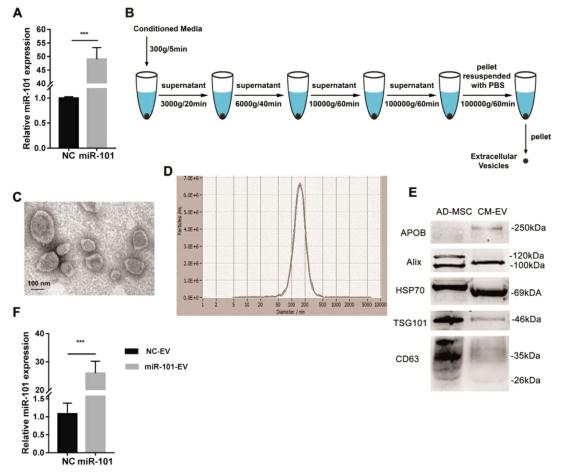
4.miR-101可以被成功包装成脂肪组织来源的间充质基质细胞(AD-MSC)来源的EV
通过流式细胞术检测包括CD31、CD34、CD44、CD45、CD90和CD105在内的阳性和阴性间充质干细胞(图S2A)的表达,确认分离的AD-MSCs的纯度。多重感染(MOI)的慢病毒载体介导转导48小时后,在AD-MSCs中观察到绿色荧光蛋白(GFP)的表达。重复流式细胞术分析间充质干细胞标记物的表达,并观察到工程化的AD-MSCs与天然的AD-MSCs之间无明显差异。研究AD-MSCs的多向分化潜能,诱导其分化为脂肪细胞、软骨细胞和骨细胞分别用油红O、阿利新蓝、茜素红S染色鉴别分化的细胞。AD-MSCs与原生的AD-MSCs具有相同的多向分化潜能。miR-101在表达miR-101 (ad - ms -101)的AD-MSCs中的表达较经qRT-PCR转导的NC病毒颗粒(ad - ms -NC)的AD-MSCs中的表达增加。差速离心从条件培养基中获得EV,透射电镜观察ad - msc衍生的EV和纳米颗粒跟踪分析。western blotting检测EVs的载脂蛋白B (APOB)蛋白标记物。ad - msc -101衍生EVs (AD-MSC-101-EVs)中miR-101的含量显著高于AD-MSC-NC衍生EVs (AD-MSC-NC-EVs)。
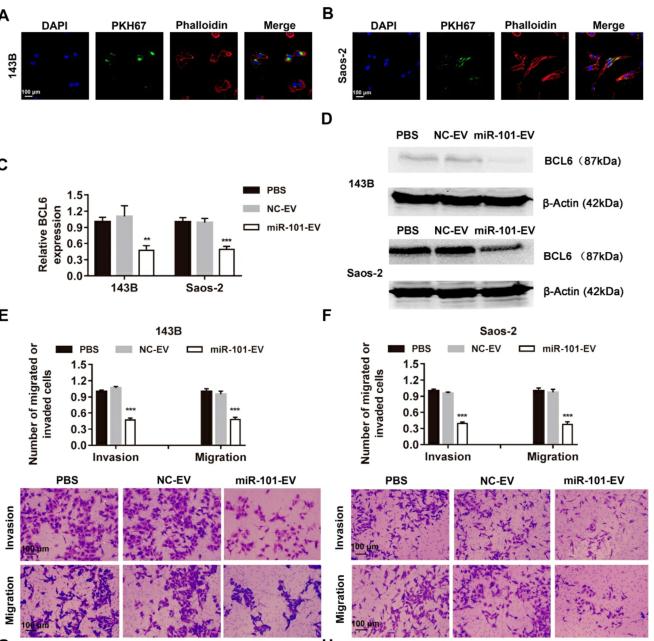
5.体外培养的AD-MSCs中,mir -101富集的EV可抑制骨肉瘤细胞的侵袭和迁移
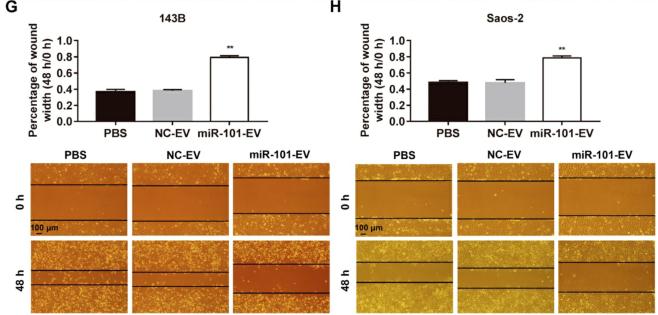
143-B和Saos-2细胞有效地吸收了AD-MSC-101-EV,如143B和Saos-2细胞中miR-101水平的增加所证明的。随后,这种摄取导致BCL6 mRNA和蛋白质表达降低。与用AD-MSC-NC-EVs或等体积的磷酸盐缓冲盐水(PBS)处理的细胞相比,用AD-MSC-101-EVs处理的骨肉瘤细胞显示出显着降低的侵袭和迁移能力。143B和Saos-2细胞迁移的伤口愈合测定结果与Transwell测定的结果一致。
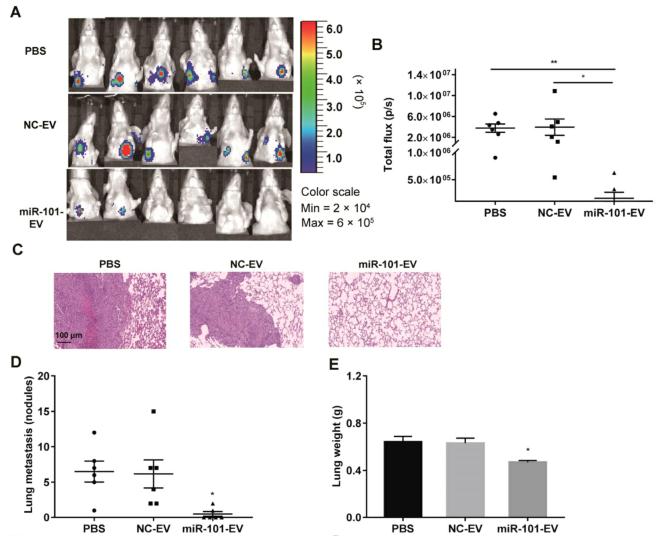
6.AD-MSCs中富含mir -101的EV可抑制体内骨肉瘤转移
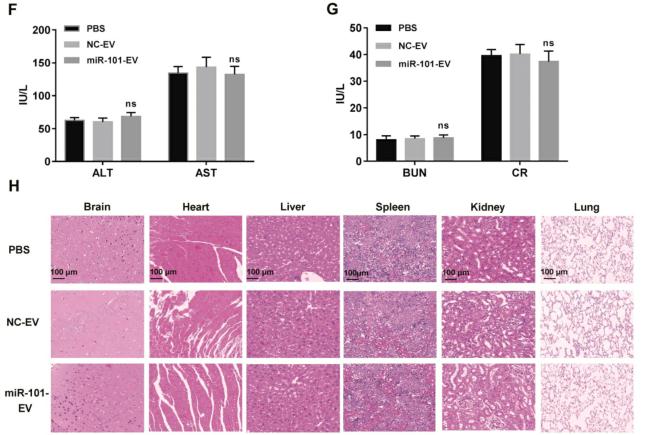
验证AD-MSCs中富含mir -101的EV是否具有治疗体内骨肉瘤转移的临床潜力,将稳定表达荧光素酶(143B-luci)的143B细胞注射到裸鼠胫骨近端形成肿瘤。2周后,AD-MSC-101-EVs、AD-MSC-NC-EVs或等量PBS分别注射到小鼠尾静脉,每周2次,共1个月。与接受AD-MSC-NC-EVs或PBS均出现肺转移的小鼠相比,接受AD-MSC-101-EVs的6只小鼠中只有2只在肿瘤细胞注射后7周内出现肺转移。在小鼠牺牲后,与接受AD-MSC-NC-EVs或PBS处理的小鼠相比,接受AD-MSC-101-EVs的小鼠肺转移结节数量和肺重量明显减少。评价EV治疗的体内安全性,将15只裸鼠随机分为3组(每组5只),分别给予AD-MSC-101-EVs、AD-MSC-NC-EVs或等量PBS。在最后注射治疗1周后,所有小鼠均被处死。血清学指标检测三组间差异无统计学意义,提示EV治疗对肝肾功能无不良影响。对主要脏器进行H&E染色,发现分别给予AD-MSC-101-EVs、AD-MSC-NC-EVs或PBS处理的小鼠无明显毒性。
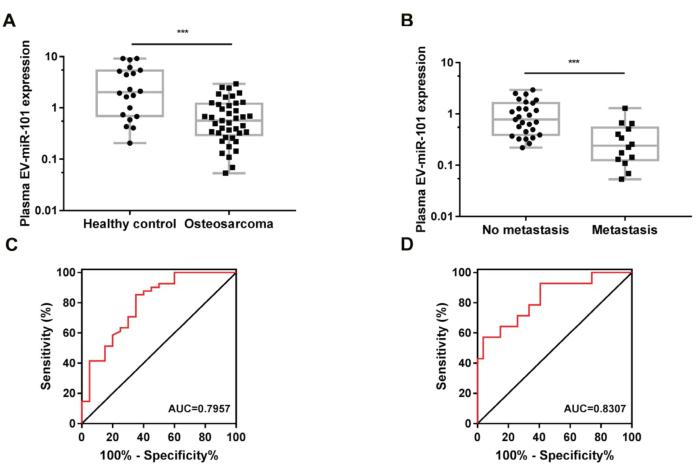
7. 血浆EV-miR-101显示出作为骨肉瘤诊断性生物标志物的潜力
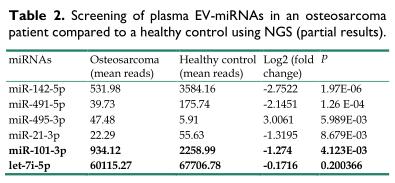
对差异表达的测序的结果,血浆样本中一个骨肉瘤病人显示了mir – 101在血浆EV的存在,以及减少的mir - 101等离子EVs的骨肉瘤病人与健康控制。进一步验证诊断潜在的EV - mir - 101,共检测61例骨肉瘤患者(41例,诊断时无转移)和健康对照组(20例)的血浆标本。与健康对照组相比,骨肉瘤患者的EV-miR-101表达较低。此外,与无转移的骨肉瘤患者(n=27)相比,有转移的患者(n=14)的miR-101水平更低然后进行受试者工作特性(Receiver operating characteristic, ROC)曲线分析,以评估血浆EV-miR-101作为诊断骨肉瘤的非侵入性生物标志物的潜在价值。结果表明,EV-miR-101水平可有效区分骨肉瘤患者与健康对照组(ROC曲线下面积)。另外,血浆EV-miR-101水平可以区分有转移的骨肉瘤患者和无转移的骨肉瘤患者。此外,血浆EV-packaged let-7i-5p (EV-let-7i-5p)的水平也被检测,并显示健康对照组和骨肉瘤患者之间没有显著差异。而且,无转移骨肉瘤患者与有转移骨肉瘤患者的血浆EV-let-7i-5p水平无显著差异。这些结果提示EV-let-7i-5p可作为未来骨肉瘤标志物研究的内源性对照。
总结 :
证明了miR-101是骨肉瘤侵袭性和转移的明确抑制因子,这些作用至少部分是通过调控BCL6介导的。来自AD-MSCs的EV显示出作为miR-101体内传递载体的巨大潜力。血浆EV-miR-101水平也具有作为骨肉瘤转移的新的生物标志物的激动人心的潜力,尽管这项研究由于这些样本的稀少而受到样本量的限制。需要进一步的研究来确定血浆EV-miR-101水平在其他更大的患者群体中的临床价值。但其结果为EV-miR-101在骨肉瘤转移患者新的诊断和治疗策略中的潜在应用提供了见解。






