肿瘤转移新机制:外泌体PMK2影响转移前微环境
早中期前列腺癌(PCa)的预后还比较可观,但是晚期的PCa预后较差,五年总体生存率较低,尤其是转移性PCa的死亡率较高。然而,PCa选择性骨转移的机制尚未可知。本文子在研究背景下出发发现了一种外泌体介导的PCa选择性骨转移的作用机制,并于2019年12月发表在期刊journal of experimental medicine (IF: 10.892)上。
主要结果如下:
1、前列腺癌来源的外泌体促进小鼠骨肿瘤的生长
从PC3细胞系分离得到的外泌体如图1所示。
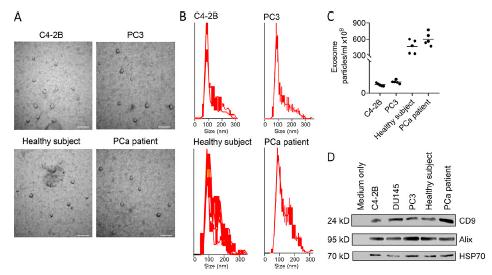
图1 外泌体的分离与鉴定
使用上述外泌体注射小鼠左心室21天,图2A和B显示PCa来源外泌体处理组的肿瘤负荷和转移部分都显著高于对照组、健康组和无外泌体处理组。并且,经外泌体预处理后的骨髓细胞中能检测到更多的前列腺癌细胞(图2 C)。静脉注射GFP标记的PCa来源外泌体,24小时后在骨髓基质干细胞检测的荧光图片(图2 D)。前列腺原位注射GFP标记的PCa来源外泌体,21天后在骨髓基质干细胞检测的荧光图片(图2 E)。此外,检测了其它组织中是否有前列腺癌细胞的的转移,结果如预期,在骨髓中转移最多(图2 G)。以上说明PCa外泌体并不直接作用于PCa细胞,而是通过远端靶微环境间接靶向和促进PCa进展,对骨髓有靶向选择性。
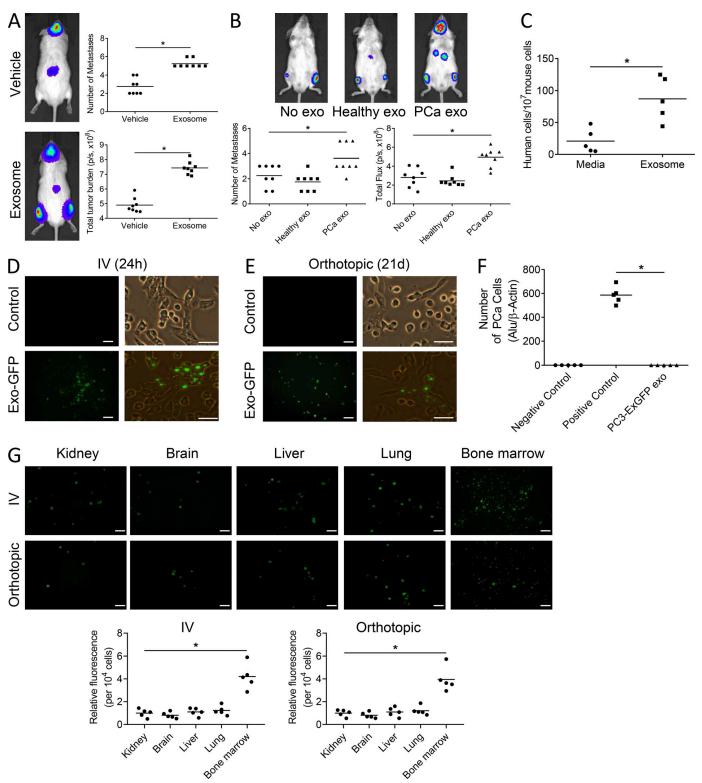
图2前列腺癌来源的外泌体促进小鼠骨肿瘤的生长
2、前列腺癌来源的外泌体可以诱导骨基质细胞增加PCa肿瘤细胞的增殖和侵袭
为了研究外泌体是否通过微环境间接促进PCa进展,我们评估了外泌体改变BMSCs影响PCa细胞生长能力的程度。分别使用新鲜培养基、C4-2B细胞外泌体、ST2细胞条件培养基、C4-2B细胞外泌体处理ST2细胞48小时后的条件培养基处理PC3和LNCaP细胞,结果发现未经外泌体处理的培养基并不能促进PCa细胞生长,相反,外泌体预处理后的基质细胞培养基可以促进PCa细胞生长(图3A)。因此,作者推测,外泌体通过改变基质细胞来促进PCa细胞生长。
为进一步验证上述推测,将PCa细胞皮下移植到没有基质细胞或相反侧腹有基质细胞的胶原海绵上,然后用空载体或PCa外泌体处理小鼠。单独的外泌体和基质细胞均不影响PCa的生长,而在基质细胞负载的海绵中,外泌体诱导了PCa的生长(图3B)。这些结果为体内外泌体调节基质细胞促进PCa生长提供了证据。为确定外泌体介导的对基质细胞的影响是否只针对成纤维细胞间质或扩展到其他骨髓细胞成分研究了PCa外泌体对内皮细胞、成骨细胞和破骨细胞前体细胞调节PCa生长能力的影响,结果显示,外泌体对成纤维细胞间质细胞的作用最强,其次是成骨细胞,对内皮细胞或破骨细胞无影响(图3C)。为了确定外泌体介导的基质细胞调节是否扩展到PCa进展的其他方面,评估了它们对PCa细胞侵袭性的影响,基质细胞条件培养基单独作用可促进PCa的侵袭,然而,经PCa细胞外泌体预处理的基质细胞的条件培养基进一步增强了PCa细胞的侵袭能力(图3 D)。
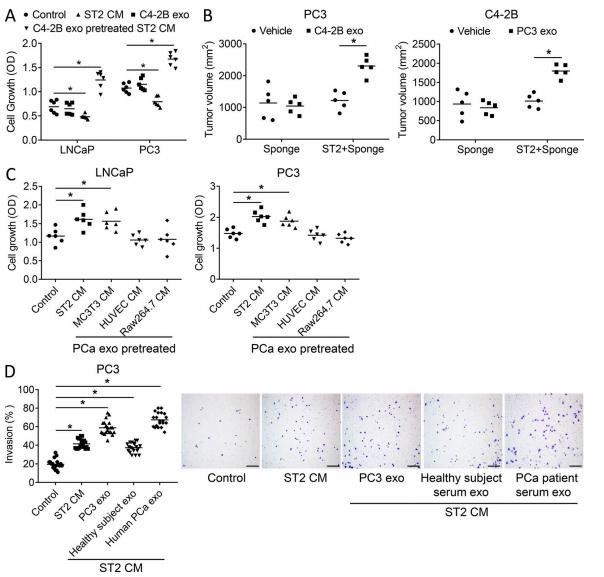
图3 PCa来源的外泌体可以诱导骨基质细胞增加PCa肿瘤细胞的增殖和侵袭
以上结果均是使用小鼠间质细胞系,作者进一步探究了是否在人的基质细胞系中也有相同的作用。因此,重复几次使用HS-5人骨髓干细胞系的实验,得出了类似的结论,如图4所示。这些结果表明,来源于PCa的外泌体对骨髓基质的影响能够促进PCa的进展。
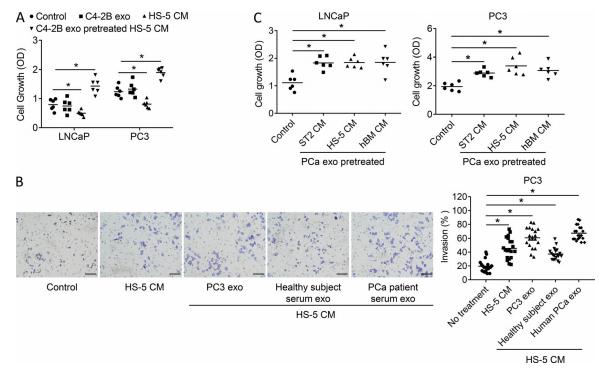
图4 PCa来源外泌体培养人骨髓间充质干细胞增加PCa肿瘤细胞的增殖和侵袭
3、PCa来源外泌体增加了基质细胞中PKM2的表达和C-X-C基序趋化配体12 (CXCL12)的产生
为了探索外泌体诱导骨髓基质形成肿瘤表型的机制,进行了蛋白组测序,在未处理细胞和外泌体处理细胞中筛选到超过30个差异表达蛋白。其中PKM2的差异最为显著,并且它是一种关键的生物学功能调节酶。因此,以PKM2为研究目标。研究发现,PCa外泌体可以增加患者和细胞系中PKM2在ST2细胞和原代BMSC中的表达水平(图5 A-C)。这说明,外泌体不诱导PKM2 mRNA的转录而是将PKM2蛋白从外泌体转移到靶细胞并/或内源性诱导PKM2向基质细胞转移。为了确定外泌体是否在基质细胞中诱导PKM2蛋白的合成,使用蛋白合成抑制剂CHX处理基质细胞。在有或没有CHX的情况下,PCa来源的外泌体诱导基质细胞来源的外泌体中的PKM2水平达到类似的水平(图5 D),表明这种增加并不依赖于蛋白质的合成。为了进一步证明PKM2是从人类PCa细胞转移到小鼠间质细胞,使用针对人类而非小鼠PKM2的抗体评估了PKM2在间质细胞中的表达。用含有人PKM2的外泌体处理基质细胞(争夺对照)可增加人PKM2在基质细胞中的表达(图5 E)。综上所述,这些结果表明外泌体将PKM2蛋白转移到基质细胞,而不是诱导PKM2 mRNA合成或蛋白合成。
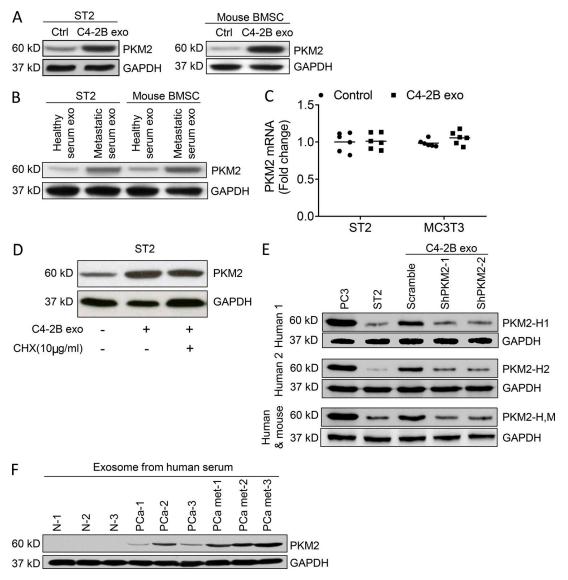
图5 PCa来源的外泌体将PKM2蛋白转移到BMSCs
之后,探究PKM2是否是外泌体介导基质细胞促进PCa细胞转移的关键。作者在PCa细胞中敲低PKM2以创建PKM2缺陷型外泌体,并测试其诱导促肿瘤发展的能力。图6A证实敲低PKM2会导致产生缺乏PKM2的外泌体(图6A)。进一步地,PKM2缺失的外泌体没有改变ST2基质细胞中PKM2蛋白的表达(图6B)。上述表明PKM2蛋白是转移到基质细胞,而不是由外泌体诱导合成。为了确定PKM2的缺失是否会影响肿瘤生长,将PKM2缺失的外泌体处理的基质细胞培养成条件培养基,培养癌细胞系,导致PCa外泌体诱导PCa细胞生长能力的丧失(图6 C)。小鼠体内实验证实原发前列腺肿瘤促进转移,PKM2促进原发肿瘤的转移能力。这些结果与原发肿瘤可以通过外泌体PKM2促进转移的观点相一致。

图6 PCa来源的外泌体通过PKM2增加基质细胞中CXCL12的产生
4、PCa外泌体通过PKM2诱导的BMSCs分泌CXCL12促进PCa肿瘤生长
为了探索PCa外泌体中的PKM2是否通过调节基质细胞中可溶性因子的产生以促进PCa的生长,使用qPCR阵列评估经对照或PKM2敲除PCa外泌体的基质细胞产生趋化因子和细胞因子的表达量。PKM2的下调改变了几种细胞因子的表达,BMP-4和CXCL12的表达下降最为明显(图7A)。实验发现,PKM2敲除后对CXCL12的表达影响要远大于BMP-4(图7B-C)。总之,PKM2显著增加基质细胞中CXCL12的产生,而对BMP-4的诱导作用有限。

图7 外泌体PKM-2促进骨髓基质BMP-4和CXCL12的表达
为了确定PCa外泌体诱导的基质细胞是否通过CXCL12促进PCa细胞生长,有或没有AMD3100(一种抑制CXCL12结合其靶标CXCR4的物质)的条件下,用PCa外泌体处理的基质细胞的条件培养基中孵育PCa细胞。如前观察到的,来自PCa衍生的外来体处理过的基质细胞的条件培养基增加了PC3和C4-2B细胞的生长和侵袭。但是,AMD3100抑制了这种诱导作用(图8A和B)。这表明CXCL12有助于外泌体诱导的增殖作用。并验证了CXCL12促进PCa细胞增殖与侵袭依赖于PKM2。但是,与仅使用PKM2敲除的PCa外泌体相比,AMD3100和PKM2敲除的PCa外泌体的组合作用并没有进一步抑制增殖或侵袭(图8C和D)。如图8E-L所示,在小鼠体内实验中也验证了上述结论。综上所述,PCa外泌体运输的PKM2调节基质细胞中CXCL12的产生以促进PCa的生长和侵袭。

图8 PCa外泌体通过PKM2诱导的骨髓细胞CXCL12表达促进PCa肿瘤生长
5、PCa外泌体通过PKM2依赖方式诱导HIF-1α促进基质细胞中CXCL12表达
文献报道HIF-1α促进CXCL12的表达,因此,作者首先探究了外泌体是否促进HIF-1α表达又是否依赖于PKM2。结果显示PCa来源的外泌体刺激了ST2基质细胞系和BMSC中HIF-1α mRNA和蛋白水平的表达,在PKM2敲除的PCa外泌体显著减少了HIF-1α mRNA和蛋白表达(图9A-C)。这些结果表明,PCa衍生的外来体以PKM2依赖的方式促进HIF-1α表达。为了确定外泌体诱导的HIF-1α是否调节CXCL12表达,敲低基质细胞中的HIF-1α,并用外泌体处理,以确认HIF-1α表达的丧失(图9 D)。然后,用C4-2B PCa衍生的外泌体处理基质细胞,并观察到基质细胞中HIF-1α的敲低显着降低了外泌体介导的CXCL12 mRNA和蛋白的表达(图9 E)。综上所述,PCa衍生的外泌体以PKM2依赖性方式刺激HIF-1α表达,进而诱导CXCL12表达。
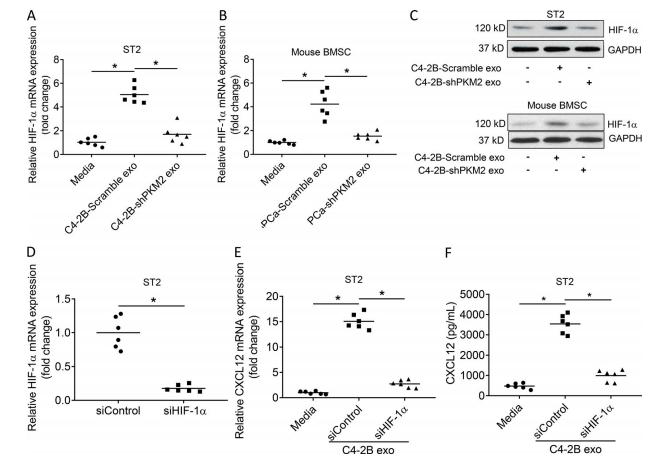
图9 PCa来源的外泌体增加BMSC细胞中CXCL12表达通过PKM2诱导HIF-1α
综上所述,本文证实,肿瘤来源的外泌体介导的PKM2转移是调节骨髓微环境以促进CXCL12表达和PCa骨转移进展的关键介质。总的来说,这项工作提出了一种新颖的机制,通过该机制,原发性肿瘤与骨骼微环境发生相互作用,从而建立了转移前niche环境并促进PCa骨转移进程。
参考文献:
Dai Jinlu., Escara-Wilke June., Keller Jill M., Jung Younghun., Taichman Russell S., Pienta Kenneth J., Keller Evan T.(2019). Primary prostate cancer educates bone stroma through exosomal pyruvate kinase M2 to promote bone metastasis. J. Exp. Med., 216(12), 2883-2899. doi:10.1084/jem.20190158






