肿瘤微环境中有氧糖酵解调控新机制
肿瘤微环境中,低氧信号通路、外泌体及lncRNA所发挥的作用是目前研究人员密切关注的内容。这里小编给大家分享一篇NCB(Nature Cell Biology)上发表的相关代表性研究。doi: 10.1038/s41556-019-0299-0。该工作模式图如下。
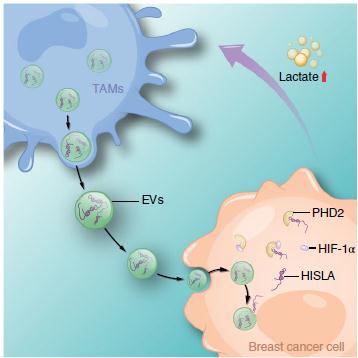
模式图
首先作者在组织样品中通过巨噬细胞表明标志CD68与糖酵解标志基因GLUT4、GLUT1的IHC、IF检测以及TUNEL法凋亡检测,发现临床乳腺癌样品中,巨噬细胞浸润处糖酵解水平更高、凋亡水平更低。接下来作者在巨噬细胞和乳腺癌细胞系共培养的细胞模型中,通过测定葡萄糖消耗、乳酸产量和细胞外酸化率证实,乳腺癌来源原代巨噬细胞能上调乳腺癌细胞的糖酵解水平。结果见图1.
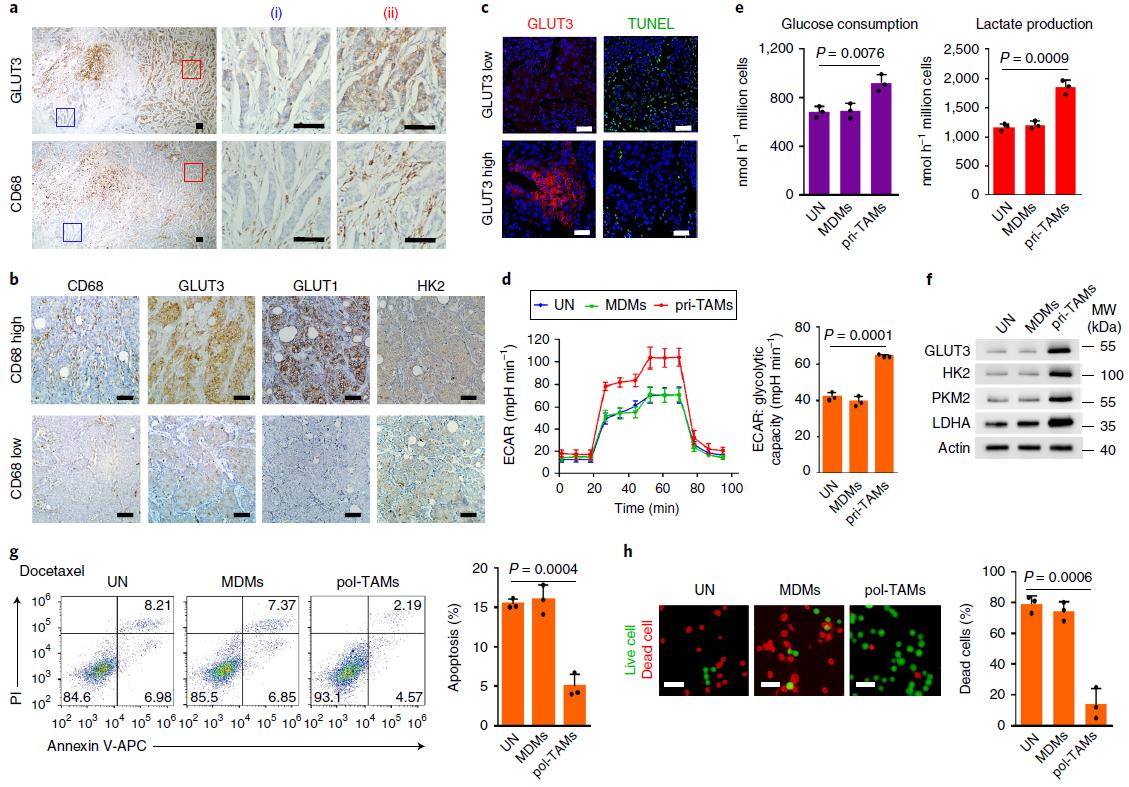
图1
问题1:在该处理下,乳腺癌细胞糖酵解水平为什么会提高呢?鉴于缺氧相关转录因子HIF-1α在细胞氧应答通路中的核心调节作用,作者首先检测和HIF-1α的蛋白水平变化,发现了乳腺癌巨噬细胞处理后,乳腺癌细胞系中HIF-1α蛋白稳定性显著增加,而转录水平(mRNA)无显著差异。在乳腺癌细胞系中敲低HIF-1α后,乳腺癌巨噬细胞促进其糖酵解并抑制凋亡的功能将被阻断,这证实HIF-1α参与该过程的下游调控。结果见图2.
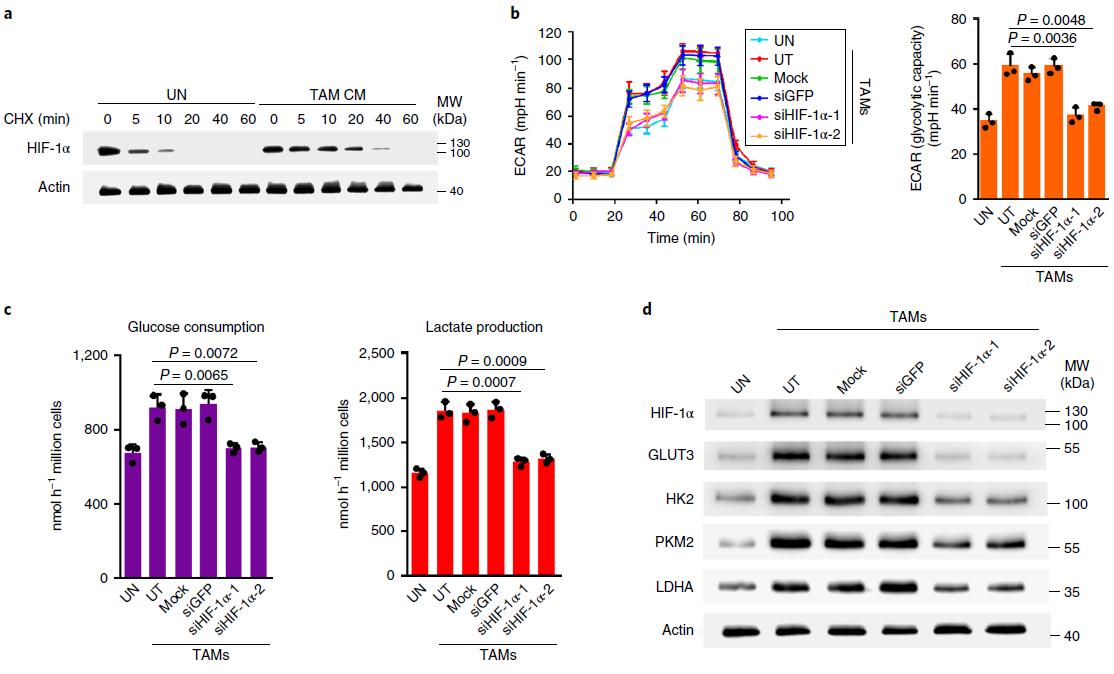
图2
问题2:巨噬细胞是通过什么作用或分子发挥该功能?通过梯度离心分离巨噬细胞培养液中不同组分后,作者发现细胞外囊泡而不是其他上清组分发挥该功能。通过抑制RAB27阻断外泌体分泌后,癌症巨噬细胞与乳腺癌细胞共培养将不再促进其糖酵解过程。作者接下来便检测不同巨噬细胞及其外泌体和受体细胞MAD-MB-231在处理前后的表达谱变化,得到5个候选靶标后分别进行siRNA敲低检测,最终发现ENST00000553929(HIF-1α-stabilizing long noncoding RNA , HISLA)调节该过程。结果见图3.
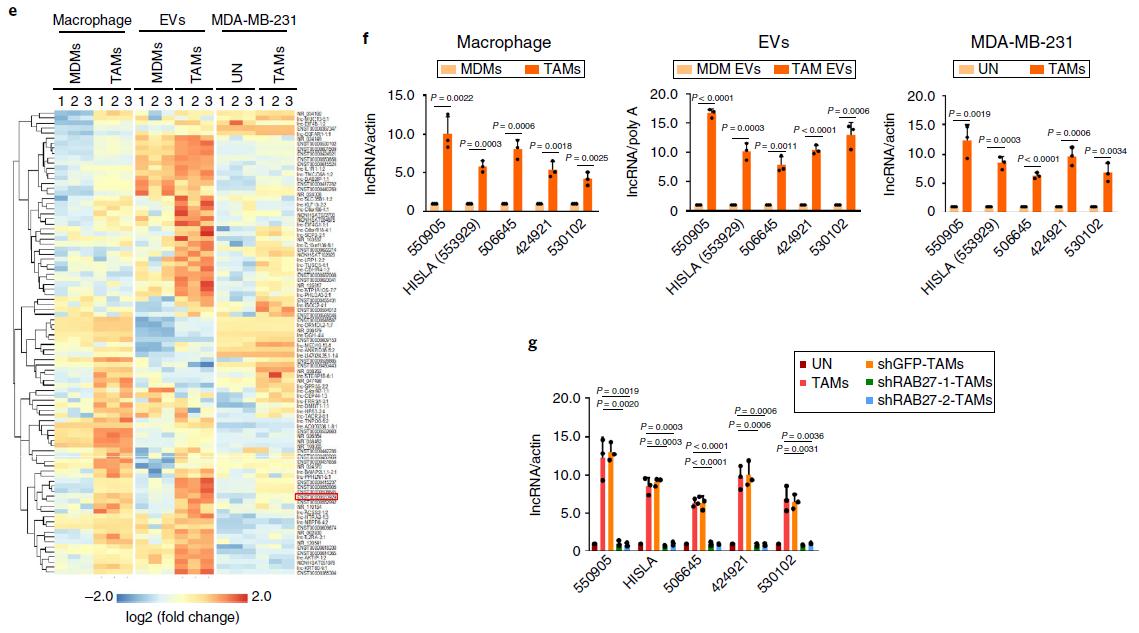
图3
一系列的实验结果也分别证明了是肿瘤巨噬细胞胞外囊泡转运HISLA至乳腺癌细胞并通过该lncRNA促进癌细胞糖酵解和抑制凋亡。核心实验包括lncRNA标记、抑制受体细胞转录后检测表型、干扰外泌体中lncRNA含量等。
问题3:肿瘤巨噬细胞中HISLA的表达是如何调控的。作者在发现在肿瘤微环境的各种细胞类群中,HISLA只在巨噬细胞中高表达后,进一步研究了它的表达受那个转录因子调节。Motif分析和ChIP-qPCR等实验验证表明,转录因子PU. 1直接调节HISLA的转录。进一步的分析表明肿瘤微环境中的乳酸能促进HISLA的表达,但该过程的调控与本地表达调控机制不同,转录因子ELK1调控了这一过程。结果见图4.
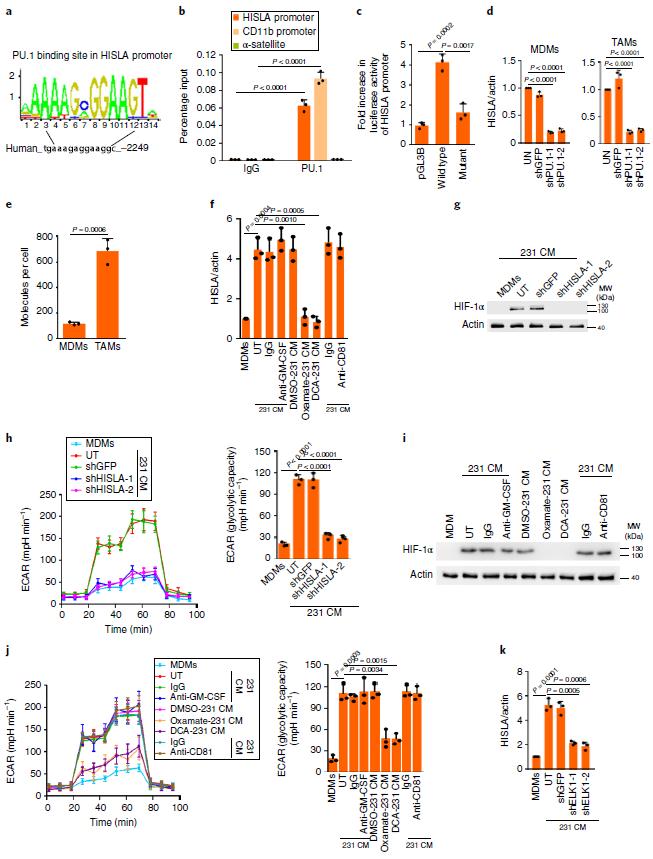
图4
问题4:HISLA在进入乳腺癌细胞后通过什么机制发挥作用。通过RNA pull-down和RIP-qPCR分析后,作者发现HISLA能直接结合PHD2并抑制其与HIF-1α的相互作用,进而抑制HIF-1α的泛素化降解。

图5
问题5:该结论在体内模型和临床样品中是否成立呢。在更深入的研究后,作者在小鼠体内模型和临床样品统计结果中也得到了同样的结论。
小结:
该文献以乳腺癌中癌细胞的有氧糖酵解为研究出发点,发现肿瘤微环境中巨噬细胞具有调节作用。在供体细胞(巨噬细胞)-受体细胞(乳腺癌细胞)-效应分子(HISLA)三者调节关系进行非常系统的研究。此外,临床样品的统计结果也极大的延伸了其价值。这非常值得大家学习。






