DNA甲基化通过激活lncRNA SNHG12促进成胶质细胞瘤的替莫唑胺耐药性
替莫唑胺(temozolomide, TMZ)是目前脑胶质瘤临床一线化疗药物,结合放疗可部分延长新诊断胶质瘤患者的生存时间。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南已把手术、放疗和替莫唑胺化疗作为新诊断胶质瘤患者的标准治疗方案,此方案使得患者的平均生存时间从单独放疗的12.1 个月提高到14.6 个月,五年的存活率为9.8%。脑胶质瘤的化疗效果受限于替莫唑胺化疗耐药,肿瘤经常治疗后迅速复发,使得脑胶质瘤的治疗成为目前医学难题之一。
长链非编码RNA(long noncoding RNA,lncRNA)是一类转录本长度大于200nt,不具有蛋白编码功能的非编码RNA。近年研究发现,lncRNA 可在染色体修饰、转录及转录后水平参与基因的表达调控,影响细胞的增殖、分化和凋亡,介导肿瘤的发生、发展、侵袭迁移等生物学行为。LncRNA与脑胶质瘤的发生发展密切相关,参与脑胶质瘤的起源、生长、侵袭等,影响脑胶质瘤患者预后,并通过多种途径调节DNA 甲基化、组蛋白修饰和染色质重构等,在脑胶质瘤恶性进展过程中发挥重要作用。ceRNA网络参与某些癌症术后抗药性的介导,但很少报道其在TMZ抗药性中的作用。
近日,来自南京医科大学附属第一医院神经外科南京医科大学江苏省癌症个性化医学协同创新中心江苏省癌症生物标志物,预防与治疗重点实验室,南京医科大学江苏省肿瘤生物标志物,预防与治疗重点实验室,江苏省肿瘤个人医学协同创新中心魏艳&游永平课题组在Mol Cancer 发表题为DNA-methylation-mediated activating of lncRNA SNHG12 promotes temozolomide resistance in glioblastoma的研究,报道了lncRNA SNHG12(小核仁RNA宿主基因12)在GBM中获得性TMZ抗性中的作用以及表观遗传调控对其异常表达的影响。
研究人员通过qRT-PCR和原位杂交法检测在TMZ敏感和TMZ耐药的GBM细胞和组织中的检测SNHG12的表达水平。通过体外实验(western blots,菌落形成,流式细胞术和TUNEL实验)检测SNHG12对TMZ耐药性的影响。通过生物信息学分析,BSAS测序以及甲基化特异性PCR,双荧光素酶报告基因,染色质免疫沉淀测定,RNA免疫沉淀测定,免疫荧光,qRT-PCR和Western blots实验确定SNHG12在TMZ耐药细胞中高表达的机制及其与miR-129-5p,MAPK1和E2F转录因子7(E2F7)的关系。然后研究人员利用颅内移植瘤小鼠模型来研究SNHG12的功能。
研究人员发现在TMZ耐药细胞和组织中,SNHG12表达上调。过表达SNHG12可使细胞TMZ耐药,而抑制SNHG12恢复了TMZ敏感性。研究人员进一步发现在SNHG12启动子区域DNA甲基化水平异常低,DNA甲基化缺失使该区域易被Sp1转录因子(Sp1)控制; 这表明DNA甲基化和SP1共同调控SNHG12的表达。在细胞质中,SNHG12充当miR-129-5p的海绵,导致MAPK1和E2F7上调,使GBM细胞具有TMZ抗性。MAPK1的去抑制作用通过激活MAPK/ERK通路来调节TMZ诱导的细胞凋亡和G1/S细胞周期转变,而E2F7的失调主要与G1/S细胞周期转变有关。在临床上,SNHG12过表达与GBM患者TMZ治疗后生存期差有关。
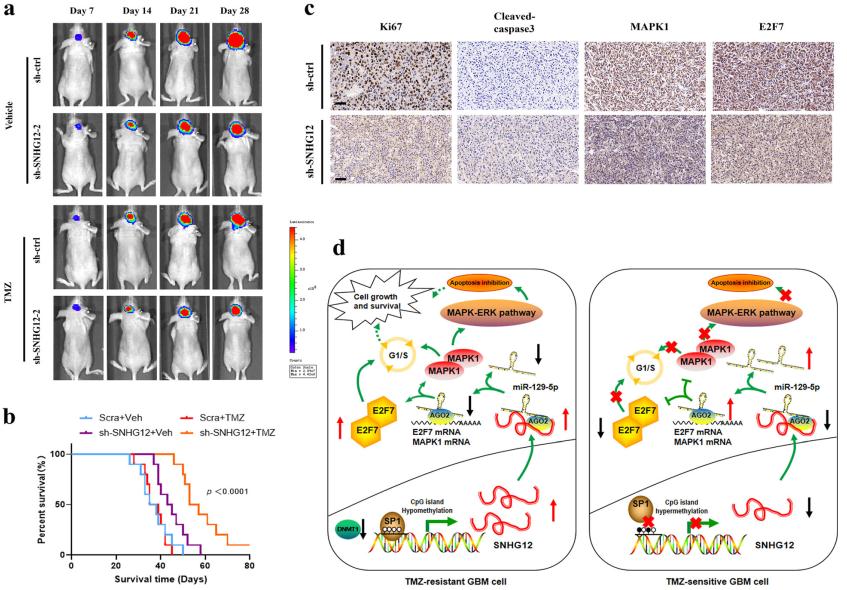
总的来说,研究人员发现SNHG12在TMZ耐药GBM细胞系和组织中高表达;SNHG12基因敲除可在体外恢复TMZ耐药GBM细胞的TMZ敏感性;SNHG12过表达可抵抗TMZ;DNA甲基化和SP1共同调控SNHG12的表达;SNHG12充当miR-129-5p的海绵;在促进细胞增殖和抑制细胞凋亡中发挥重要作用,从而增加MAPK1和E2F7的表达,激活MAPK-ERK通路;MAPK1和E2F7在SNHG12介导的替莫唑胺抗性中发挥不同的作用;敲除SNHG12可在体内恢复TMZ敏感性。此外,研究人员还发现SNHG12在临床中与较差的总生存率和药物敏感性相关。因此,SNHG12是一种有前途的预后生物标志物,是治疗GBM耐药的潜在治疗靶点。






