揭秘:焦亡与CAR-T疗法中细胞因子风暴
作为新发现的一种程序性死亡方式,焦亡备受科研界关注。细胞因子释放综合征(CRS),也就是常说的细胞因子风暴,是CAR-T疗法的一个常见副作用。近日,一篇发表在Science Immunology的文章阐述了CRS的发生机制,首次将焦亡与CRS联系在一起,开拓了焦亡研究的新世界。

技术路线:

结果:
1.CAR-T细胞诱导靶细胞凋亡
从B细胞急性淋巴细胞白血病(B-ALL)患者分离的白血病细胞与识别CD19的CAR-T细胞孵育时,白血病细胞的活力减弱,而人表皮生长因子受体2(HER2)特异的CAR T细胞没有这种作用。肿瘤细胞有肿胀的外观,质膜产生大气泡,超过30%的CD19+ B白血病细胞是PI+,在上清液中存在高水平的LDH,提示CAR-T细胞诱导CD19+ B白血病细胞发生焦亡。CAR-T细胞对CD19+ Raji和NALM-6白血病细胞中有相同影响。开发一种原子力显微镜(AFM)技术可视化细胞膜中孔的形成,观察到与CAR-T细胞共培养后B白血病细胞膜上形成了许多孔。这些结果表明,CAR-T细胞疗法可诱导靶肿瘤细胞焦亡。

2.CAR T细胞激活GSDME介导靶细胞焦亡
GSDME在CD19+ B细胞恶性肿瘤中普遍表达,GSDME的活性形式为肿瘤细胞中的CAR-T细胞诱导。在四种类型的靶细胞敲GSDME,发现GSDME缺乏废除CAR-T细胞诱导的焦亡,过表达GSDME增加靶细胞的焦亡,表明GSDME介导CAR-T细胞触发的肿瘤细胞焦亡。GSDME过表达载体转移到GSDME缺陷的肿瘤细胞中,发现GSDME重新表达恢复了CAR-T细胞诱导的细胞焦亡,突变GSDME的重新表达不能恢复焦亡。这些结果表明,CAR-T细胞可以调节GSDME诱导靶细胞焦亡。
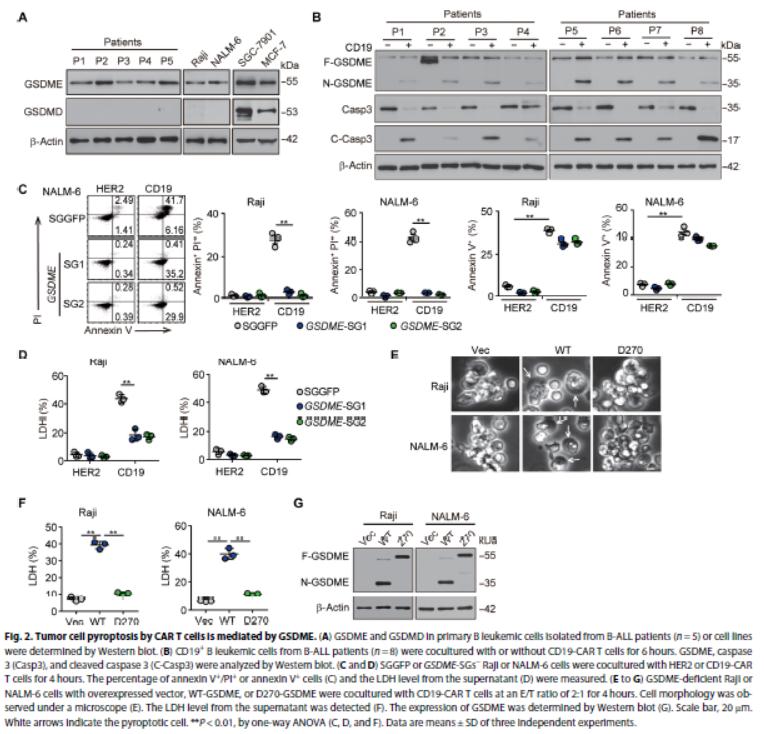
3.CAR-T细胞释放的granzyme B激活GSDME
caspase 3裂解在共同孵育的肿瘤细胞中裂解并激活,添加caspase 3抑制剂抑制GSDME裂解并预防肿瘤细胞焦亡。发现GSDME敲除并没有影响caspase 3激活,表明GSDME作用在caspases 3下游。从T细胞溶质释放的granzyme B是一种将caspase 3和caspase 7激活的效应分子。抑制CAR-T细胞中的granzyme B阻断了肿瘤细胞中caspase 3和caspase 7激活从而抑制焦亡。穿孔素孔形成允许granzyme B进入靶细胞的胞浆,穿孔素敲低阻止了caspase 3和caspase 7的激活,GSDME的裂解以及随后的焦亡。这些结果表明CAR-T细胞释放穿孔素形成孔,导致granzyme B进入靶肿瘤细胞,导致激活GSDME和细胞焦亡。

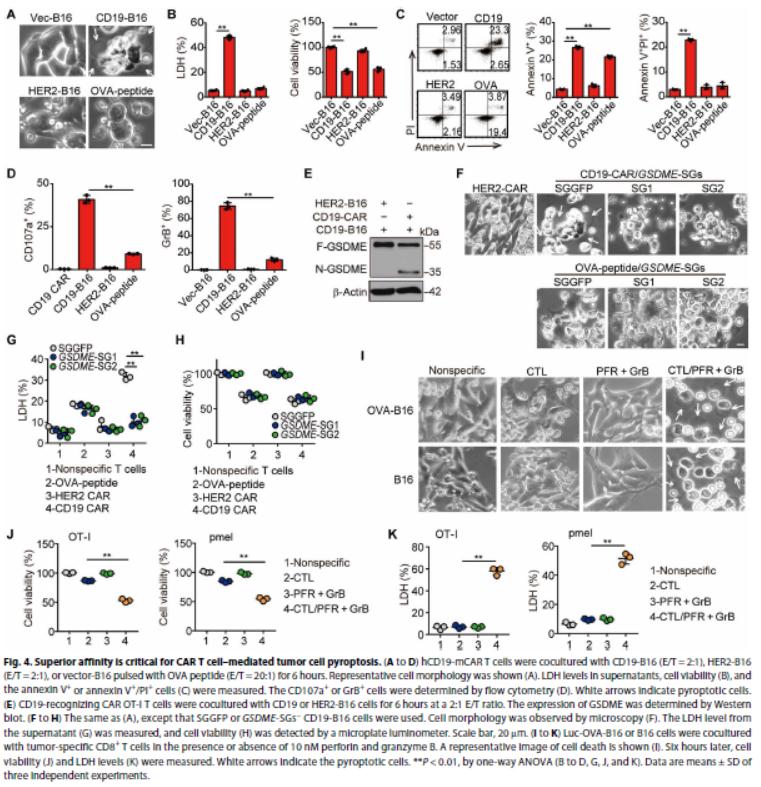
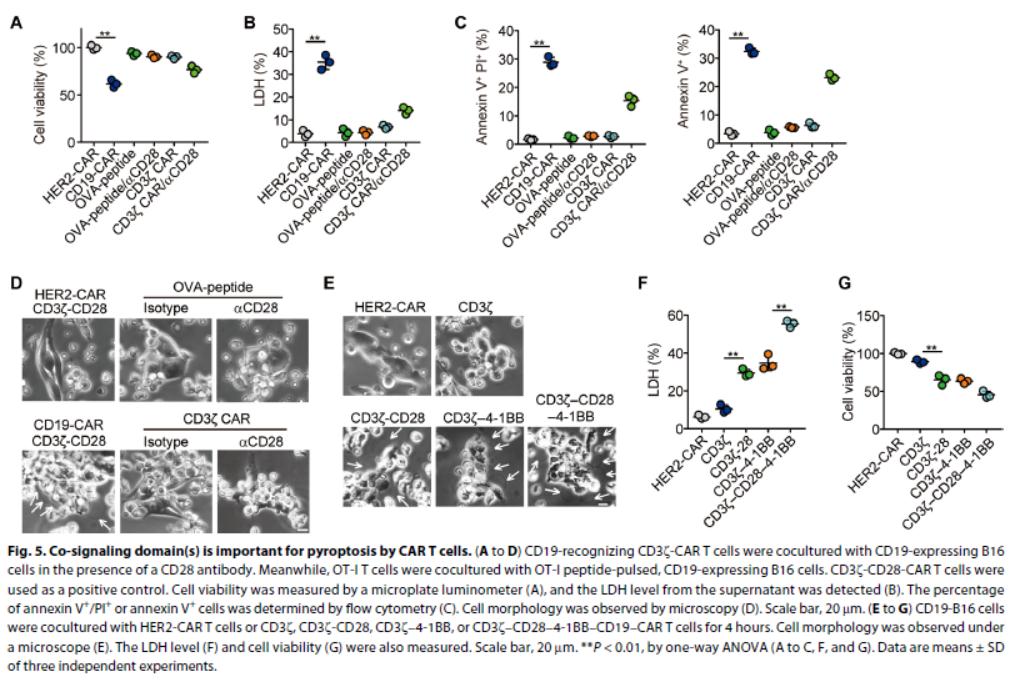
4.对靶细胞的优异亲和力对CAR-T细胞引发焦亡至关重要
构建了人类CD19识别小鼠CAR(hCD19-mCAR)和表达人CD19或人HER2的B16黑色素瘤细胞,将hCD19-mCAR T细胞与CD19-B16细胞一起孵育引起焦亡,人HER2的B16未焦亡。hCD19-mCAR T细胞与hCD19-B16细胞共培养后,释放更多穿孔素/granzyme B,引起高水平的GSDME裂解,GSDME基因敲除消除了CAR-T细胞对CD19-B16细胞的焦亡。添加穿孔素/ granzyme B进入培养基导致B16焦亡。研究CD19-CAR中的共同信号域是否调节靶细胞焦亡。CD3-CAR T细胞对减细胞影响小,不诱导肿瘤细胞焦亡,另外发现具有不同共同信号域的CD19-CAR T都鞥诱导CD19-B16细胞焦亡。这些结果表明肿瘤抗原亲和力和共同信号域赋予CAR T释放大量穿孔素/粒酶引起焦亡的能力。
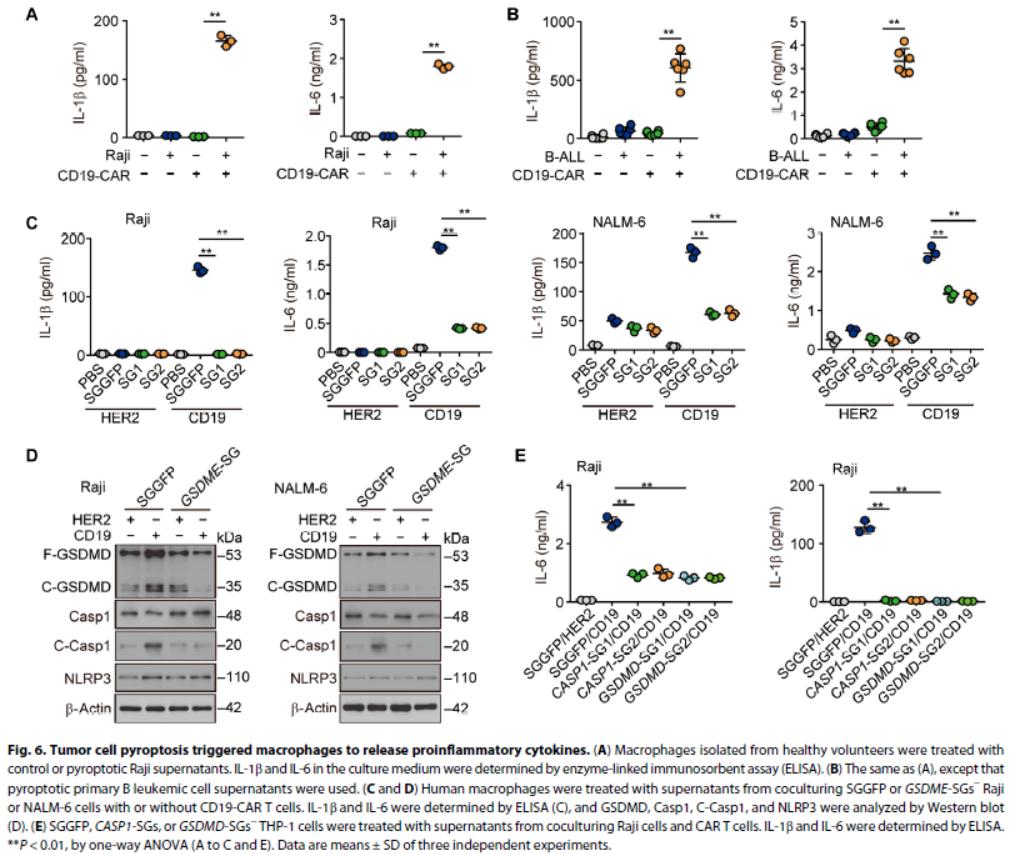
5.靶细胞焦亡刺激巨噬细胞释放CRS相关细胞因子
共培养(CD19-CAR T细胞和NALM-6,Raji或原代B白血病细胞)上清液处理健康捐献者外周血单核细胞,观察到IL-1β和IL-6释放,表明CRS可以被肿瘤细胞焦亡的产物触发。将CD19或HER2-CAR T细胞与GSDME-/-靶细胞共培养,上清液不能刺激巨噬细胞产生IL-1β或IL-6。焦亡细胞上清液能活化巨噬细胞中Caspase 1,活化GSDMD,导致IL-1β和其他促炎因子的释放,而GSDME基因敲除组上清液不能。敲低GSDMD或caspase 1消除了巨噬细胞中IL-1β和IL-6的上调。表明肿瘤细胞的焦亡激活了GSDMD介导的巨噬细胞中的炎症途径,导致释放CRS相关的细胞因子。
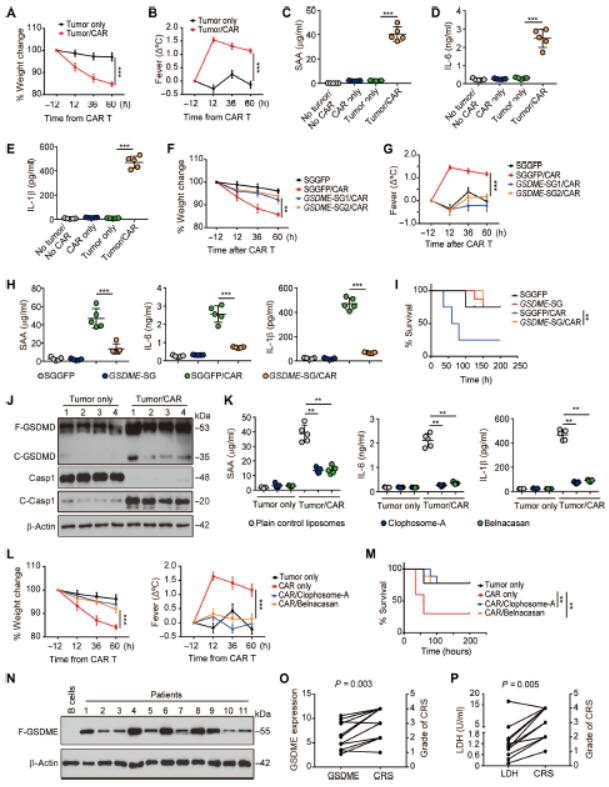
6.CAR T细胞疗法通过GSDME介导的焦亡诱导CRS
诱导CRS小鼠模型,与人类CRS非常相似的反应(高烧、体重减轻和急性蛋白如淀粉样蛋白A3、IL-1β和IL-6水平升高)。 但是,注射GSDME-/-Raji或NALM-6细胞消除了CRS症状,预防CRS相关死亡率。在接受CAR T细胞治疗的小鼠中,腹膜巨噬细胞caspase 1和GSDMD的激活,IL-1β、IL-6和SAA的上调。巨噬细胞耗竭或caspase 1抑制剂给药预防了与CAR T细胞相关的CRS。原发性B-ALL白血病细胞中普遍表达GSDME,较高水平的GSDME与更严重的的CRS相关,高CRS患者血液中LDH水平较高,LDH水平与CRS的严重程度呈正相关。这些结果表明, CAR T细胞疗法诱导B白血病细胞焦亡可触发患者的CRS。
总结:
1. CAR T细胞通过颗粒酶B/GSDME导致细胞焦亡;
2.在CAR T细胞治疗期间肿瘤细胞的焦亡可触发CRS。






