来自hUMSCs的外泌体-阿尔茨海默病的治疗
减少淀粉样蛋白β(Aβ)积累可能是阿尔茨海默病(AD)一个潜在的治疗方法。微环境赋予外泌体特殊的功能生物分子,原细胞所在的微环境可将其转移到受体细胞以改善病理条件。然而,很少有关于外泌体治疗AD的报道。在此,小编为大家介绍一篇发表于Small的文章:“The Regulatory Functionality of Exosomes Derived from hUMSCs in 3D Culture for Alzheimer’s Disease Therapy”。

3D石墨烯支架和2D石墨烯薄膜均被用作人脐带间充质干细胞(huMSCs)培养的基质,从中获得上清液来分离外泌体。3D培养的外泌体(3D-Exo)中195种miRNAs和蛋白的水平与2D培养的明显不同。因此,3D-Exo可以调控α-secretase的表达和抑制β-secretase,从而减少AD病理细胞和转基因小鼠中Aβ的产生。3D-Exo增强AD小鼠的记忆和认知功能。这些发现为干细胞来源的支架材料和功能性外泌体提供了新的临床应用。
结果:
(1)3D石墨烯支架合成及hUMSC培养
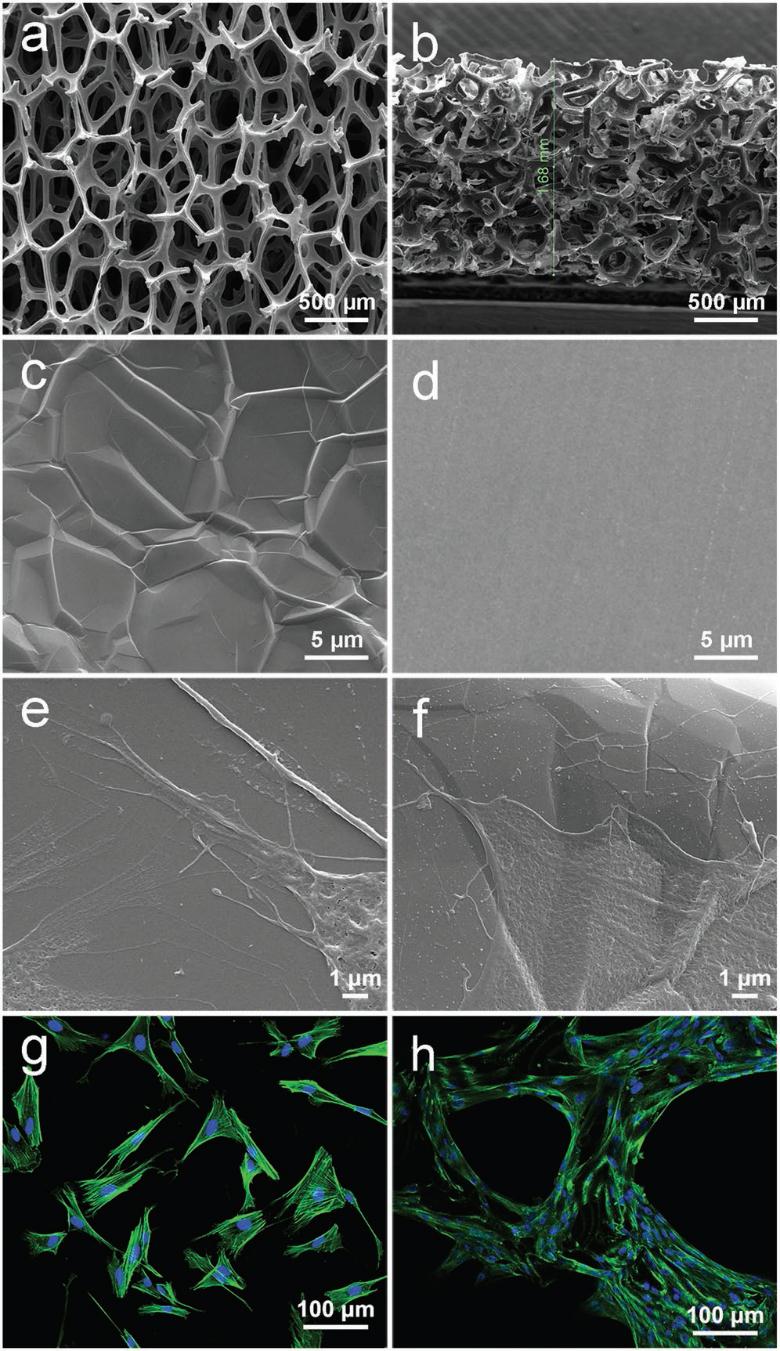
三维石墨烯支架和二维石墨烯薄膜均采用化学气相沉积法合成。扫描电镜观察结果显示,3D支架呈整体、连续、多孔结构,孔隙率为99.5%±0.2%(图1a)。三维支架的孔隙大小是100-300μm,石墨烯骨架的宽度是100-200μm。3D支架的厚度为1.68 mm(图1b),而2D膜是由3-5层碳片组成。已知石墨烯薄膜具有非生理硬度,3D支架的刚度值为30±0.55 kPa。图像显示,3D支架在微纳米尺度上具有许多波纹和褶皱(图1c),与二维膜的光滑表面形成对比(图1d)。
使用免疫荧光染色和流式细胞术培养和鉴定hUMSCs。SEM显微照片显示,广泛分布的hUMSCs与2D膜和3D支架形成了强烈的相互作用(图1e,f)。在2D膜上,hUMSCs表现出典型的扩张形态和显著的肌动蛋白丝(图1g)。相反,我们观察到细胞在3D支架上扩散,穿过相互连接的孔壁,并与邻近的细胞建立物理接触(图1h)。
(2)外泌体及其含量特征
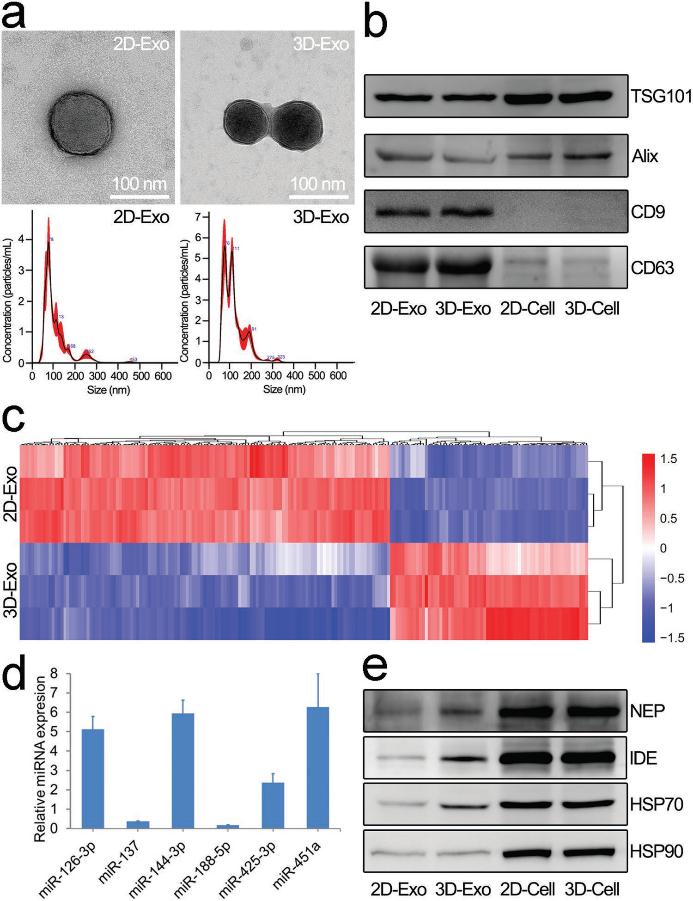
在3D支架(3D- exo)和2D薄膜(2D-Exo)上培养的hUMSCs上清液中,通过超离心的标准方法分离出外泌体。根据透射电镜和纳米颗粒跟踪分析的结果,外泌体通常由直径为50-150 nm的膜泡组成(图2a)。western blotting检测外泌体的标记物四聚体蛋白(CD9、CD63)和核内体途径蛋白(Alix和TSG101)。结果显示Alix和TSG101在外泌体中表达,而CD9和CD63同时在2D-Exo和3D-Exo中富集(图2b)。外泌体中含有丰富的miRNA,在细胞间通讯中起着重要的作用。我们使用miRNA微阵列对外体miRNA进行了表征。与2D-Exo相比,195种miRNA在3D-Exo中的表达存在差异。其中68个miRNA上调,127个miRNA下调,如图2c所示。对差异表达的miRNA进行GO分析和KEGG分析,我们推测这些3D-Exo中的miRNA对细胞行为、突触、免疫和抗氧化作用至关重要。我们确定了36种miRNA可能与AD治疗相关。我们通过real-time PCR进一步检测了miR-126-3p、miR-137、miR- 144-3p、miR-188-5p、miR-425-3p和miR-451a的水平(图2d),趋势变化与芯片一致。
此外,外泌体包含各种类型的蛋白质。本研究通过western blotting检测NEP、IDE、HSP70和HSP90的水平。结果表明,与2D-Exo相比,3D-Exo中NEP、IDE和HSP70的含量显著增加(图2e)。与此同时,两种外泌体中HSP90的表达水平无差异,且这些蛋白在hUMSCs中的表达水平无明显变化。这些结果表明,来自于hUMSCs的外泌体的miRNA和蛋白质受到3D支架培养的影响。
(3)3 D-exo减少分泌和细胞内AβAD病理细胞模型
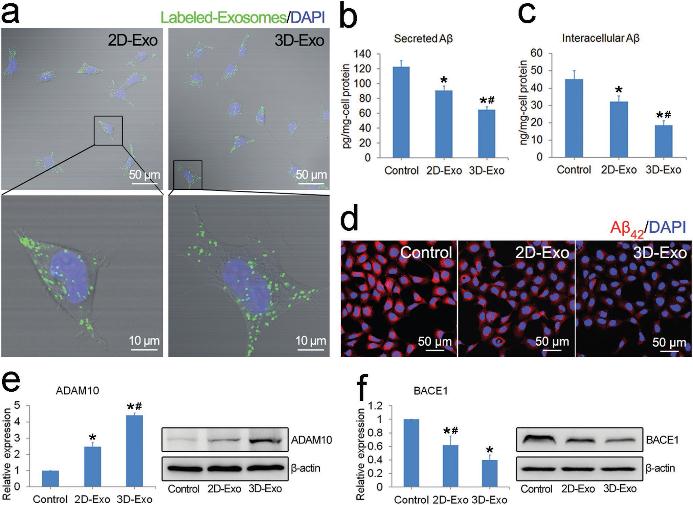
为了调查外泌体对Aβ积累减少的影响,用3D-Exo或2D-Exo处理APPswe细胞。共聚焦成像显示APPswe细胞上DiO点的荧光表明受体细胞具有较高的摄取效率(图3a)。ELISA结果显示3D-exo能更好地降低Aβ42在细胞内的积累(图3 b,3c)。此外,免疫荧光染色显示,细胞内Aβ42积累在3D-exo组显著降低(图3 d)。另外,在外泌体处理后,α-secretase ADAM10 mRNA和蛋白表达上调,β-secretase BACE1表达下调(图3e,3f)。其中,3D-Exo组的效果更明显。
(4)3D-Exo能改善APP/PS1转基因小鼠的空间学习和记忆功能
我们在9个月大的APP/ PS1转基因小鼠右海马区连续给予3D-Exo和2D-Exo 14 天。为了评估3D-Exo对AD小鼠空间学习和记忆功能的影响,外泌体给药后进行Morris水迷宫实验。结果表明,与野生型小鼠相比,生理盐水(NS)处理小鼠在空间学习和记忆方面表现出明显的缺陷。与NS组和2D组相比,3D-Exo处理的AD小鼠在第3天表现出显著的空间学习改善。第4、5天外泌体注射组小鼠的逃逸潜伏期短于NS注射组,此外,3D-Exo组在第5天的空间学习能力优于2D-Exo组(图4a)。在第6天进行空间探针测试,对小鼠的空间记忆进行评估,并在60 s内记录小鼠的运动轨迹(图4b)。令人印象深刻的是,与注射2D-Exo的小鼠相比,3D-Exo组表现出更多的平台交叉、在目标象限花费的时间和距离(图4c-e)。因此,3D-Exo在改善AD小鼠认知行为方面明显优于2D-Exo。

(5)3D-exo缓解Aβ在APP / PS1转基因小鼠的沉积
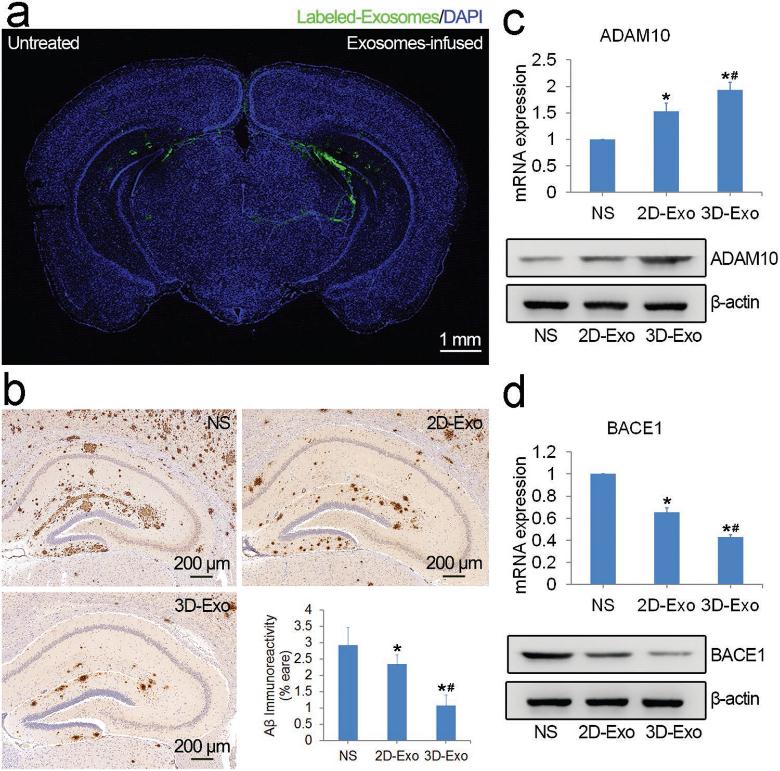
为了研究外泌体在小鼠大脑中的分布,我们将Dio标记的外泌体移植到AD小鼠右海马。荧光成像显示,外泌体广泛分布于脑实质,主要集中在右海马,而在左海马可见少量外泌体(图5a)。Morris水迷宫测试后,评价外泌体对Aβ沉积的影响。免疫组织化学染色图像显示Aβ42在外泌体处理的AD小鼠的右海马中的积累减少。Aβ42在3D外泌体处理的小鼠海马中沉积的区域更小(图5b)。接着,为了评估外泌体是否通过调节海马体内的分泌酶减少Aβ产生,ADAM10和BACE1的mRNA和蛋白表达水平被检测。RT-PCR和免疫印迹结果表明3D-Exo导致ADAM10 mRNA表达上调,BACE1表达下调(图5c,5d)。
(6)3D-Exo抑制炎症和氧化应激
我们分析了小胶质细胞的激活,这是神经炎症的标志性特征之一。小胶质细胞标记物Iba-1在AD小鼠中显著增加。注射3D-Exo可显著降低右侧海马Iba-1的mRNA表达。3D-Exo注射组Iba -1阳性小胶质细胞密度低于2D-Exo组和NS组(图6a)。此外,TNF-α和IL-1β在外泌体处理的AD小鼠海马中下调。与2D-exo组相比,TNF-α和IL-1β在3D-exo组表达水平更低(图6b,6c)。RT-PCR和免疫组化结果显示,3D-Exo处理后AD小鼠HO-1 mRNA和蛋白表达明显下降(6d)。这些数据表明,3D-exo可以更好的减轻炎症、氧化应激和减少Aβ积累。

结论:
来自3D支架培养的hUMSCs的外泌体可以减少Aβ的积累、改善APP/PS1转基因小鼠的空间学习和记忆功能。这为从3D支架上培养的hUMSCs获得的外泌体用于AD和其他疾病的治疗提供了新的治疗干预和潜在的临床应用。






