国自然热门领域之细胞缺氧
2019年诺贝尔生理学或医学奖颁发给三位发现细胞如何感知和适应氧气的科学家。近十年细胞缺氧在国自然中标数目相对较大,科研文章发表数目也很大。而且氧气参与多数生命的生命进程,氧气感受对许多疾病至关重要(图2)。例如,因为EPO表达减少,慢性肾衰竭患者经常严重贫血。EPO由肾细胞产生,对于控制红细胞产生极为重要。而且,氧气调节机制在癌症中也扮演了重要角色。在肿瘤中,氧气调节机制被用来刺激血管形成和重塑代谢,实现癌细胞的有效增殖。
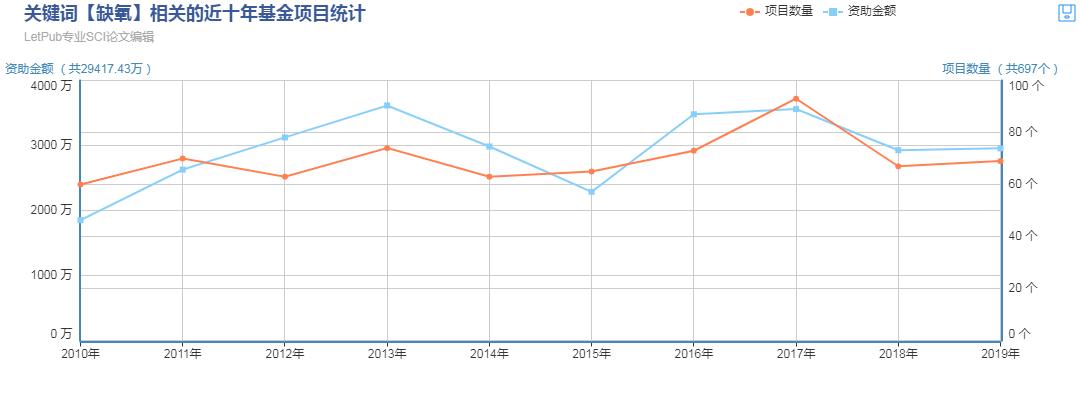
今天我们说一说缺氧通过调节肿瘤微环境在癌症治疗中的作用。文章是南京医科大学团队于2019年11月发表于Molecular Cancer期刊的一篇综述(IF=10.679),文章题名为:Role of hypoxia in cancer therapy by regulating the tumor microenvironment.

这项研究旨在从肿瘤细胞适应缺氧微环境的角度着眼于治疗耐药性的原因,特别是讨论氧调节转录因子HIF-1改变癌症对治疗剂敏感性的能力。也就是概述缺氧和HIF对抗癌药耐药性的影响,强调在HIF介导的治疗失败中,HIF与细胞凋亡,自噬,DNA损伤,线粒体活性和p53的多方面相互作用。提供对缺氧介导的分子信号传导途径的全面理解,并为癌症治疗提供新的视野。
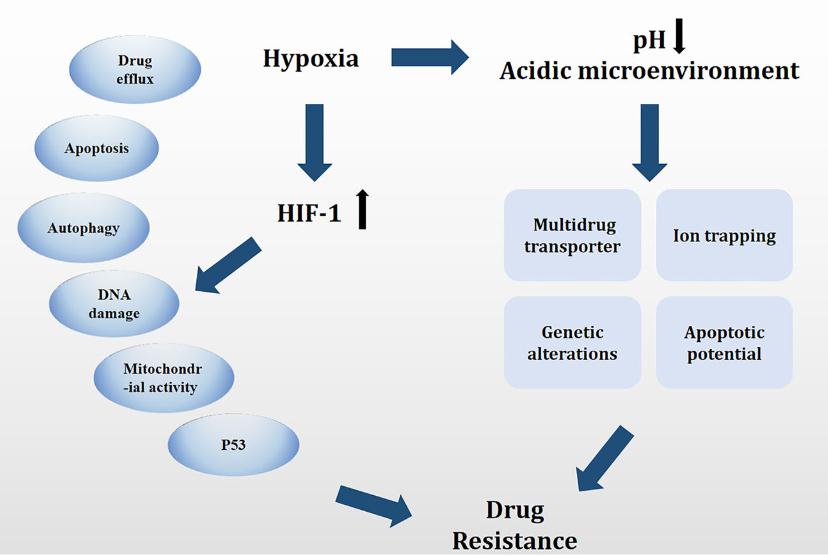
缺氧可以说是癌症最吸引人的治疗靶点之一。针对缺氧肿瘤细胞,人们提出了多种靶向途径,包括缺氧激活前体药物、基因治疗和HIFs的特异性靶向,或是对缺氧细胞有重要作用的靶向途径,如mTOR和UPR途径。另外,由于肿瘤组织与正常组织相比pH值较低,因此该特征可用于靶向酸诱导肿瘤。
前药是一种无活性的化合物,可以自发地或通过特定的代谢途径转化为药理活性物质。设计一种在缺氧组织中激活的缺氧前药,以利用缺氧肿瘤的特征选择性地杀死缺氧肿瘤细胞。 缺氧前药被细胞还原酶激活,再氧化为缺氧细胞中的初始药物祖先,并转化为细胞毒性物质。 最近发表的关于低氧祖细胞TH-302联合吉西他滨治疗胰腺癌或阿霉素治疗软组织肉瘤的II期临床试验结果令人鼓舞。 临床前研究已显示另一种Mitomycin C衍生物前药吡喹酮(EO9)的功效。 因此,对于接受膀胱癌手术的患者,推荐使用局部吡喹酮作为辅助治疗。另一种策略是靶向和调节实体瘤中的HIF-1α,以克服对缺氧的抵抗力。 例如,低氧策略可以针对下游HIF信号通路。 靶向VEGF(贝伐单抗)的单克隆抗体或靶向VEGF受体的小分子抑制剂已经获得了晚期癌症的临床益处。 抑制HIF对缺氧的反应的方法包括siRNA处理,阻断HIF-1α和β亚基的二聚化以及使用已知抑制PI3K / AKT /HIF-1α途径的抗癌剂直接抑制HIF-1α。 此外,触发HIF-1α降解途径激活的药物有可能清除缺氧肿瘤中过表达的HIF-1α。 雷帕霉素处理低氧细胞导致HIF-1α降解,导致肺癌细胞对survivin表达的抑制作用和细胞凋亡增加。
癌细胞具有较高水平的活性氧和过表达的抗氧化酶。因此,清除参与抗氧化防御的酶会导致更高的氧化应激,从而导致抵抗细胞死亡。ROS调节剂通过这种作用原理在克服癌细胞MDR方面是有效的。此外,靶向酸诱导肿瘤可以提高肿瘤治疗的特异性。近年来,质子泵抑制剂(PPIs)在处理酸性环境中的应用越来越广泛。研究表明,PPIs能以酸依赖的方式增加顺铂细胞的摄取,并增强细胞毒药物在卵巢上皮癌化疗耐药中的作用。针对酸性微环境的干预策略和新的联合治疗策略可能是未来的研究方向。
临床研究表明,肿瘤缺氧性微环境中的成分与患者预后不良有关,并且可以通过许多与免疫疗法,化学疗法或放射疗法失败有关的信号通路促进凋亡和自噬或抑制DNA损伤和线粒体活性。特别是在晚期转移性癌症中,建立一个低氧环境,这在癌症的发展中起着重要作用。 进一步的研究证明,HIF-1α参与了低氧诱导的治疗耐药性,其敲低可以逆转耐药性。因此,推测肿瘤缺氧环境生态的选择压力可能影响肿瘤细胞的进化。HIF-1通过糖酵解关键酶和LDH-A促进糖酵解和乳酸生成,从而抑制PEP进入TCA循环。此外,HIF-1靶基因PDK1通过灭活PDH直接抑制PEP向线粒体的迁移。越来越多的研究表明,HIF-1可以诱导线粒体自噬并抑制线粒体的生物合成以抑制细胞死亡,最终导致HIF-1介导的耐药性。 低氧诱导的肿瘤酸性微环境对化疗耐药有重要意义,在某些情况下,可促进EMT和干细胞样表型的形成。V-ATPase、NHE、MCT等调节肿瘤酸性微环境的主要因子也为肿瘤治疗提供了靶点。因此,了解这些分子的调节对于鉴定潜在的治疗靶点很重要。更好地了解肿瘤进展过程中低氧环境中的途径可能有助于癌症免疫治疗研究的突破,并为临床试验提供理论基础,以帮助改善治疗效果。
有兴趣的话大家可以去看一下,好了今天就看到这,下回带大家看点别的,再见!






