肠道菌群——国自然研究又一热点
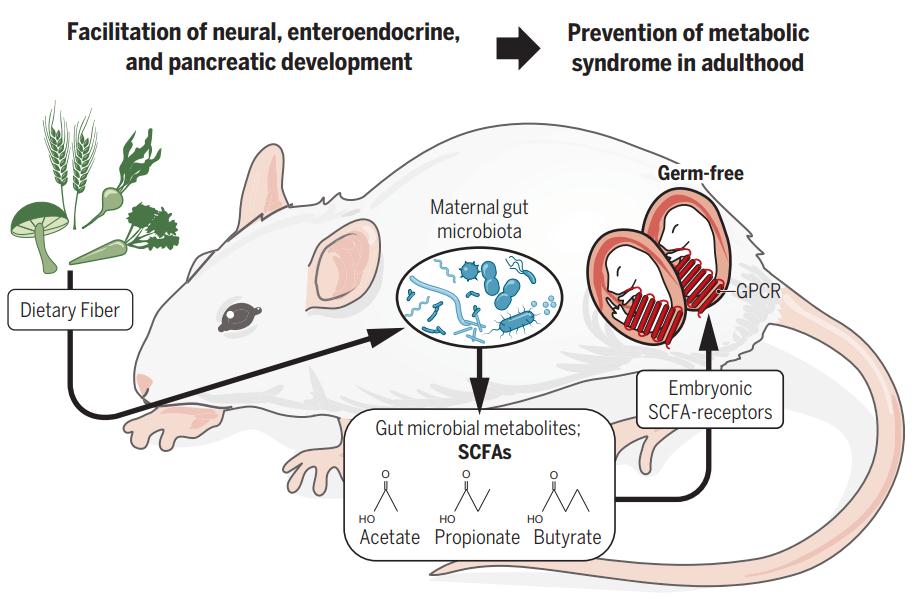
肠道菌群作为寄居在人体肠道内的微生物群落,是近年来微生物学、医学、基因学等领域最引人关注的研究焦点之一。随着抗生素的迅速使用和高热量、低纤维饮食的摄入导致肠道微生物群落紊乱,使人类易患代谢综合征等多种疾病。虽然已有大量的研究致力于微生物群对个体出生后的环境影响,但是作者对于胚胎期肠道微生物群的作用却知之甚少。然而,2020年2月28日,日本东京农工大学Ikuo Kimura、庆应大学Koji Hase等研究人员在science上在线发表了题为“Maternal gut microbiota in pregnanc influences offspring metabolic phenotype in mice“的研究性论文,该研究发现了孕期母体微生物群对后代的肥胖具有抵抗力,进一步揭示了妊娠期间母体肠道环境影响后代代谢的具体机制。

结果一、GF母亲的后代与肥胖症的发展
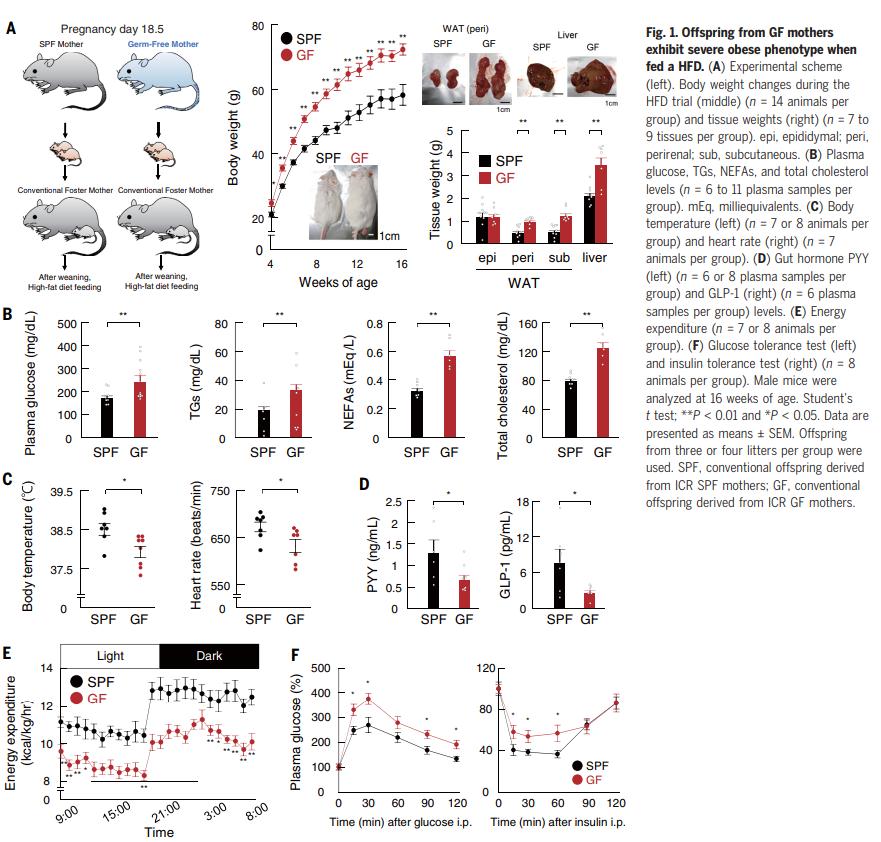
为了研究怀孕期间母体肠道菌群对后代的影响,在SPF和GF条件下繁殖了怀孕的小鼠。在妊娠的第18.5天,怀孕的GF小鼠从相应菌株的SPF小鼠接受了粪便微生物菌群移植,以防止不利微生物过度生长。寄养母亲在常规条件下饲养新生动物,以适应出生后的生长环境。断奶后,给雄性小鼠喂食高脂饮食(HFD)以诱导肥胖(图1A)。结果表明,GFD后代在HFD喂养后表现出肥胖表型。为了支持这种解释,GF后代中HFD诱导的葡萄糖耐量和胰岛素抵抗显着加速,表明胰岛素敏感性受损。因此,或多或少地普遍观察到GF后代的代谢紊乱,而与菌株和性别无关。
结果二、感知胚胎中的母体SCFA
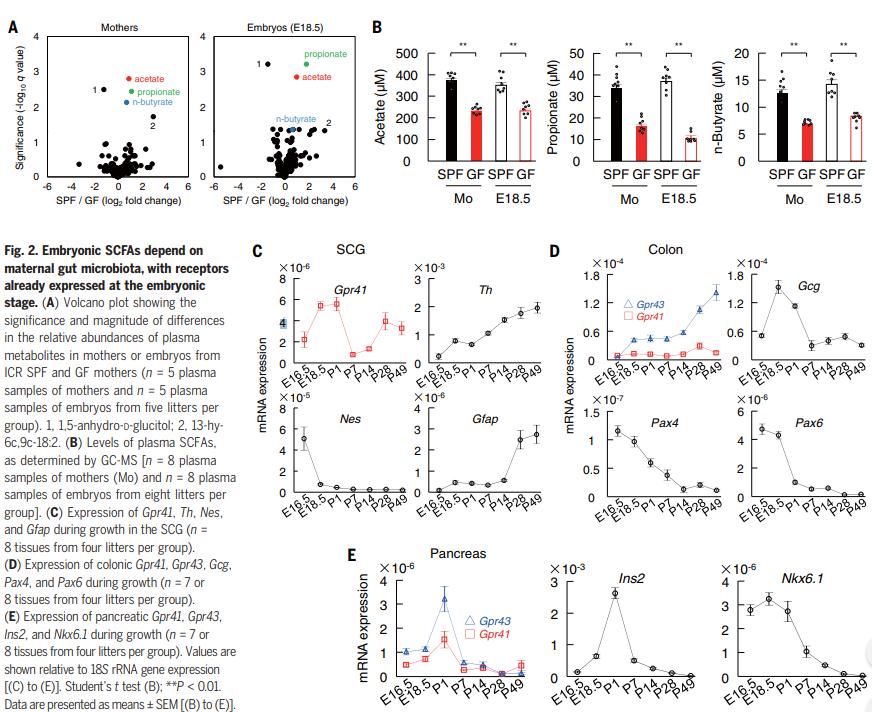
作者在小鼠怀孕期间分析了SPF和GF ICR母亲及其胚胎中亲水和亲脂代谢产物的血浆水平,只有5种代谢物对繁殖条件的反应在母体和胚胎中表现出相似的变化(图2A)。特别是,GF母亲和胚胎的血浆SCFA水平显着低于SPF对应物(图2B)。作者在胚胎交感神经节中检测到Gpr41 mRNA(图2C)在胚胎和成年阶段具有双相表达(图2C)。结果表明,胚性代谢组织,如交感神经系统,肠道和胰腺,可能通过表达GPR41和GPR43来感知母体肠道微生物衍生的SCFA。
结果三、通过GPR41进行同情发展
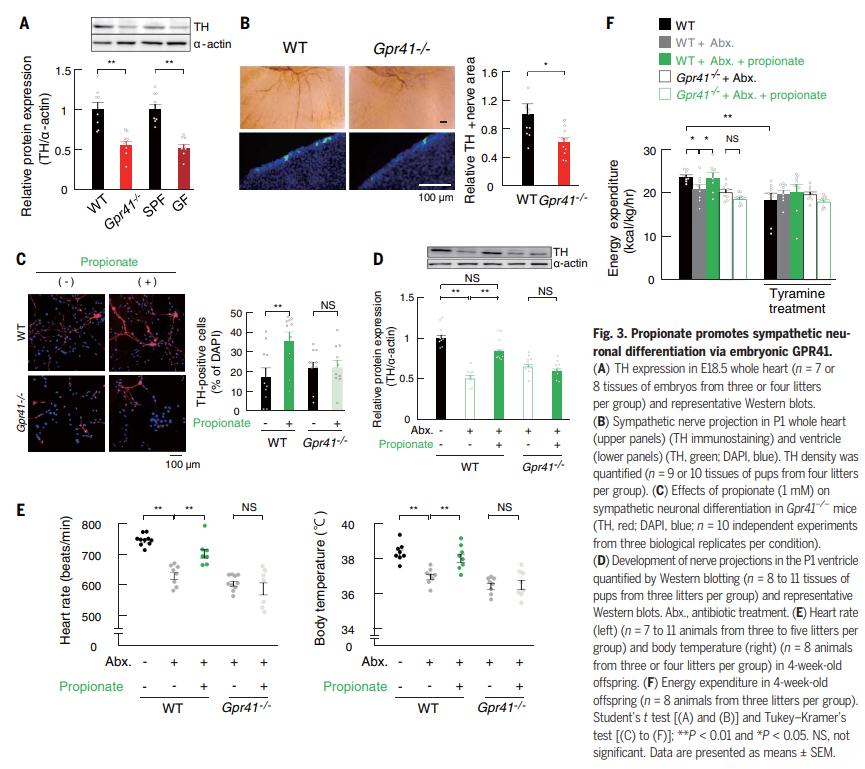
作者进一步研究了GPR41在交感神经系统中的功能以及GPR43在肠道和胰腺胚胎发育过程中的功能。作者发现与野生型(WT)胚胎相比,Gpr41-/-C57BL / 6J胚胎在心脏的交感神经投射明显减少,并且在具有相同背景的GF胚胎中这种异常也很明显(图3A) 。此外,在出生后第1天(P1),Gpr41-/-幼崽向心脏的交感神经投射明显减少,即使这些幼崽是从SPF条件下维持的母亲分娩的(图3B)。propionic acid诱导的交感神经元分化在来自Gpr41-/-胚胎的交感神经细胞中被消除(图3C)。这些发现强烈表明propionic acid介导的GPR41活化促进交感神经元分化。为了验证这一观点,作者用抗生素混合物处理了WT怀孕小鼠,以消除肠道菌群。在P1上,经抗生素处理的小鼠的幼崽向心脏的交感神经投射明显减弱。值得注意的是,在怀孕期间服用propionic acid可改善这种异常(图3D)。断奶后的心律和体温是交感神经投射的指标,与耗氧量相似(图3,E和F)。用酪胺治疗显着降低了未经治疗或经propionic acid或抗生素治疗的WT母亲的后代的耗氧量,而这些影响在经过抗生素治疗的WT母亲或未经治疗的Gpr41-/-母亲的后代中减弱了(图3F)。基于这些观察,作者认为来自母体肠道菌群的propionic acid可通过GPR41促进交感神经的发育,如在GF的后代中观察到的,propionic acid的缺乏导致交感神经功能障碍,包括体温和心率波动的降低。
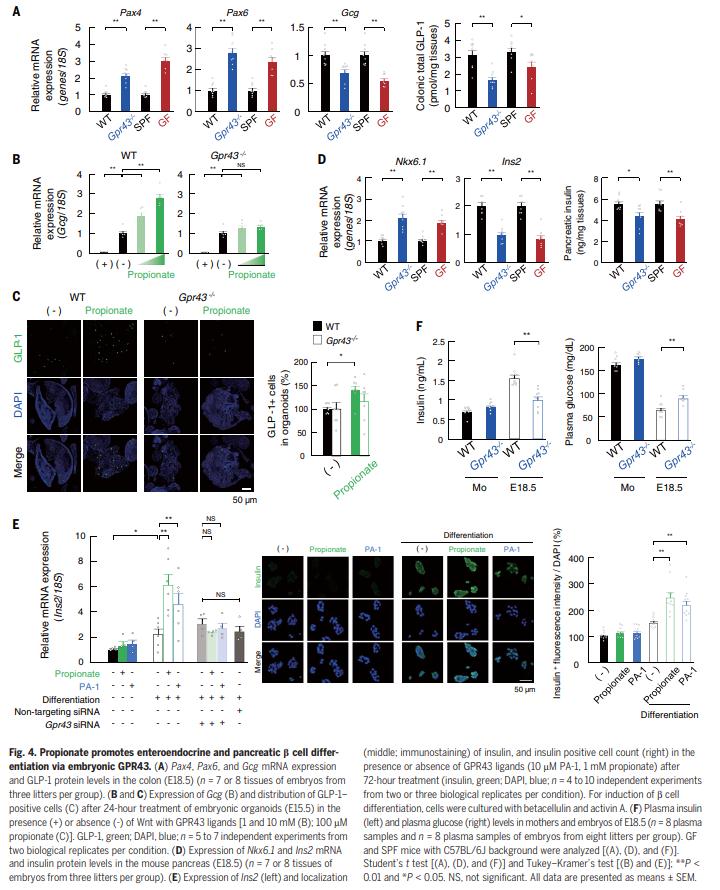
结果四、通过GPR43调节胚胎胰岛素
作者研究了GPR43在胚胎期对肠内分泌细胞分化的影响。与WT胚胎相比,Gpr43-/-C57BL / 6J胚胎的结肠中Pax4和Pax6明显上调(图4A)。PMP是一种比乙酸酯或butyrate更有效的GPR43配体(EC50:〜30 mM)可显着促进WT小肠类器官中GLP-1 +肠内分泌细胞的分化。胚胎(图4,B和C),这种作用在来自Gpr43-/-胚胎的类器官中消失了(图4,B和C)。与WT和SPF小鼠相比,Gpr43-/-和GF小鼠胚胎的胰腺中Nkx6.1明显上调,而Gpr43-/-和GF小鼠的Ins2表达和胰岛素水平下调(图4D)。尽管WT和Gpr43-/-母亲之间没有差异,但Gpr43-/-胚胎中的血浆胰岛素水平明显低于WT胚胎(图4F)。作者推测在产前期缺乏SCFA-GPR43信号转导会导致成年期代谢综合征,最可能的原因是能量消耗降低胚胎体内的稳态。
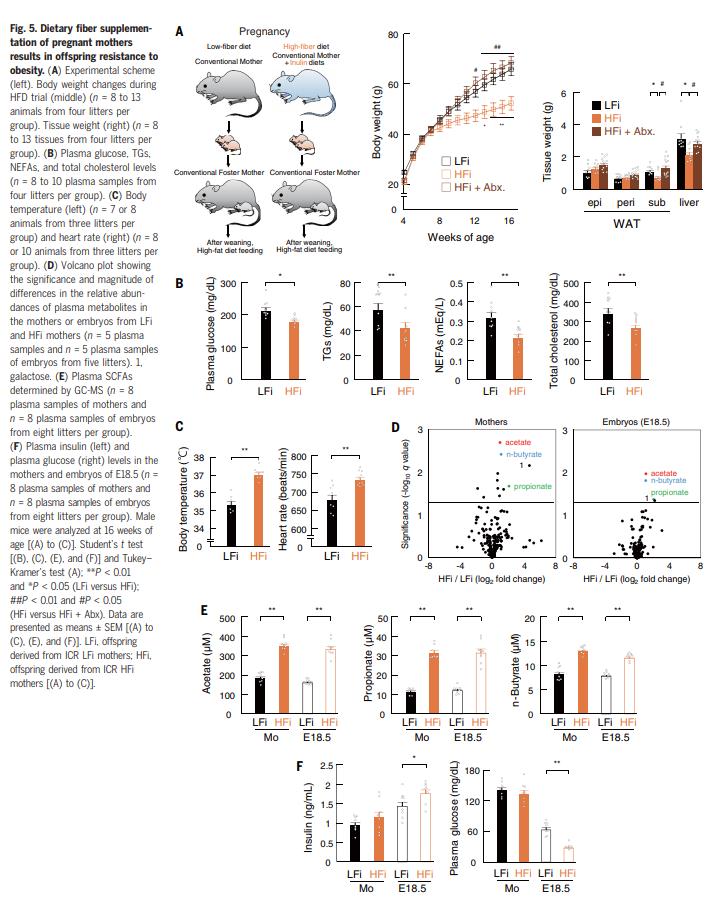
结果五、怀孕期间的膳食纤维摄入量
为了提供SCFA在肥胖抵抗力发展起源中的重要性的进一步证据,作者进行了一项饮食干预研究,在该饮食干预研究中,对怀孕的ICR小鼠在常规条件下饲喂高纤维(HFi)或低纤维(LFi)饮食检查了他们的后代对肥胖的易感性(图5A)。结果表明膳食纤维的微生物发酵有助于抑制肥胖。与LFi后代相比,HFi后代的血浆代谢参数也得到了改善(图5B)。在HFi后代中,LFi后代的交感神经功能障碍,例如体温降低和心率波动降低,得到改善(图5C)。而由PMP喂养的母亲及其胚胎中通常有4种代谢物增加(图5D)。在这4种代谢产物中,SCFA是SPF与GF和LFi与HFi的比较中唯一的共同因素。用PMP喂养的小鼠的胚胎(HFi胚胎)中的SCFA水平显着高于使用LFi喂养的小鼠的胚胎(LFi胚胎)(图5E)。作者还观察到,HFi胚胎中的血浆胰岛素水平显着高于LFi胚胎(图5F),因此HFi胚胎中的血浆葡萄糖水平显着降低(图5F)。因此,由母体肠道菌群通过膳食纤维的发酵产生的SCFA通过母体循环提供给胚胎,从而改善胎儿的葡萄糖稳态,并赋予后代抵抗肥胖的能力。
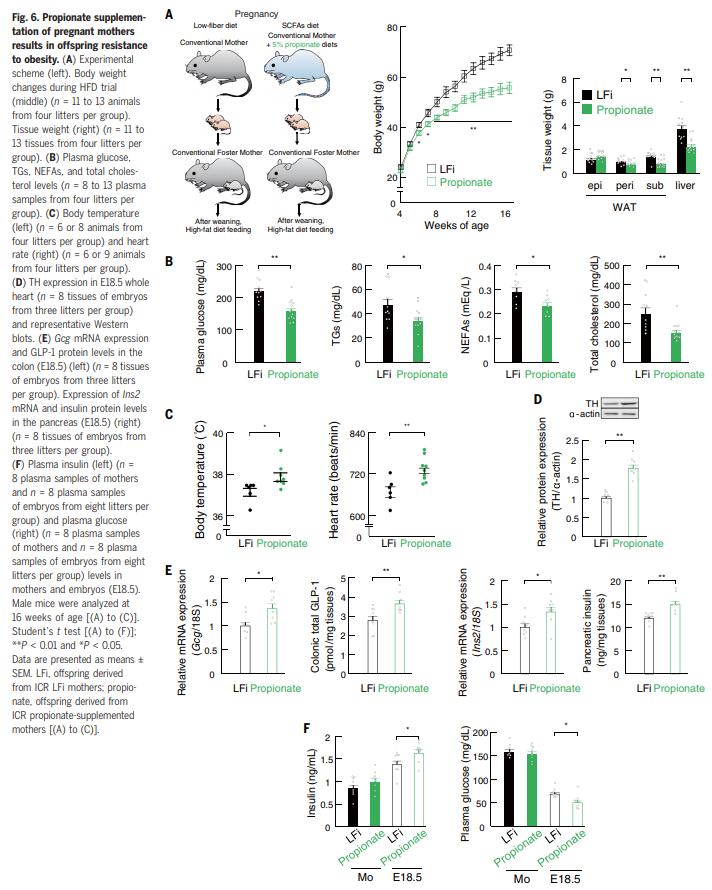
结果六、怀孕期间补充SCFA
考虑到测定值优于其EC50值,HFi胚胎中的血浆propionic acid水平可能足以激活GPR41和/或GPR43受体(图5E)。因此,为了严格检验PMP在后代肥胖抵抗中的作用,作者给怀孕的ICR小鼠喂食了补充PMP的LFi饮食(图6A)。PMP治疗可抑制HFD诱导的成年后代体重,肾周或皮下WAT量以及肝脏重量的增加(图6A)。与对照LFi后代相比,经propionic acid处理的母亲(Pro后代)的血浆代谢参数也得到了改善(图6B)。此外,在Pro后代中挽救了LFi后代的交感神经功能障碍(图6C)。此外,产妇用PMP干预可逆转由LFi喂养的母亲的胚胎中向心神经投射的延迟以及GLP-1 +肠内分泌细胞和胰腺b细胞分化的延迟(图6,D和E);它也增强了胚胎中的血浆胰岛素水平,使其恢复到与HFi胚胎相当的水平(图6F)。因此,在给予propionic acid的母亲的胚胎中,对照胚胎中的血浆葡萄糖水平的增加被有效地抑制了(图6F)。结果表明,母体PMP的重要性,这使得后代对肥胖具有抵抗力。
结论:
在妊娠期间,母体肠道菌群通过SCFAGPR41和SCFA-GPR43轴赋予了后代肥胖抵抗力。 怀孕期间,交感神经、肠道和胰腺中的GPR41和GPR43感测到来自母体肠道菌群的SCFA,影响了产前代谢和神经系统的发育。 这些发现表明,怀孕期间的母体肠道环境是防止后代代谢综合征的新陈代谢程序的关键因素。 因此,怀孕小鼠的肠道菌群提供了一种环境提示,可微调子代的能量稳态,从而防止代谢综合征的发展。






