CircRNA-ZBTB44与脉络膜新生血管的形成
脉络膜新生血管(CNV)是严重视力丧失的主要原因,在许多眼部疾病中都有发生,尤其是新生血管年龄相关性黄斑变性(nAMD)。环状RNAs(circRNAs)是一类新的内源性非编码RNA,参与了糖尿病和癌症内皮细胞功能障碍的调节。今天小编带大家了解最新发表于杂志“Theranostics”上的文章“Circular RNA-ZBTB44 regulates the development of choroidal neovascularization”。本研究旨在探讨circRNA-ZBTB44(cZBTB44)在CNV发病中的作用。

在本研究中,我们采用定量聚合酶链反应检测CNV发生过程中cZBTB44的表达。采用体外分离蛋白B4染色、HE染色和脉络膜发芽试验,探讨cZBTB44在CNV发生发展中的作用。另外,通过体外内皮细胞增殖、迁移和成管实验,探讨cZBTB44在血管生成中的作用。通过生物信息学分析、RNA免疫沉淀分析、荧光素酶分析和体外研究,探讨cZBTB44介导CNV发生的机制。
结果:
1.cZBTB44在激光诱导CNV损伤和缺氧应激内皮细胞中的表达上调
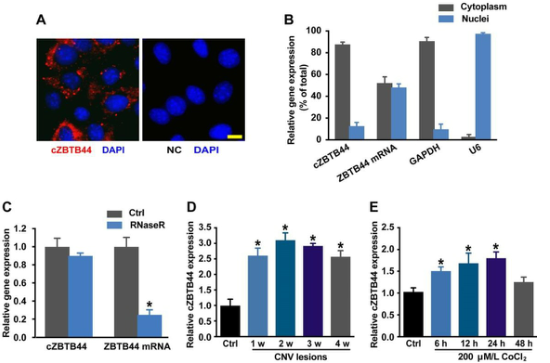
我们首先通过荧光原位杂交(FISH)和qRT-PCR检测cZBTB44是否在脉络膜视网膜内皮细胞(RF/6A)中表达。结果表明,cZBTB44主要在RF/6A细胞的细胞质中表达(图1A-B)。然后,我们通过用RNase R处理来自RF/6A细胞的总RNA来评估cZBTB44的稳定性。结果显示cZBTB44对RNase R消化具有抗性,而线性ZBTB44的mRNA很容易降解(图1C)。我们利用激光光凝技术建立了小鼠CNV模型,并测定了cZBTB44在激光诱导的体内CNV膜中的表达是否发生了改变。qRT-PCR检测显示,CNV病变中cZBTB44的表达明显高于对照脉络膜(图1D)。缺氧被认为是CNV形成的重要驱动因素。将RF/6A细胞置于含CoCl2的培养基中模拟缺氧条件。我们观察到,CoCl2治疗导致cZBTB44表达以时间依赖的方式增加(图1E)。
2.cZBTB44调节CNV在体内的发育
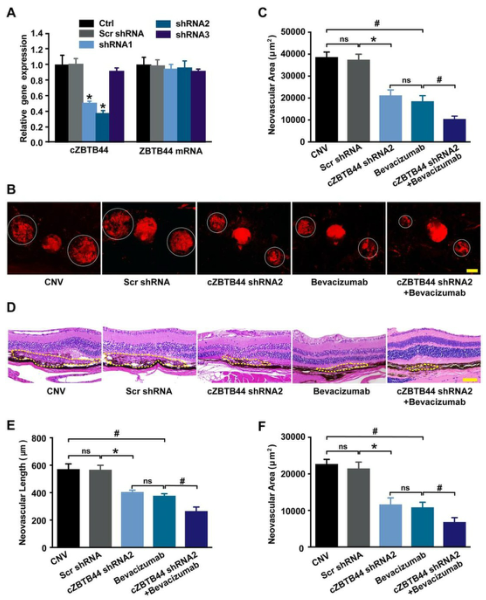
我们设计了三种不同的短发夹RNA(shRNAs)来沉默cZBTB44的表达。两种shRNA可显著降低小鼠脉络膜cZBTB44的表达(图2A)。我们选择shRNA2是因为它具有更高的消声效率。为探讨cZBTB44在激光诱导CNV中的作用,采用玻璃体腔注射cZBTB44-shRNA2。用免疫荧光法检测脉络膜平坦区新生血管面积。结果表明,cZBTB44沉默导致激光诱导的CNV小鼠模型CNV损伤面积减少,与贝伐单抗、阿非贝西普等抗VEGF药物对CNV的抑制作用相似。此外,cZBTB44沉默联合抗血管内皮生长因子药物比其单独作用更有效地抑制CNV的形成(图2B-C)。同样,HE染色分析显示cZBTB44沉默导致CNV病变长度和面积减少(图2D-F)。这些结果表明cZBTB44参与了CNV的体内形成。
3.cZBTB44在体外调节CNV的发育
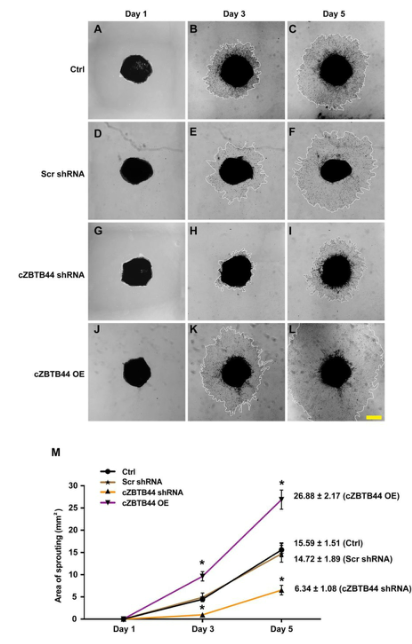
我们利用体外模型进一步研究了cZBTB44在脉络膜血管生成活性中的作用。实验分为4组:cZBTB44沉默组、cZBTB44高表达组、shRNA干扰组和未处理组。在第1天、第3天和第5天,对这些外植体的脉络膜毛细血管发芽区域进行了拍照。cZBTB44沉默导致发芽面积减少(图3A-I)。相比之下,cZBTB44的过表达导致了更大的血管萌生区域(图3J-L)。脉络膜萌动区的定量结果如图3所示。总之,上述结果表明cZBTB44参与了体外模型中CNV的调节。
4.cZBTB44在体外调节内皮细胞功能
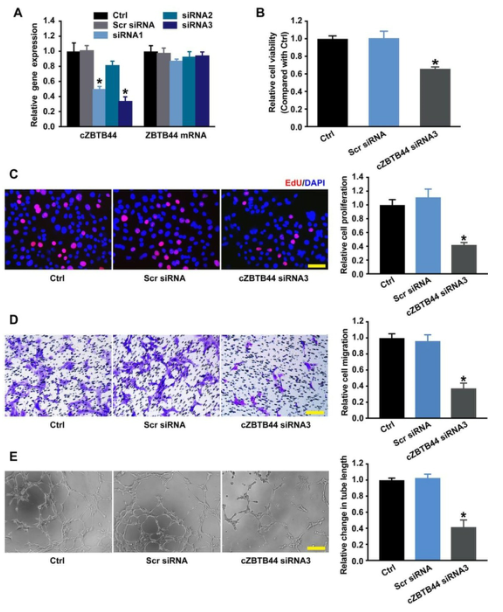
内皮细胞被认为是眼部新生血管疾病的主要参与者。因此,我们研究了cZBTB44在体外内皮细胞中的作用。我们设计了三种不同的siRNAs用于cZBTB44沉默。siRNA1和siRNA3转染均能显著降低cZBTB44的表达(图4A)。在基础条件和缺氧条件下,我们检测了cZBTB44沉默对RF/6A细胞功能的影响。siRNA3沉默cZBTB44导致细胞活力降低(图4B),增殖减少(图4C),细胞迁移和试管形成减慢(图4D-E)。
5.cZBTB44作为miRNA海绵调节内皮细胞功能
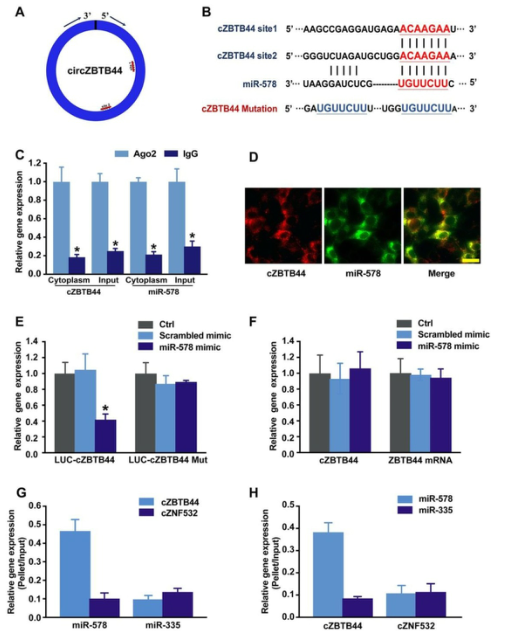
cZBTB44主要表达于RF/6A细胞的胞浆中。我们推测cZBTB44可能通过充当miRNA海绵来调节基因表达。环状RNA相互作用体数据库和序列分析表明,cZBTB44中miR-578有两个潜在的结合位点(图5A-B)。成熟miRNA的功能链被Ago2组装成RNA介导的沉默复合物RISC,从而引导RISC沉默靶mRNA。我们采用RNA免疫沉淀(RIP)分析表明,与对照组相比,cZBTB44富含含Ago2的免疫沉淀,即免疫球蛋白G(IgG)免疫沉淀(图5C)。miR-578在含ago2的免疫沉淀物中的表达水平明显高于IgG免疫沉淀物(图5C)。这些结果也提示cZBTB44和miR-578主要定位于RF/6A细胞的胞浆中。RNA-FISH也证实了cZBTB44和miR-578之间的共同定位(图5D)。接下来我们将cZBTB44序列插入荧光素酶报告子(LUC-cZBTB44)的下游。miR-578模拟转染降低了LUC-cZBTB44的荧光素酶活性,但对LUC-cZBTB44突变体的荧光素酶活性没有影响(图5E)。miR-578模拟转染不影响cZBTB44和ZBTB44 mRNA的表达水平(图5F),表明miR-578对cZBTB44和ZBTB44 mRNA的降解没有影响。使用生物素偶联的miR-578,我们观察到与阴性对照组(生物素化miR-335)相比,miR-578捕获组分中cZBTB44的富集程度更高(图5G)。我们还观察到,与阴性对照组(生物素化cZNF532)相比,cZBTB44捕获组分中miR-578的富集程度更高(图5H)。上述结果提示cZBTB44可作为miR-578在内皮细胞中的海绵。
6.cZBTB44/miR-578相互作用参与内皮细胞功能的调节
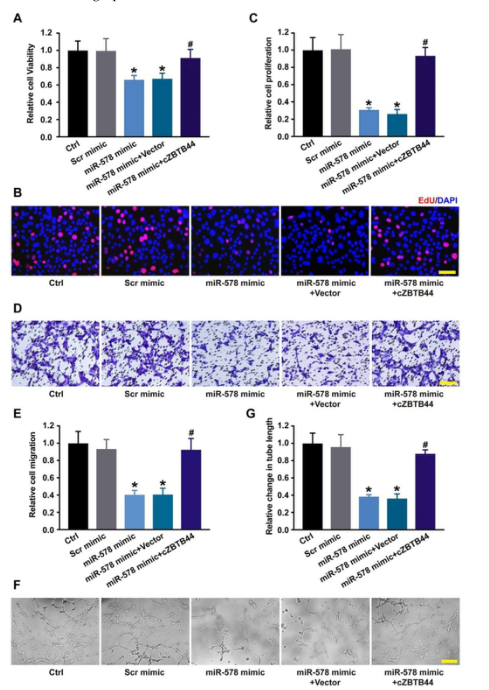
由于miR-578被cZBTB44诱导,我们研究了miR-578在调节RF/6A细胞功能中的作用。miR-578模拟转染降低了RF/6A细胞的增殖、迁移和成管能力,而cZBTB44过表达可以挽救miR-578模拟转染对RF/6A细胞功能的影响(图6A-G)。结果提示,cZBTB44/miR-578的相互作用参与了内皮细胞功能的调控。
7.cZBTB44/miR-578相互作用参与CNV的发育调控
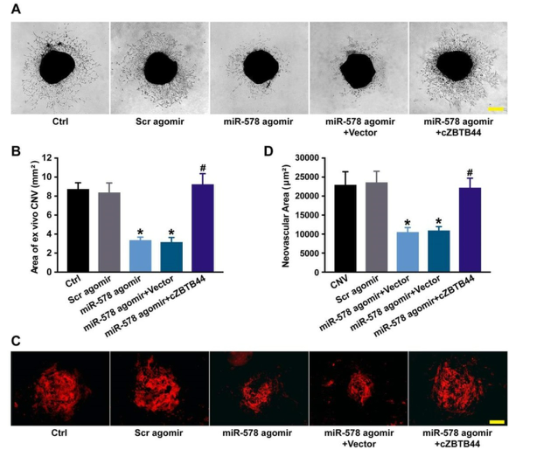
我们研究了miR-578在CNV发生发展中的作用。agomir注射上调miR-578可能模拟cZBTB44沉默对CNV形成的影响,显示出明显的体内外抗血管生成活性(图7A-D)。我们进一步探讨了外源cZBTB44的加入是否能抑制miR-578的抑制作用。结果表明,外源cZBTB44可以阻断miR-578在CNV中的调节(图7A-D)。因此,我们认为cZBTB44/miR-578相互作用参与了CNV的发育调控。
8.cZBTB44-miR-578-VEGFA/VCAM1网络调节内皮血管生成作用
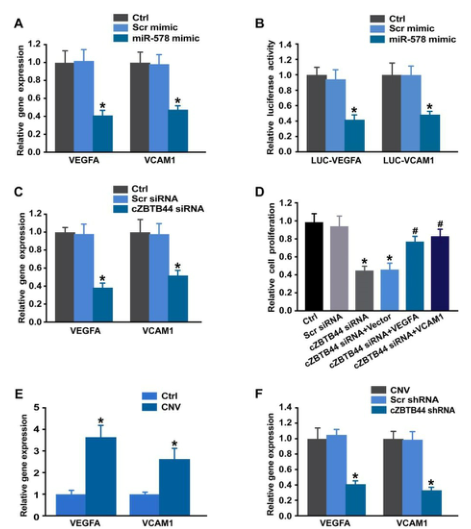
我们利用Targetscan数据库预测miR-578的靶基因。miR-578模拟转染显著抑制了RF/6A细胞中VEGFA和VCAM1的表达(图8A)。随后,用荧光素酶报告法验证miR-578对其血管生成靶点的直接调控。miR-578模拟转染降低了含有VEGFA和VCAM1靶序列的报告构建物的荧光素酶活性(图8B)。这些结果表明miR-578是VEGFA和VCAM1在RF/6A细胞中的直接调节因子。我们还发现cZBTB44沉默显著降低了VEGF和VCAM1的表达(图8C)。进一步的功能分析显示,VEGFA和VCAM1的过度表达可以部分缓解cZBTB44沉默对RF/6A细胞增殖、迁移和管形成的抑制作用(图8D)。在激光诱导的CNV中,VEGFA和VCAM1的表达显著上调(图8E)。cZBTB44沉默显著降低了VEGFA和VCAM1的表达(图8F)。因此我们认为cZBTB44-miR-578-VEGFA/VCAM1串扰参与了内皮细胞功能的调节。
9.cZBTB44在CNV患者中的临床意义
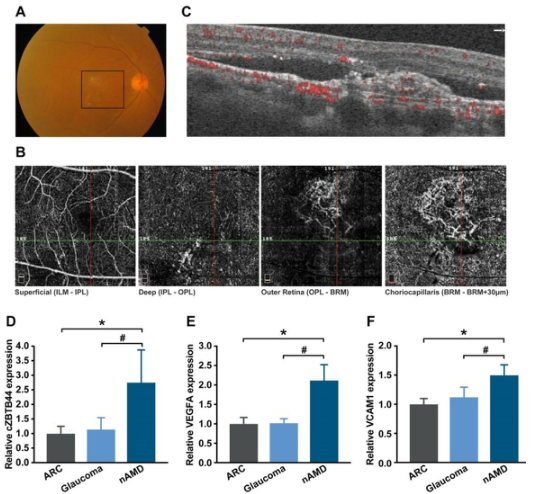
我们采用qRT-PCR方法检测了nAMD患者房水(AH)和血浆中cZBTB44的表达水平。AH,眼内的一种重要体液,被认为与许多眼部疾病有关。眼底照片显示nAMD患者有灰黄色新形成的脉络膜血管,伴有视网膜下出血和视网膜内液体(图9A)。光学相干断层血管造影(OCTA)显示黄斑部有一个异常的新生血管网,主要分布在外视网膜和脉络膜毛细血管(图9B-C)。nAMD患者的AH中cZBTB44、VEGFA和VCAM1的表达显著上调,而年龄相关性白内障(ARC)和青光眼患者的AH没有增加(图9D-F)。总之,这些结果提示cZBTB44可能参与了新血管性AMD的发病机制。
结论:
这项研究揭示了cZBTB44在CNV发展中的作用。cZBTB44沉默抑制CNV在体内和体外的发育,抑制内皮细胞的增殖、迁移和试管形成。cZBTB44作为内源性miR-578海绵调节CNV的发育。这些结果将有助于更好地了解CNV的形成,开发新的cZBTB44靶向治疗新生血管引起的眼部疾病。






