小小外泌体效应大
随着新的治疗策略的不断发展,基于细胞疗法已成为有前途的选项一些疾病。尽管干细胞具有有益的作用,但它们的临床应用面临许多挑战,包括劳动量大,成本高和安全性等问题。研究表明,成年干细胞的再生能力主要是由于它们的旁分泌活性,这种分泌是通过这些分泌物来实现的。减轻细胞疗法问题同时保留细胞治疗益处的一种可行方法是使用分泌组或条件培养基代替实际细胞。肺球细胞分泌蛋白(LSC-Sec)和外泌体(LSC-Exo)的治疗效果优于源自间充质干细胞的同类药物。

技术路线:

结果:
1. 细胞分泌蛋白可减轻博来霉素诱导的纤维化和细胞凋亡
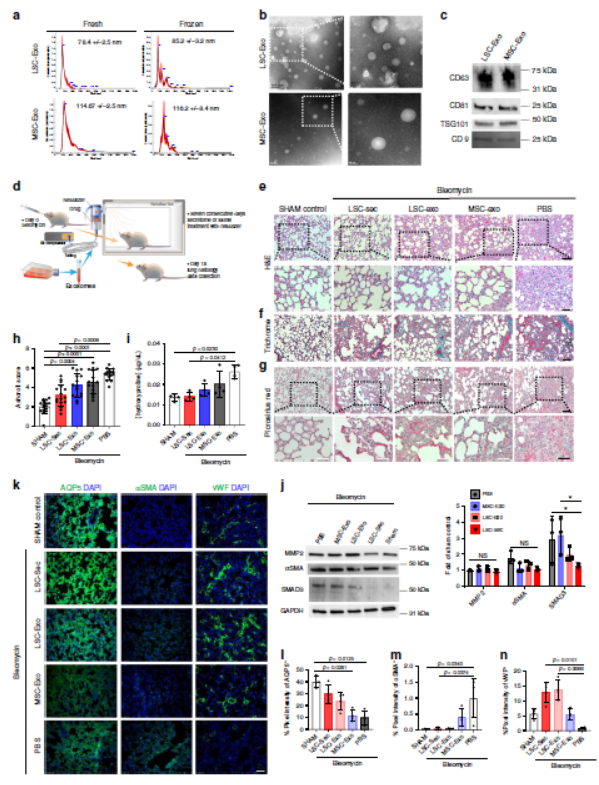
为检测LSC-Sec对肺修复和纤维化的影响,使用大剂量博来霉素建立肺纤维化(PF)模型,炎症在注射后第7天达到峰值,并在第9天左右转变为纤维化阶段,在炎症阶段结束后的第十天开始干预,以确保处于疾病模型的治疗阶段。雾化处理后发现所有组均显示出血性坏死,LSC-Sec或MSC-Sec治疗后出血坏死减少。由于Bleo会诱导DNA损伤,因此我们研究了分泌物治疗对凋亡的影响,发现LSC-Sec处理导致肺部细胞凋亡减少。LSC-Sec和MSC-Sec都通过保留肺泡上皮结构和减少胶原蛋白沉积来减少纤维化,只有LSC-Sec能减少纤维化区域并使肺泡上皮损伤恢复至对照水平。
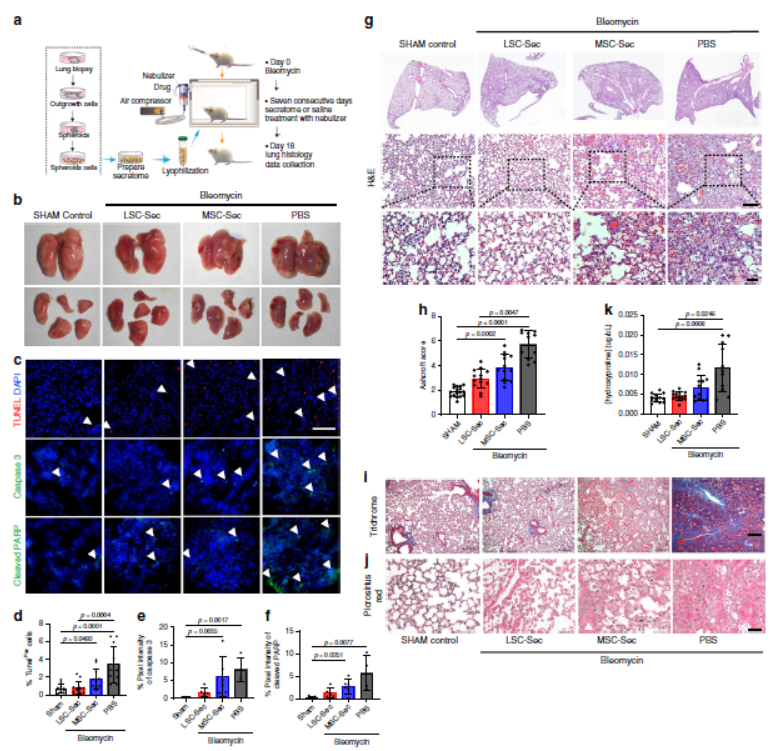
2. 吸入分泌蛋白可促进血管和肺泡修复
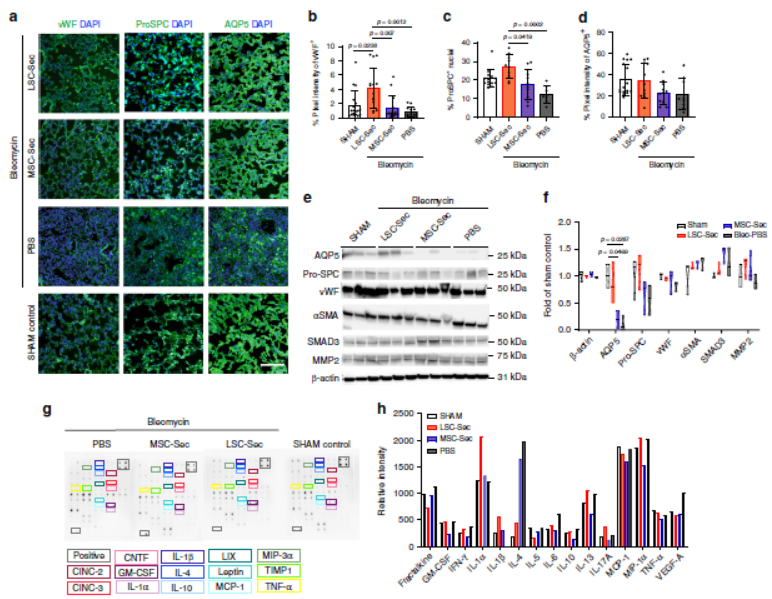
肺泡上皮由AT1和AT2细胞组成以防御损伤和维持体内平衡。AT1标记AQP5的免疫染色显示LSC-Sec处理能够逆转由Bleo引起的上皮损伤,LSC-Sec处理组中AQP5蛋白增加,表面活性蛋白C(ProSPC +)阳性AT2细胞的增殖增加。这种反应在MSC-Sec处理组中仍然发生,但程度较低,与PBS组无显着差异。只有LSC-Sec处理能够增加PF肺中vWF +脉管系统的表达。LSC分泌组显示出αSMA下降趋势,MMP2的表达呈增加趋势,促炎因子IL-4表达呈下降趋势。
3. LSC分泌蛋白治疗二氧化硅引起的肺纤维化
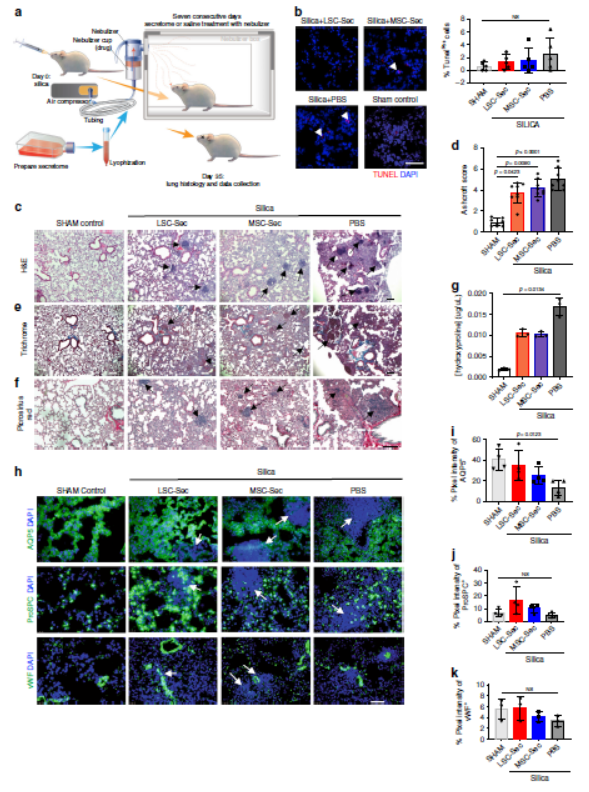
为检验LSC-Sec的作用是否可应用于其他肺损伤模型,我们使用公认的二氧化硅诱发肺纤维化模型,二氧化硅滴注后第28天开始治疗。任何治疗组中凋亡细胞均无差异,LSC-Sec能显著降低纤维化的严重程度,二氧化硅诱导的结节周围的纤维化组织强度较小且分布较少,但均持续存在;还减少了胶原蛋白沉积并减少肺泡上皮损伤。所有组中,两种肺泡细胞标记物均无明显下降,但LSC-Sec能通过促进ProSPC + AT2细胞表达并维持AQP5 + AT1细胞群体来减少肺泡上皮损伤。
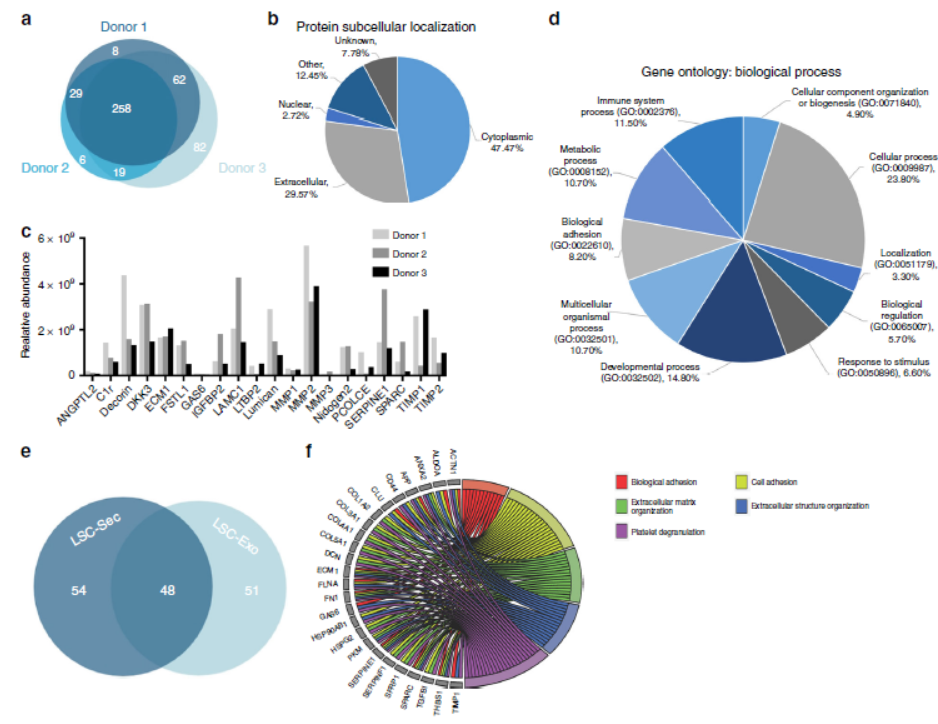
4.LSC-分泌蛋白和外泌体的蛋白质组成
我们使用来自三个不同供体LSC的集合分泌蛋白,采用液相色谱-串联质谱分析检查其蛋白质组,并将其与报道的干细胞分泌物组进行比较。发现在共有的蛋白质中,有29.6%的注释为具有已知分泌膜受体的细胞外蛋白,而47.5%的注释为具有未知分泌途径的胞质蛋白,且发现在LSC-Sec中75%的细胞质蛋白是通过目前未知的机制或途径从细胞释放的蛋白。
当LSC裂解时,大多数蛋白质组由细胞质蛋白(65%)和仅5%的细胞外蛋白组成。当将在LSC-Sec中检测到的细胞质蛋白与裂解细胞进行比较时,我们发现在分泌组中被分类为细胞质蛋白的222种蛋白中只有56种(25%)来自潜在的裂解或死细胞。在三个供体中鉴定出102种常见细胞外蛋白中,大多数是生长因子和细胞外基质相关蛋白,约一半也在LSC-Exo中鉴定出,许多蛋白都与生物粘附、细胞粘附、细胞外基质组织、细胞外结构组织和血小板脱粒有关。
5. LSC外泌体的治疗作用
检测外泌体的功能作用,发现所有分泌蛋白和外泌体治疗组在维持正常肺结构,减少纤维化,减少肺细胞凋亡和胶原沉积 方面均显示出治疗效果。肺αSMA蛋白水平没有明显下降趋势,LSC-Sec和LSC-Exo治疗可减轻肺泡上皮和血管损伤,并减少纤维化反应。
6. 外泌体治疗改善肺功能和外泌体miRNA分析
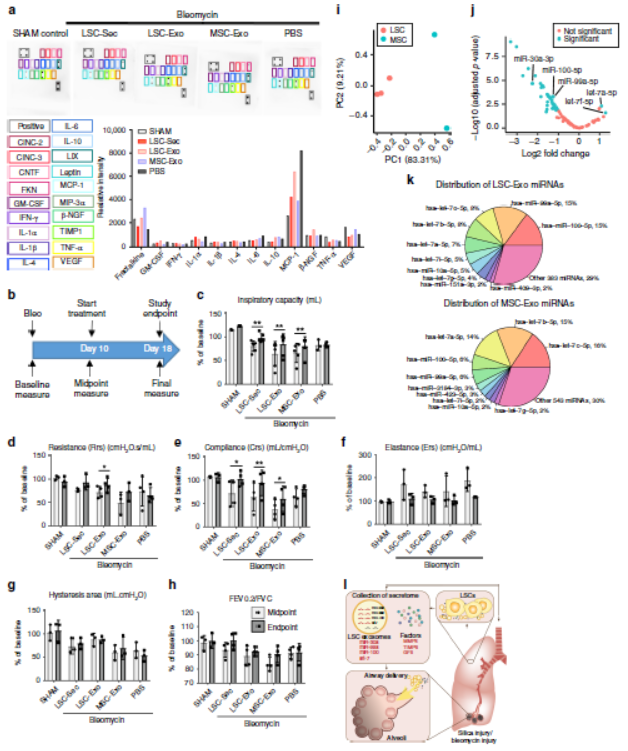
在进行吸入博来霉素的同时进行了多项肺功能测试,发现吸气量、阻力、顺应性、滞后面积以及强制呼气量与强制肺活量的比率均呈下降趋势。表明所有动物的肺功能持续受损,造成肺损伤,导致组织硬度和弹性反冲增加。通过分泌蛋白和外泌体治疗仅部分恢复肺功能。LSC-Sec、LSC-Exo或MSC-Exo治疗后,吸气能力和呼吸顺应性均显著改善,仅使用LSC-Exo治疗,呼吸阻力才明显恢复,而滞后面积和FEV / FVC比均无明显变化。
LSC-Exo和MSC-Exo的进行小RNA测序分析其miRNA组成差异,发现有600多个独特miRNA,总共有42个miRNA在这两个外泌体之间差异表达,在LSC-Exo中最上调的miRNA中有hsa-miR-99a-5p和hsa-miR-100-5p,并且是miR-99家族成员。抗纤维化的miR-30a-3p也明显上调。