LncRNA HCP5参与卵巢早衰
卵巢早衰(POI)的遗传病因至今已被证实,但lncRNAs在POI中的作用尚不清楚。那么,小编给大家介绍发表在“Nucleic Acids Research”上的文章“Long noncoding RNA HCP5 participates in premature ovarian insufficiency by transcriptionally regulating MSH5 and DNA damage repair via YB1”,让大家详细了解LncRNA HCP5在POI中的作用机制。

在本研究中,我们在生化性POI(bPOI)患者的颗粒细胞(GCs)中发现了一种低表达的lncRNA HCP5,它破坏了DNA损伤修复,促进了GCs的凋亡。在力学上,我们发现HCP5稳定了Nyb1和ILF2之间的相互作用,它可以介导YB1向GCs核的转移。HCP5沉默影响了YB1在细胞核中的定位,降低了YB1与MSH5基因启动子的结合,从而降低了MSH5的表达。
结果:
1.bPOI患者颗粒细胞中lncRNA HCP5表达下调
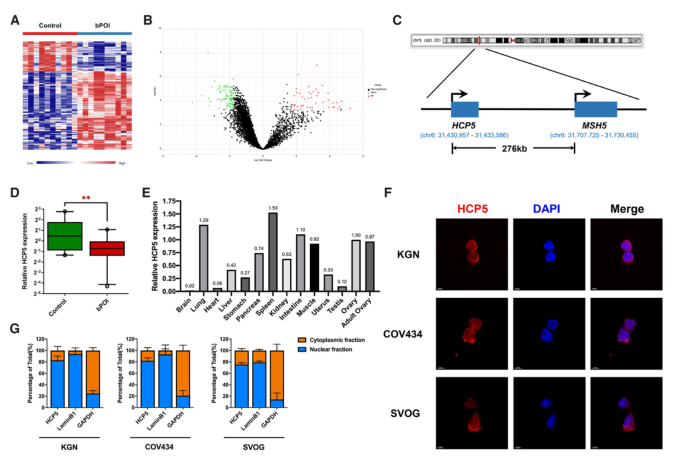
为了探讨异常表达的lncRNAs与POI的关系,我们首先对bPOI患者和正常人的颗粒细胞进行了微阵列分析。我们发现159个lncRNA在患者和对照组之间有差异表达(图1A,B)。在这些候选基因中,我们只考虑与POI相关基因共定位和共表达的lncRNA。lncRNA HCP5来自6号染色体MSH5基因上游276kb,是唯一一个POI基因共定位的lncRNA(图1C)。定量RT-PCR分析证实,bPOI患者和对照女性的GCs中HCP5的表达存在差异(图1D)。此外,我们的结果表明,HCP5在21周人胎儿的多个组织中广泛表达,在卵巢中表达相对较高(图1E)。采用荧光原位杂交(FISH)技术检测HCP5的亚细胞定位。结果表明,HCP5主要位于细胞核内,尤其是在KGN、COV434和SVOG细胞的核膜周围(图1F),细胞分离结合qPCR分析进一步证实了这一点(图1G)。
2.HCP5调节颗粒细胞MSH5的表达
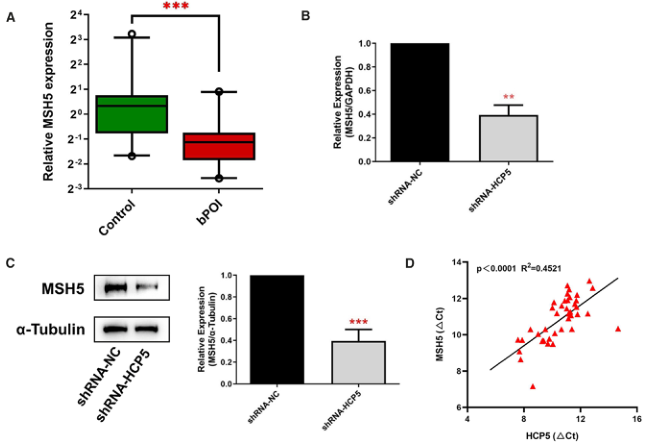
据报道,LncRNAs在其邻近基因中起到顺式调节作用。鉴于HCP5与MSH5的相邻定位,我们提出HCP5可能参与MSH5的表达调控。RT-qPCR结果显示bPOI女性GCs中MSH5较对照组下调(图2A),这与HCP5的表达一致。此外,在KGN细胞中敲除HCP5导致MSH5在mRNA和蛋白质水平上的表达明显降低(图2B,C)。由于lncRNA-HCP5能在转录水平上调控MSH5的表达,故进一步研究HCP5是否与MSH5-mRNA在GCs中共同表达。我们检测了GCs患者和正常人GCs中HCP5和MSH5的表达。如图2D所示,lncRNA HCP5与MSH5 mRNA水平显著相关。这些结果表明HCP5在调节MSH5表达中起着重要作用。
3.MSH5是DNA双链断裂(DSBs)修复过程中HCP5的靶点
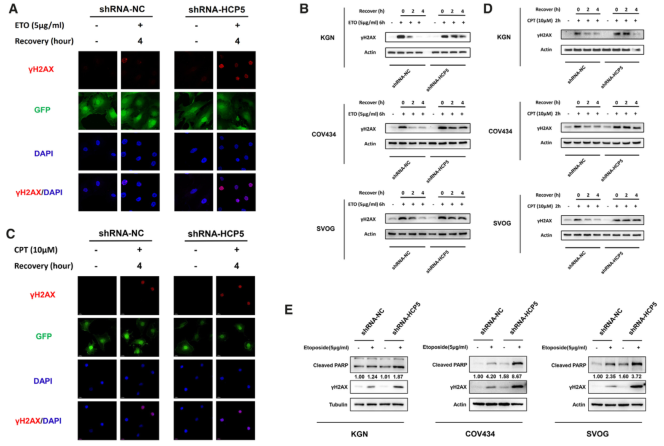
MSH5主要参与错配修复,MSH4-MSH5杂二聚体在DSBs的同源重组(HR)修复中起重要作用。通过免疫荧光法发现DSBs的敏感指标γH2AX随修复过程逐渐消失(图3A)。western blot检测γH2AX蛋白水平。结果表明,HCP5基因敲除明显延长了ETO诱导的KGN、COV434和SVOG细胞DSB修复的时间(图3B)。鉴于MSH5在DSBs的HR途径中的重要作用,我们研究了HCP5基因敲除对喜树碱(CPT)诱导的DNA损伤修复的影响。与ETO处理一致,γH2AX病灶被观察到, 并随着恢复逐渐消失(图3C)。此外,沉默HCP5明显延长了CPT诱导的KGN、COV434和SVOG细胞DSB修复的时间(图3D)。此外,HCP5基因的敲除显著增强了ETO诱导的细胞凋亡(图3E)。
4.HCP5直接与YB1结合,是其核定位的关键
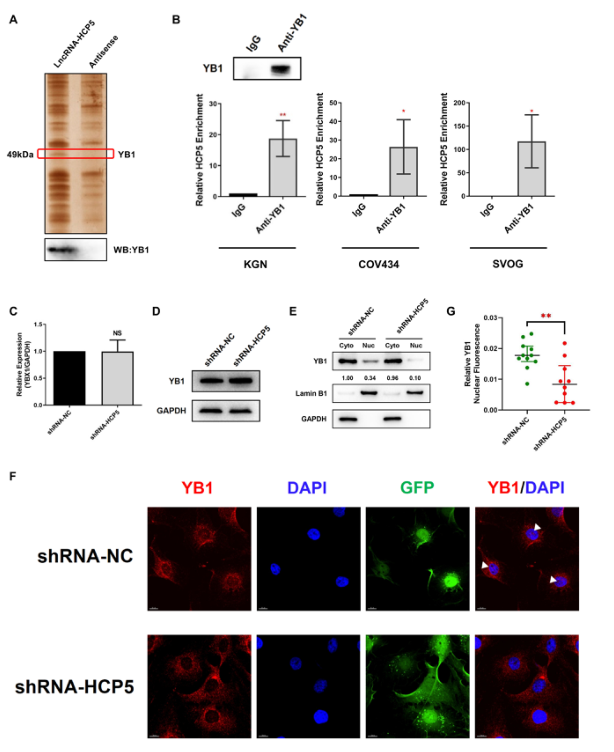
为了研究HCP5的蛋白伴侣,采用生物素标记的HCP5全长转录物及其反义转录物进行RNA下拉和MS联合检测。如图4A所示,银染后在50kDa处可见一条不同的HCP5结合蛋白带。Western blot证实YB1在HCP5下拉蛋白中富集(图4A)。由于RNA下拉实验揭示了HCP5-YB1在体外的相互作用,我们采用RNA结合蛋白免疫沉淀法(RIP)检测HCP5与YB1之间的内源性联系。用抗YB1抗体进行RIP检测,然后进行qRT PCR,证实了KGN、COV434和SVOG细胞中HCP5和YB1之间的直接相互作用(图4B)。然后我们探讨了HCP5对其结合蛋白YB1的调节作用。HCP5的敲除并没有改变YB1在mRNA或蛋白质水平上的表达(图4C,D),表明HCP5并不影响YB1在KGN细胞中的整体表达。考虑到YB1的活性主要取决于它在细胞核和细胞质之间的穿梭,进一步研究了HCP5是否参与了YB1的细胞定位。我们检测了HCP5沉默后KGN细胞核质部分YB1的表达。Western blot显示YB1存在于KGN细胞的细胞核和细胞质中;然而,HCP5沉默明显减少了YB1在细胞核中的存在(图4E)。免疫荧光分析表明YB1蛋白的核染色减少,排除了HCP5敲除时YB1的核仁定位(图4F、G)。这些结果表明HCP5沉默阻止了YB1向细胞核的转运。
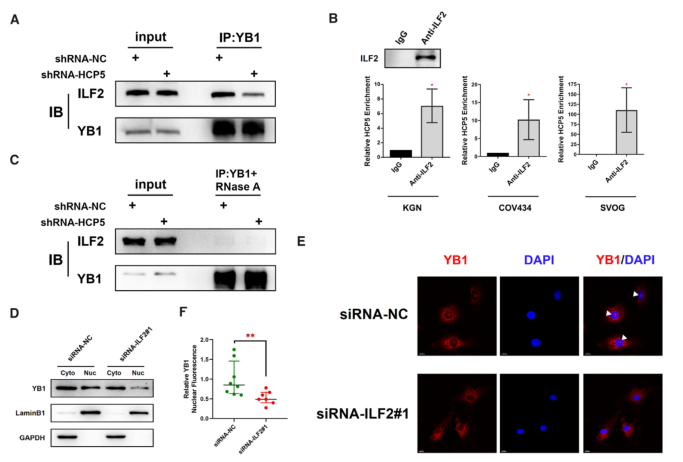
5.HCP5作为ILF2和YB1的RNA支架,对YB1定位到细胞核至关重要
在机制上,目前还不清楚HCP5是如何诱导YB1定位到细胞核的。考虑到ILF2可以与YB1相互作用并调节其核定位,我们采用共免疫沉淀的方法来评估HCP5对YB1 - ILF2复合物的影响。结果表明,HCP5的敲除降低了YB1抗体共沉淀的ILF2的相对量(图5A)。考虑到HCP5在细胞核,特别是核膜中的定位,我们推测HCP5可能是YB1和ILF2之间的一种模块化支架。因此,我们进行了RIP分析以确认HCP5和ILF2之间的相互作用。如预期,抗ILF2抗体在KGN、COV434和SVOG细胞中共沉淀HCP5(图5B)。此外,我们观察到在RNase A处理后YB1和ILF2之间的联系减弱,这进一步验证了RNA支架在YB1-ILF2相互作用中的重要作用(图5C)。最后,ILF2沉默导致YB1的核定位显著降低,这与HCP5基因敲除时的结果一致(图5D-F)。因此,HCP5可以作为YB1和ILF2相互作用的RNA支架,并可能对YB1的核定位负责。
6.HCP5基因敲除降低了与MSH5启动子的YB1结合并抑制了MSH5的转录激活
核YB1可以定位到启动子或其他关键调控区的目标基因,并开始转录。我们进一步探讨了HCP5敲除是否影响了MSH5启动子对YB1的占用。染色质免疫沉淀(ChIP)分析和qPCR显示YB1在MSH5启动子上显著富集(图6A)。此外,HCP5的敲除显著降低YB1与MSH5启动子的结合(图6B)。接着,我们研究了HCP5基因敲除对RNA PolⅡ与MSH5启动子结合的影响。如图6C所示,HCP5沉默导致RNA Pol II与MSH5启动子的结合减少,这与HCP5 shRNA对MSH5 mRNA水平的抑制一致。综上所述,HCP5通过促进YB1和RNA PolⅡ向MSH5启动子的募集来调控MSH5的转录。
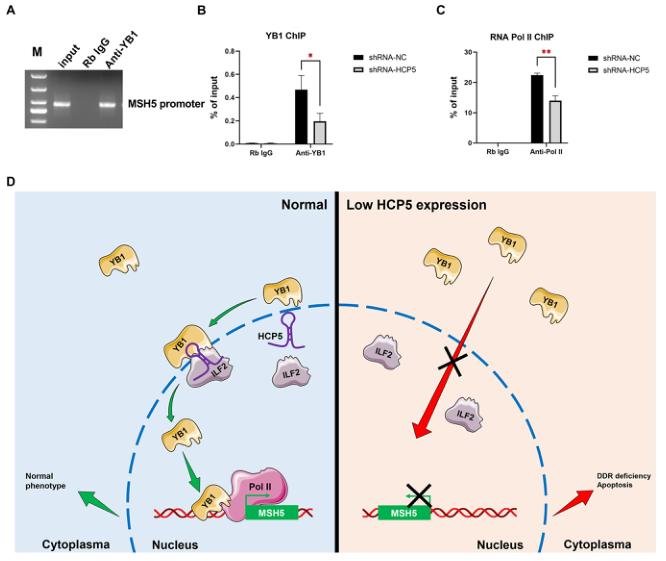
结论:我们阐明了LncRNA HCP5对人类POI的作用机制,即HCP5通过直接与YB1结合并调控其亚细胞定位来调节MSH5的表达和GCs的功能。本研究为POI的发病机制提供了一种新的表观遗传学机制。






