又一调控轴被发现啦?!CircFBXW4/miR-18b-3p/FBXW4抑制肝纤维化
CircRNA在多种疾病中发挥着重要的调控作用,但circRNA在肝纤维化(HF)中的表达谱和功能仍未解决,本文在一定程度上回答了此问题,并在2020年3月26发表于《Theransotics》杂志上。
本文主要结果如下:
1、HSCs小鼠的circRNA的表达谱
为了研究参与HF的circRNA的表达谱,使用RNA- Seq分析了原代肝星状细胞(HSC)三个阶段的(媒介期,HF进展期和HF消退期)表达谱。图1A是动物处理的示意图,图1B表明小鼠三个时期的病理特征符合预期,肝纤维化和损伤期小鼠HF加重,而HF恢复后减轻。图1C-D显示纤维发生因子的表达量在HF小鼠的HSC中持续高表达而在HF恢复的小鼠中则下降。此外,共鉴定4343个差异表达的circRNA。

图1 HSCs小鼠的circRNA的表达谱
2、CircFBXW4的表达在HF的小鼠中下降,在HF恢复的小鼠体内表达恢复
尽管根据表达丰度和外显子的类型筛选到27个差异表达的circRNA,其中在肝纤维组上调的11个和下调的16个。PCR验证后只有8个的表达与RNA测序一致(图2A),其中与媒介期相比,circFBXW4在HF中显著下调表达。因此,作者选定它为下一步研究对象。此外,小鼠的肝脏急性损伤模型的研究中发现circFBXW4的表达显著下调(图2B-D)。circFBXW4的表达在肝纤维时下降在HF恢复处理后表达上调(图2E),且circFBXW4的宿主基因FBXW4的表达呈现出一致的趋势(图2G)。此外,人体中的研究结果与小鼠体内类似,与健康对照组相比,人纤维化肝组织中circFBXW4的水平下调(图2I-J)。总之,这些结果揭示了HF进展中circFBXW4的下调,而HF恢复中circFBXW4的表达恢复(图2H)。 表明circFBXW4的表达与HF病理相关,并且circFBXW4可作为HF的诊断和预后标志物。
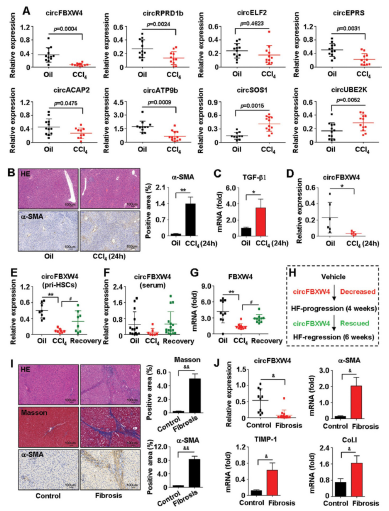
图2 CircFBXW4的表达在HF的小鼠中下降,在HF恢复的小鼠体内表达恢复
3、CircFBXW4的表征
circFBXW4来源于宿主基因FBXW4,定位于19号染色体,包含4个外显子,实验证实其头尾连接位点,且不可被Rnase R消化,核定位显示主要分布于细胞质中(图3)。
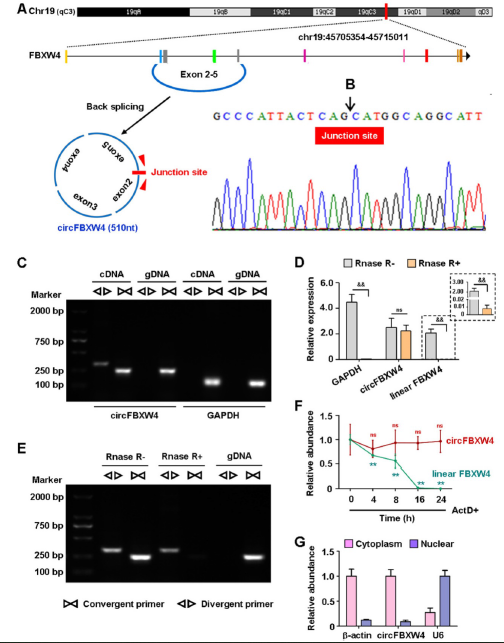
图3 CircFBXW4的表征
4、circFBXW4在体外抑制LX-2细胞的活化和增殖
过表达circFBXW4降低了FBXW4,TGF-β1,TIMP-1,α-SMA和collagens I的mRNA水平以及α-SMA和collagens I的蛋白水平(图4A-B),并抑制了LX-2细胞的活化,细胞增殖,DNA合成和凋亡(图4C-G)。

图4 LK-2细胞中过表达circFBXW4对其活性,增殖和凋亡的影响
5、circFBXW4对HF小鼠的抗纤维化作用
施用荧光素酶标记的pHBAAV-circFBXW4后,HF小鼠的肝实质和血管结构畸变,胶原蛋白沉积和α-SMA+成纤维细胞免疫信号持续降低(图5C),这与HSC中α-SMA和胶原蛋白I的表达降低有关(图5D);此外,肝组织中的羟脯氨酸(HYP)水平和血清中的丙氨酸转氨酶(ALT)均降低(图5E-F)。此外,circFBXW4过表达后,纤维化因子(TGF-β1,α-SMA,胶原蛋白I和TIMP-1)下调(图5G)。
综上这些结果表明,通过递送肝特异性pHBAAV-circFBXW4,在具有FBFBXW4过表达的HF小鼠中,肝纤维化损伤和肝纤维化标志物的表达被显着抑制。

图5 HF小鼠体内circFBXW4的抗纤维化效果
6、circFBXW4在体内可预防HF小鼠的炎症反应
炎症反应对HSCs激活和HF的启动具有重要作用,因此,评估了circFBXW4在肝纤维化中对炎症反应的功能。与媒介物相比,HF小鼠的肝巨噬细胞中circFBXW4的水平变化可忽略不计,并且在施用pHBAAV-circFBXW4后,肝巨噬细胞中circFBXW4的水平显着升高(图6A-B)。在circFBXW4过表达后,促炎性细胞因子TNF-α和IL-1β的循环水平降低了(图6C)。此外,C-C基序趋化因子配体2(CCL2)和CCL9的mRNA水平在用pHBAAV-circFBXW4处理的肝巨噬细胞中得到抑制(图6D)。
作者使用炎症抗体进一步测试了40种炎症因子在小鼠肝组织裂解物中的表达数组。结果显示,与媒介组相比HF小鼠的五种炎性因子的水平有所增加,而circFBXW4过表达后水平又下降了(图6E)。另外,在递送pHBAAV-circFBXW4后,肝脏组织中F4 / 80的免疫染色持续降低,HF小鼠中F4 / 80 + CD11b +肝巨噬细胞(肝巨噬细胞和浸润性单核细胞)也持续下降(图6F-G)。
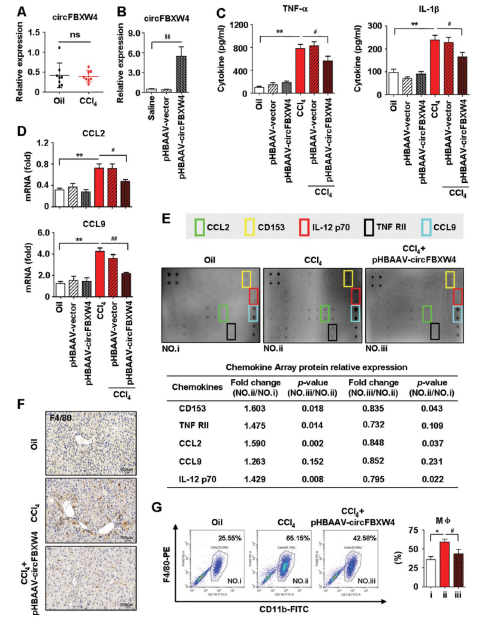
图6 HF小鼠体内circFBXW4的抗炎性
7、微阵列分析和鉴定circFBXW4-miR-18b-3p的相关性
鉴于circRNA吸附miRNA的特性,使用微阵列分析了HSCs细胞中的miRNA表达谱,共检测到1881个差异表达的miRNA,其中132个miRNA在HF组和媒介组间差异表达,160个在HF组和HF恢复组间差异表达。其中有41个被预测为circFBXW4潜在靶标。
萤光素酶结果显示与对照相比,circFBXW4-wt荧光素酶活性在6种miRNA组中显著抑制(图7D)。随后,RNA下拉检测表明miR-18b-3p,miR-324-3p和miR-18b-5p可能直接与circFBXW4结合(图7E),并在circFBXW4中鉴定到miR-18b-3p的结合位点序列(图7F),circFBXW4和miR-18b-3p主要共定位在细胞质中(图7G)。此外,与载体相比,HF小鼠中miR-18b-3p的水平显着增加(图7H)。 有趣的是,施用pHBAAV-circFBXW4后,肝纤维化中更高水平的miR-18b-3p被抑制。因此,circFBXW4可能直接充当miR-18b-3p的海绵,调节HF中miR-18b-3p的水平(图7H)。因此,重点放在circFBXW4与miR-18b-3p之间的相互作用上,进行进一步研究。
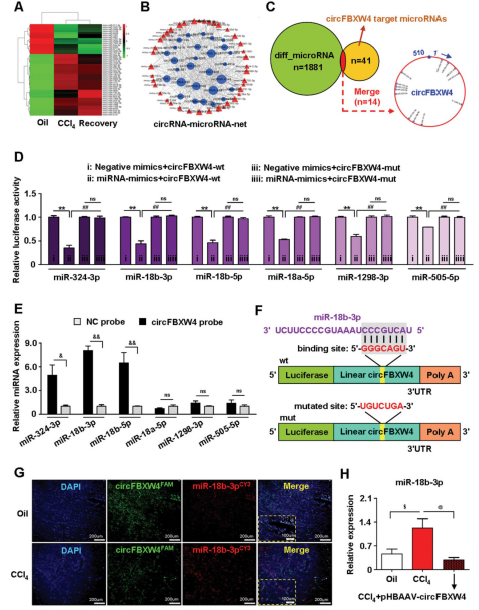
图7 HSC和circFBXW4结合miR-18b-3p的微阵列分析
8、circFBXW4通过海绵吸附miR-18b-3p上调FBXW4的表达
为了挖掘与HF相关的circFBXW4/miR-18b-3p的靶基因,进行了全转录测序,获得差异表达的mRNA(DEM),对DEM进行GO和KEGG富集分析(图8A-D)。分析发现FBXW7是miR-18b-3p的一个潜在靶基因,其结合序列如图8E所示。此外,作者发现,HF小鼠中无论是CCl4诱导还是BDL处理FBXW7的表达始终下调。
进一步揭示,circFBXW4通过海绵吸附miR-18b-3p调节FBXW7发挥抗纤维化作用,但是,miR-18b-3p水平上调后,pHBAAVcircFBXW4处理对FBXW7的作用被逆转(图8G-I)。相反,FBXW7的下游Yap1与指定的治疗相反(图8G-I)。这些结果表明circFBXW4充当了miR-18b-3p的海绵通过circFBXW4 / miR-18b-3p / FBXW7轴消除对HF的影响。
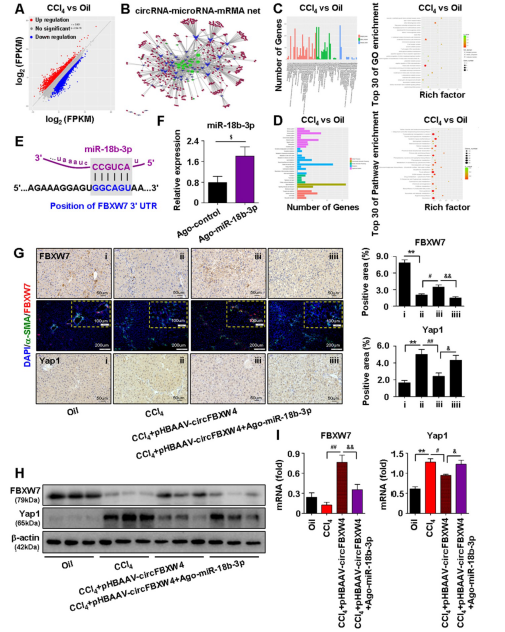
图8 circFBXW4/miR-18b-3p/FBXW7轴的鉴定
总之,这篇研究揭示了HF中的circFBXW4 / miR-18b-3p / FBXW7形成的新型调控轴。研究了circFBXW4在HF中的表达模式,功能和机制,证实了在HF消退阶段挽救了circFBXW4的表达,但该机制尚未明确阐明,需要进一步验证。此外,circFBXW4提供了一个平台,可容纳各种与肝脏或纤维化相关的miRNA候选基因,但circFBXW4在ceRNA机制中的参与机制仍需解决。
参考文献:
Chen Xin., Li Hai-Di., Bu Fang-Tian., Li Xiao-Feng., Chen Yu., Zhu Sai., Wang Jia-Nan., Chen Si-Yu., Sun Ying-Yin., Pan Xue-Yin., Yin Na-Na., Xu Jie-Jie., Huang Cheng., Li Jun.(2020). Circular RNA circFBXW4 suppresses hepatic fibrosis via targeting the miR-18b-3p/FBXW7 axis. Theranostics, 10(11), 4851-4870. doi:10.7150/thno.42423






