糖尿病性的视网膜病,了解一下?不急,circRNA在捉妖!
糖尿病性视网膜病(DR)是工龄较长者失明的主要原因,血管周细胞变性是DR的主要临床表现,但对周细胞变性的机制了解甚少。circRNA在多种生物学过程和疾病进展中起重要作用,本文研究了circRNA在周细胞生物学和糖尿病引起的视网膜血管功能障碍中的作用。
主要结果如下:
1、在周细胞中鉴定发现cZNF532是一种高糖调节的circRNA
以正常血糖(NG)浓度,NG加渗流控制对照(OS),和高血糖(HG)浓度的三个血糖水平的人类视网膜周细胞为材料进行测序。在HG和NG组间共鉴定到1523个差异表达circRNAs(625个上调,898个下调),在HG和OS组间共鉴定到792个差异表达circRNAs(386个上调,406个下调)。任意挑选出5个上调和5个下调的差异表达circRNAs进行qRT-PCR验证,结果发现,circ_0047814是最显著上调的circRNA,其宿主基因为ZNF532,因而将其命名为cZNF532。Sanger测序证实,cZNF532在视网膜周细胞中构成性表达,不可被RNase R 消化,且主要在细胞质中表达(图1A-C)。
进一步研究,体内体外糖尿病应激是否影响cZNF532在周细胞中的表达。如图1D所示,在小鼠体内,与非糖尿病对照组相比,cZNF532在糖尿病血管中的表达明显上调,且随着糖尿病病程时间延长差距逐渐增大。与正常血糖组相比,cZNF532在HG组的人视网膜周细胞中高表达,类似的,在H2O2或炎症刺激下,cZNF532在人视网膜周细胞中高表达;与此相反,cZNF532在人视网膜血管上皮细胞(HRVECs)中的表达则不受高血糖、H2O2或炎症刺激的影响(图1E-H)。总之,cZNF532表达响应周细胞中血糖含量的变化。
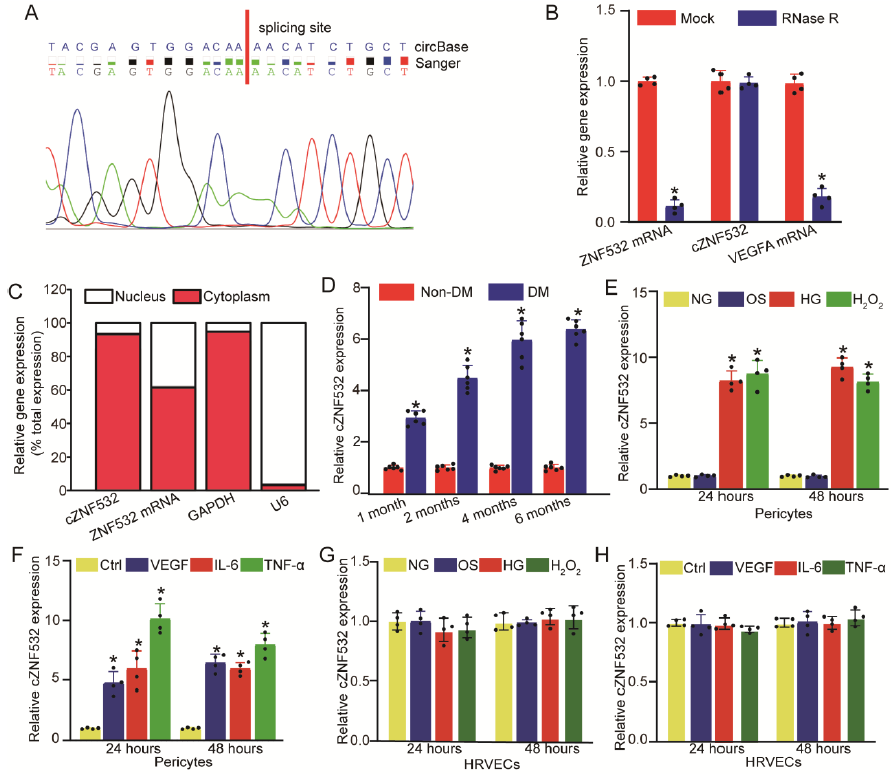
图1 在周细胞中鉴定发现cZNF532是一种高糖调节的circRNA
2、在体外cZNF532调节周细胞功能
鉴定cZNF532是否在体内调控周细胞的功能,使用cZNF532 siRNA1干扰cZNF532的表达,结果发现,周细胞外膜细胞标记物的表达也随之降低,包括血小板衍生生长因子受体(PDGFR) –β,α-SMA,肌腱线蛋白和NG2(图2A);并且周细胞向HRVECs的补充也下降了(图2B);但增加了周细胞中大分子的通透性(图2C)。然后进一步确定异常的周细胞分化和补充是否与细胞活力或增殖的改变有关。结果显示,沉默cZNF532后,周细胞活力和增殖均下降;而S期细胞的数量下降了3倍,G1期的细胞数量则增加了约30%;此外,还导致高血糖或氧化应激诱导的细胞凋亡水平加剧(图2D-H)。总之,实验证实, cZNF532可在体外调节周细胞的膜结构,细胞活力和增殖。
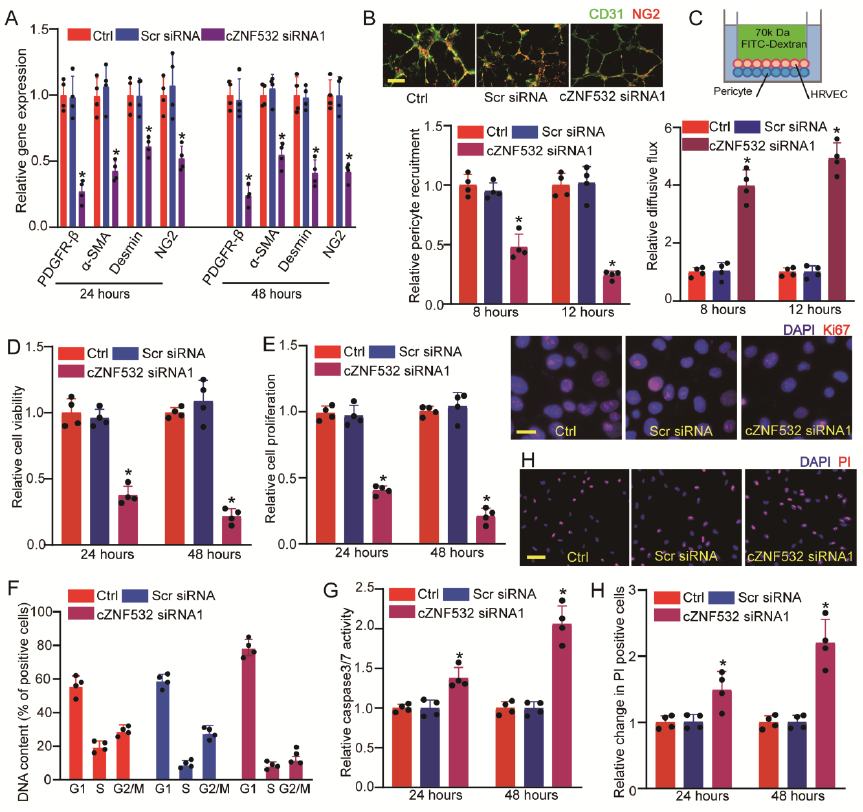
图2 cZNF532在体外调节周细胞功能
3、cZNF532在体内调节视网膜周细胞功能和血管完整性
采用IB4和NG2免疫荧光染色法检测视网膜血管中周细胞覆盖率。如图3所示,糖尿病模型构建1个月时,沉默cZNF532或糖尿病本身均对周细胞覆盖率没有影响,而糖尿病和cZNF532沉默结合作用时或下调周细胞覆盖率;在2/4/6月时,沉默cZNF532或糖尿病本身均会导致周细胞覆盖率下降,两者结合作用时下调比率更大(图3A-B)。此外,还发现,cZNF532沉默和糖尿病两个实验因素协同作用会加重糖尿病诱导的视网膜血管渗漏,这与cZNF532改变周细胞覆盖率的结果相似(图3C-D)。
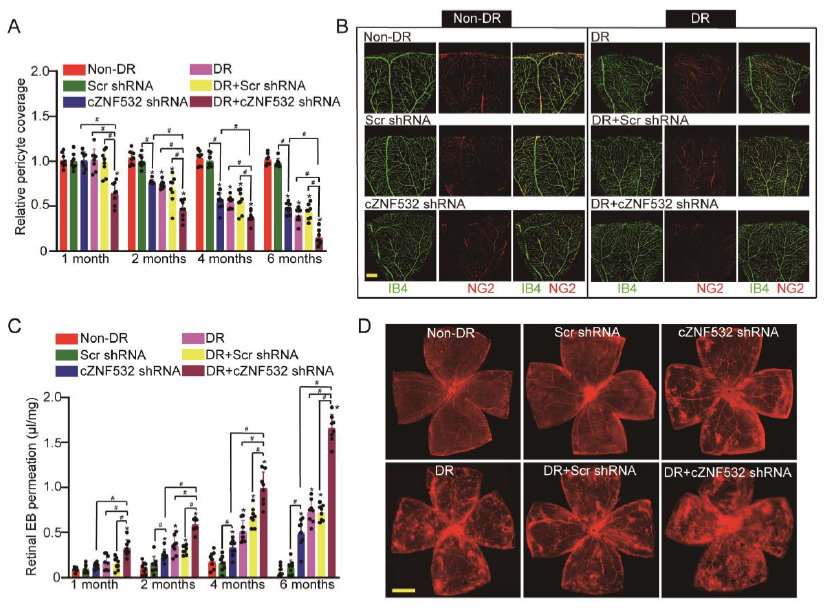
图3 cZNF532在体内调节视网膜周细胞功能和血管完整性
4、在活体条件下,细胞内cZNF532基因的下调会诱发视网膜血管功能障碍
IB4和NG2染色显示,与非糖尿病Cre组(Cre)或糖尿病Cre组(DR)相比,1/2/4/6个月时,周细胞特异性敲低cZNF532 (DR+cZNF532 shRNA)降低了视网膜血管周细胞覆盖率(图4A-B)。此外,Evans blue检测显示,与Cre组或DR组相比,周细胞特异性敲低cZNF532 (DR+cZNF532 shRNA)进一步加重了视网膜血管渗漏(图4C-D)。上述结果表明,特异性下调cZNF532的表达可诱导视网膜血管功能障碍。
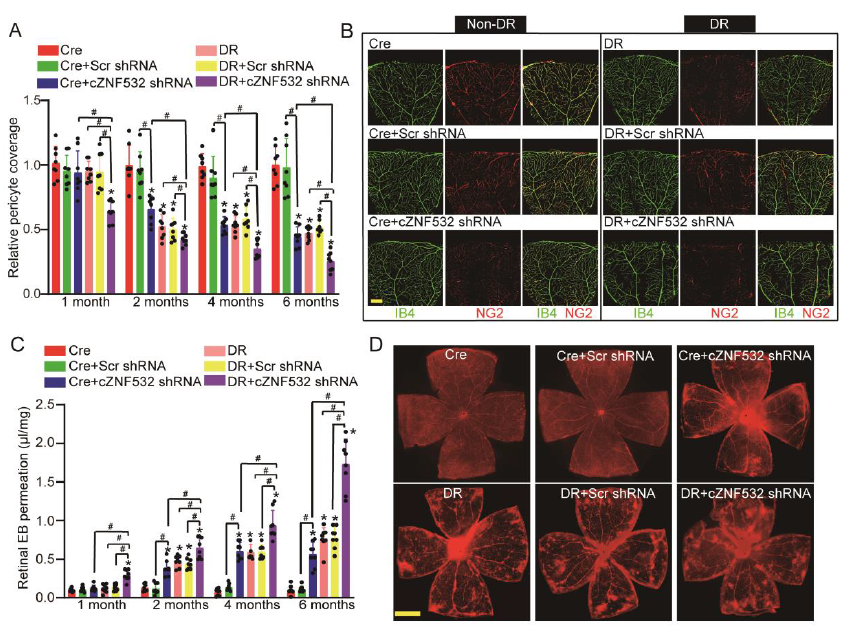
图4 在活体条件下,细胞内cZNF532基因的下调会诱发视网膜血管功能障碍
5、在体外cZNF532作为miRNA海绵调控周细胞功能
由于cZNF532主要在周细胞的细胞质中表达,因而推测cZNF532通过作为miRNA海绵在转录后水平调控周细胞的功能。使用荧光素酶实验检测cZNF532与预测的有结合位点的miRNA之间的关系,结果显示miR-29a-3p、miR-498和miR-758转染降低了LUC-cZNF532细胞的荧光素酶活性,而对LUC-cZNF532突变的荧光素酶活性没有影响(图5A-B)。随后检测cZNF532、miR-29a-3p、miR-498和miR-758在周细胞和小鼠视网膜中的相对表达丰度,与miR-498和miR-758相比,cZNF532和miR-29a-3p的表达丰度较高(图5C-D)。因此,后续主要研究miR-29a-3p在周细胞中的表达,结果显示,在周细胞胞质中,cZNF532和miR-29a-3p的存在共表达 ,且cZNF532与miR-29a-3p有三个潜在结合位点;荧光素酶等实验进一步证实cZNF532充当了miR-29a-3p的海绵,并通过将miR-29a-3p从它的目标基因隔离而削弱了miR-29a-3p活性(图5E-I)。不仅如此,作者通过实验证明,过表达cZNF532不仅可以颠倒miR-29a-3p对周细胞活力和增殖的影响,还可以缓解周细胞因miR-29a-3p介导的促凋亡作用。
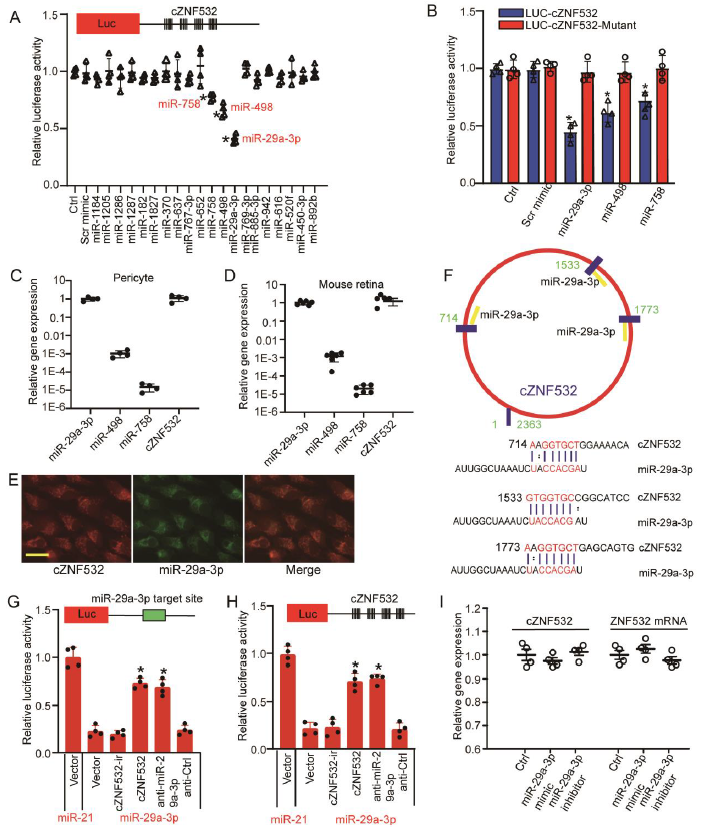
图5 在体外cZNF532作为miRNA海绵调控周细胞功能
6、cZNF532-miR-29a-3p-NG2/LOXL2/CDK2网络在体内调节视网膜周细胞功能和血管完整性
然后在体内研究了miR-29a-3p在视网膜血管功能障碍中的作用。miR-29a-3p agomir或cZNF532沉默导致NG2,LOXL2和CDK2表达增加。miR-29a-3p agomir可以模拟cZNF532沉默对视网膜血管功能障碍的影响,如图6所示,在糖尿病性视网膜中,注射miR-29a-3p agomir会降低周细胞覆盖率,加剧血管渗漏,并增加微动脉瘤,无细胞毛细血管和周细胞重影。
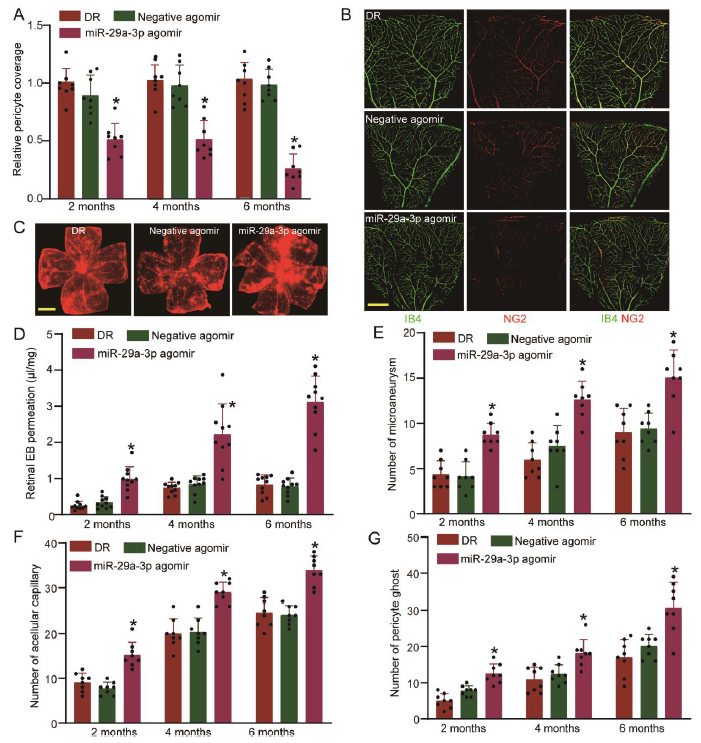
图6 在体内cZNF532-miR-29a-3p-NG2/LOXL2/CDK2信号通路调节视网膜周细胞功能和血管完整性
7、cZNF532/miR-29a-3p/NG2、LOXL2和CDK2信号通路在视网膜血管功能障碍中的临床意义
收集36例眼部玻璃体样本,分成4类,非糖尿病对照样本(Ctrl,n=8),无增殖性糖尿病视网膜病变(PDR)的糖尿病黄斑水肿(DME) (n=12),有PDR的DME (n=12),虹膜新生血管(NVI),代表DR最严重(n=4)。qRT-PCR显示,在患有DME,PDR或NVI的患者玻璃体中,cZNF532的表达上调,并且其表达与疾病的严重程度相关(图7A)。相比之下,在四类患者中,玻璃体患者的miR-29a-3p表达没有改变(图7B)。 此外,与非糖尿病对照相比,DME,PDR或NVI患者玻璃体中NG2,LOXL2或CDK2的浓度上调。将周细胞与来自PDR患者的玻璃体一起温育,结果发现,通过cZNF532过表达或miR-29a-3p抑制诱导cZNF532介导的信号转导,可以保护周细胞免受糖尿病性玻璃体诱导的周细胞凋亡的影响(图7C-D)。此外,共注射cZNF532过表达载体或miR-29a-3p antagomir可降低糖尿病玻璃体对视网膜血管通透性的影响,这类似于抗VEGF对视网膜血管通透性的影响(图7E)。cZNF532过表达或miR-29a-3p抑制作用可降低糖尿病性玻璃体诱导的周细胞变性(图7F)。

图7 cZNF532/miR-29a-3p/NG2、LOXL2和CDK2信号通路在视网膜血管功能障碍中的临床意义
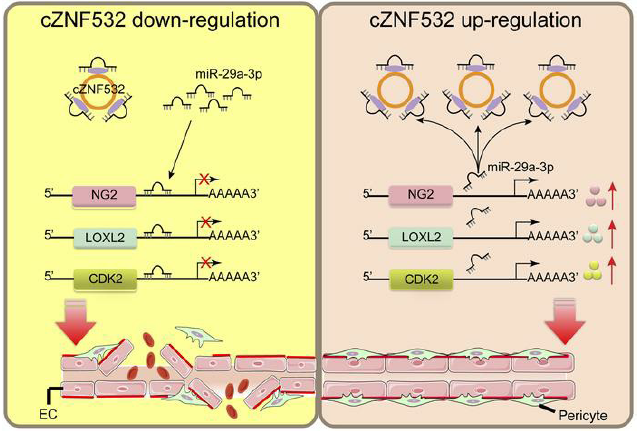
总之,如图8所示,这项研究中表明在糖尿病应激下的周细胞中,糖尿病鼠模型的视网膜血管中以及糖尿病患者的玻璃体液中,cZNF532的表达上调。 cZNF532通过充当miR-29a-3p海绵并诱导NG2,LOXL2和CDK2的表达增加来调节视网膜周细胞变性和血管功能障碍。cZNF532过表达或miR-29a-3p抑制可防止糖尿病引起的视网膜周细胞变性和血管功能障碍。
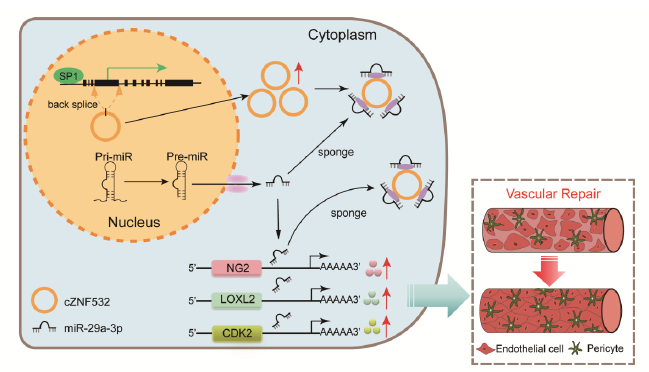
图8 cZNF532在视网膜血管功能障碍中的作用及机制
此外,作者表明不能排除cZNF532在体内通过靶向内皮细胞调节视网膜血管功能的可能性。虽然cZNF532调节视网膜周细胞变性和血管功能障碍的结果令人鼓舞,但需承认,仍需要通过改进条件circRNA敲除技术,进一步的来明确cZNF532在DR中的确切作用。
参考文献:
Jiang Qin., Liu Chang., Li Chaopeng., Xu Shanshan., Yao Mudi., Ge Huimin., Sun Yanan., Li Xiumiao., Zhang Shujie., Shan Kun., Liu Baihui., Yao Jin., Zhao Chen., Yan Biao.(2020). Circular RNA-ZNF532 regulates diabetes-induced retinal pericyte degeneration and vascular dysfunction. J. Clin. Invest., undefined(undefined), undefined. doi:10.1172/JCI123353






