外泌体是如何作为纳米治疗剂的?
该研究是2019年8月发表于Theranostics的文章‘Mesenchymal stem cell-derived exosomes as a nanotherapeutic agent for amelioration of inflammation-induced astrocyte alterations in mice’(IF=8.063)。间充质干细胞衍生的外泌体在治疗癫痫、中风或创伤性脑损伤等神经系统疾病中具有强大的抗炎作用。虽然星形胶质细胞被认为是这些效应的介质,但对它们的作用仍知之甚少。为了解决这个问题,该实验研究了骨髓MSC-Exo对炎症诱导的星形胶质细胞改变的治疗作用和机制。
文章缩写:
间充质干细胞外泌体(MSC-Exo)
脂多糖(LPS)
细胞增殖标记(ki67)
一种反应性星形胶质增生标记(GFAP)
假手术(Sham)
硒(SE)
结果:
一 、骨髓间充质干细胞(MSC)和外泌体(Exo)的特征
根据流式细胞仪分析,Wharton’s Jelly组织的酶消化获得的MSC的CD73,CD90和CD105呈阳性,而造血谱系标记(如CD34和CD45)呈阴性,且显示出分化为脂肪细胞,骨细胞和软骨细胞谱系的潜力。通过一系列超速离心产生的MSC-Exo,对经典的外泌体标记物呈阳性(图1A)。当通过TEM和纳米粒子跟踪分析检查MSC-Exo的形态和粒径时,结果显示出MSC外泌体的经典“杯状边缘”形态(图1B),并且绝大多数源自MSC的外泌体具有预期直径为30至150 nm(图1C)。结果表明,实验中MSC-Exo的特征符合外泌体的典型标准。
二、星形胶质细胞的特征及骨髓MSC-Exo掺入
GFAP/Iba1双重免疫染色检查培养的星形胶质细胞的组成(图1D)。 92.16%的细胞表达了GFAP,只有2.99%的细胞显示了Iba1+免疫染色(图1E)。为了在体外和体内追踪MSC-Exo,星形胶质细胞和SE模型的原代培养接受了CM-A594标记的外泌体,并通过GFAP(图1F)或s100-β(图1G)检查了细胞或组织样品染色。红色的MSC-Exo纳米颗粒似乎呈较小的簇状,在星形胶质细胞的整个原代培养物中(图1F1)以及在小鼠的海马星形胶质细胞中观察到(图1G1)。在细胞样本和海马中,外泌体摄取的荧光强度分别为0.9885±0.1844和0.2812±0.03721。结果表明,MSC-Exo可以在体外和体内掺入海马星形胶质细胞。
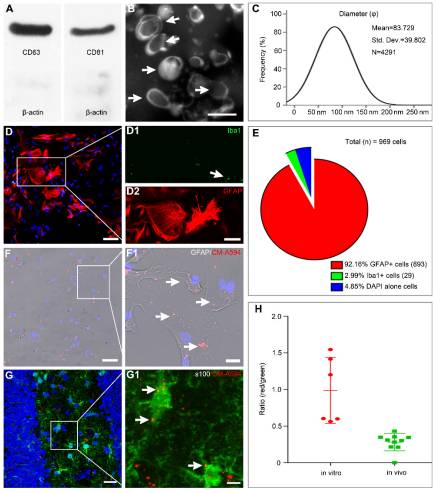
图1.MSC-Exo和星形胶质细胞表征,纳米粒子追踪。
三、骨髓MSC-Exo治疗可减轻脂多糖(LPS)诱导的细胞毒性、反应性星形胶质细胞增生和炎症反应在体内
免疫荧光实验(图2A-L)表明,与LPS组相比,MSC-Exo处理极显著降低了GFAP(一种反应性星形胶质增生标记)的相对表达(图2M),C3(A1星形胶质细胞标记,图2N),CD81(星形细胞活化的基本调节剂,图2O)和ki67(细胞增殖标记,图2P)。 WB(图2Q)显示LPS+GFAP(图2R),C3(图2S)和CD81(图2T)的蛋白表达显着降低MSC-Exo组与LPS组相比。使用ELISA来检查MSC-Exo对LPS诱导的星形胶质细胞的抗炎反应。与LPS组相比,MSC-Exo处理显着减弱了培养基中TNFα(图2U)和IL-1β(图2V)的分泌,但并未减弱IL-6(图2W)。这些结果表明,MSC-Exo可以显着降低LPS诱导的细胞毒性,反应性星形胶质细胞增生和炎症反应。
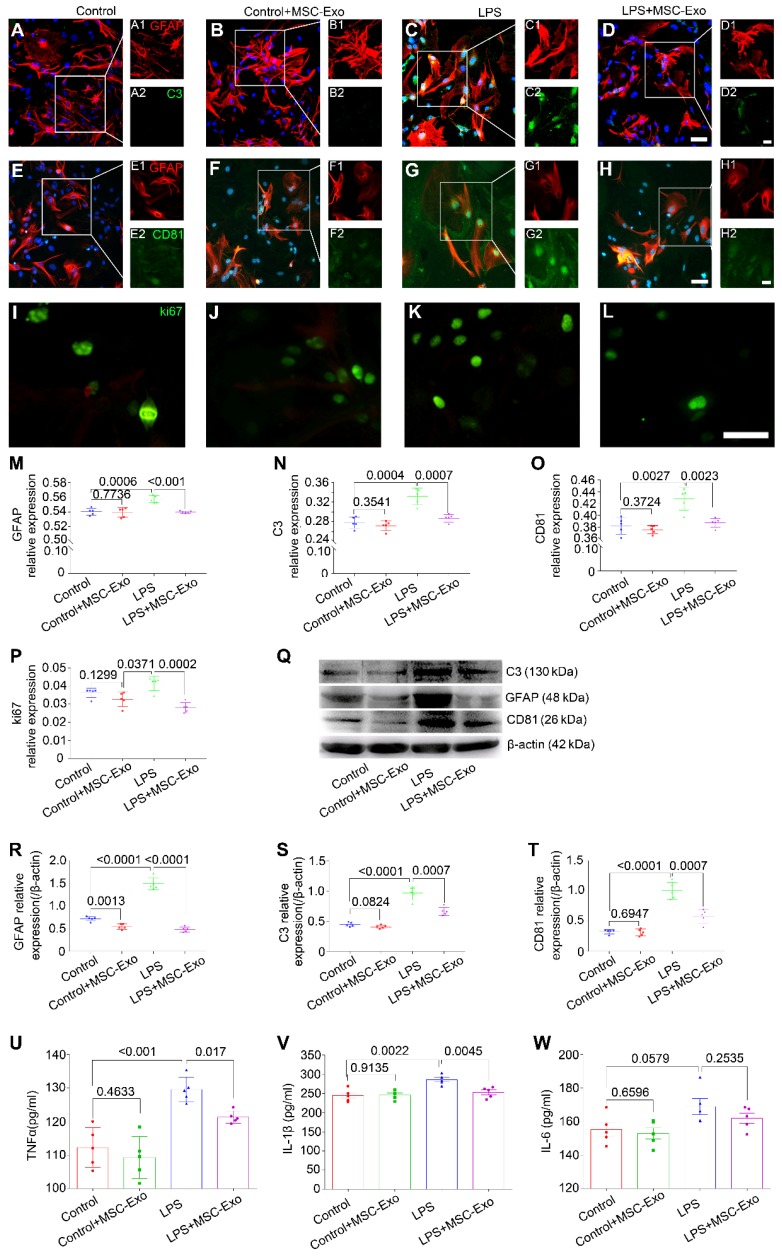
图2.骨髓间充质干细胞-Exo对LPS诱导的星形胶质细胞活化和炎症反应的保护作用在体内。
四 、骨髓间充质干细胞外泌体(MSC-Exo)处理改善脂多糖(LPS)诱导的星形胶质细胞原代培养中异常钙信号和线粒体功能障碍
使用钙成像研究星形胶质细胞原代培养中钙信号的改变。星形胶质细胞在各个组中具有不同的荧光特性(图3A-D)。在ATP刺激后,第一阶段Ca2+响应,一个尖峰代表一个瞬时的大幅度增加的细胞内Ca2+组成,第二阶段的响应,即对照组中的细胞内Ca2+浓度缓慢下降(图3E),Control+MSC-Exo(图3F),LPS(图3G)和LPS+ MSC-Exo(图3H)组。统计分析表明,与对照组相比LPS组在添加ATP后具有更高的细胞内Ca2+振荡幅度(ΔF/ F),而在Control+MSC-Exo组中未检测到这种变化(图3I)。 MSC-Exo与LPS组相比,治疗(LPS+MSC-Exo)极显着减少了Ca2+内流(图3I)。与对照组相比,LPS刺激导致响应时间极显著上升(图3J)和衰减时间的变化显著更快(图3K)。在Control+MSC-Exo组中无变化(图3J,图3K)。MSC-Exo逆转了LPS组中观察到的Ca2+振荡速率(图3J和K)。由于线粒体通透性对于炎症诱导的星形细胞活化至关重要,因此使用线粒体特异性亲脂性阳离子荧光染料JC-1进一步检查了原代培养中星形胶质细胞的MMP(图3L-O)。统计分析表明,LPS组的JC-1比率显着降低(图3P),而通过MSC-Exo给药可以逆转(图3P)。在Control组和Control+ MSC-Exo组之间无显着差异(图3P)。总之,MSC-Exo可改善海马星状细胞原代培养物中LPS诱导的异常钙信号传导和线粒体功能障碍。
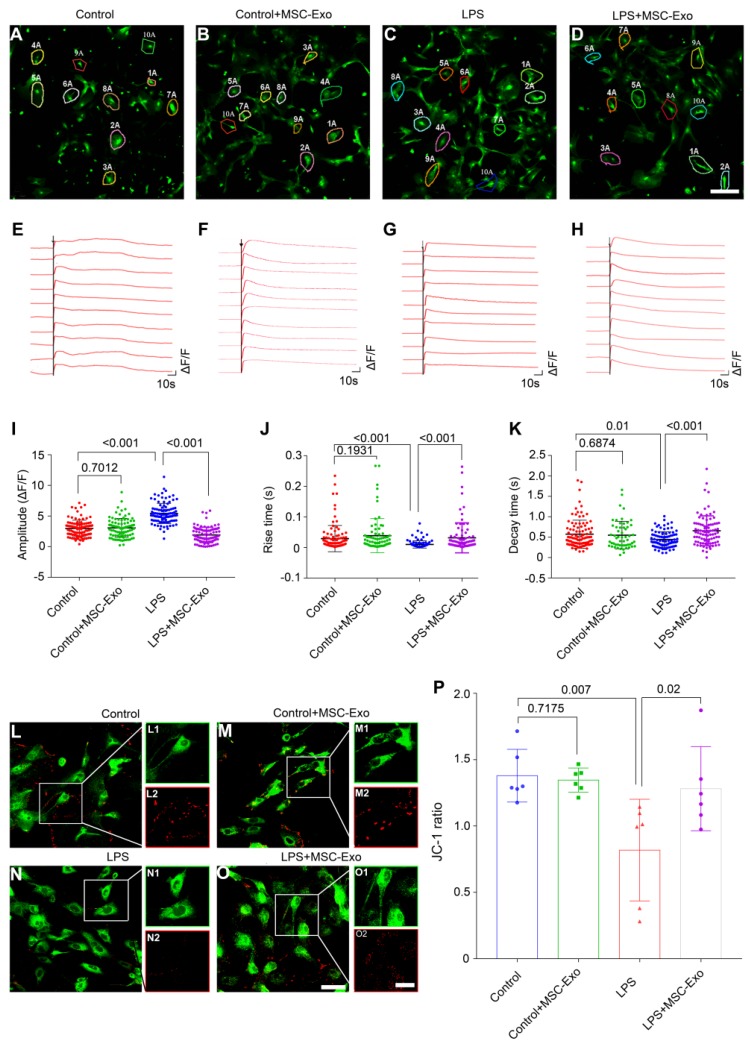
图3.骨髓MSC-Exo治疗改善LPS诱导的海马星形胶质细胞原代培养中异常钙信号和线粒体功能障碍。
五、sgRNA敲除Nrf2降低骨髓MSC-Exo对星形胶质细胞活化的抑制作用在体内
免疫印迹和免疫荧光用于探讨Nrf2-NF-κB信号通路是否参与了星形胶质细胞活化的抑制。Western印迹法显示LPS极显着增加了抗氧化剂(Nrf2,Keap1,HO-1)和炎症性蛋白(p-P65/P-65,NF-κB激活和炎症标记)的表达(图4A),而MSC-Exo治疗逆转了这些变化(图4D-G)。此外,control+ MSC-Exo组的NF-κB活化极显著降低(图4E)。免疫荧光进一步检查抗氧化剂和炎性因子的核易位,对培养的星形胶质细胞中的LPS刺激,MSC-Exo处理抑制Nrf2和P-65的核易位(图4B,C)。
为了确定通过MSC-Exo抑制LPS诱导的星形细胞活化的机制,用sgRNA敲除原代培养的星形胶质细胞中的Nrf2基因。 Western印迹法(图4H)显示敲低Nrf2(图4J)显著降低NF-κB(图4K),Keap1(图4L)和HO-1(图4M)。与sgRNA组相比,LPS刺激极显著上调了Nrf2,NF-κB和HO-1的表达(图4J,K),但与sgRNA组相比,并没有改变Keap1的表达(图4L)。在LPS诱导的Nrf2敲低星形胶质细胞中,与sgRNA + LPS组相比,MSC-Exo的给药未影响氧化(Nrf2,Keap1和HO-1)和炎症(p-P65/P-65和GFAP)的标志物(图4I-M)。这些数据表明,通过MSC-Exo处理可预防LPS诱导的星形细胞活化,NF-κB-Nrf2信号通路起着决定性作用。

图4.Nfr2的sgRNA敲除降低了骨髓MSC-Exo对星形胶质细胞活化的抑制作用在体内。
六、侧脑室注射骨髓间充质干细胞外泌体(MSC-Exo)可减轻小鼠海马反应性星形胶质细胞增生
蛋白质印迹法使用毛果芸香碱诱导的SE模型检查MSC-Exo的抗反应性星形胶质细胞增生,这是海马中强烈的反应性星形胶质细胞增生的特征。从假手术(Sham),Sham + Exo,SE + PBS和SE + Exo实验组中收集海马组织(图5Q)。注射PBS的小鼠在术后24、4 d和8 w时C3(图5R),CD81(图5S)和GFAP(图5T)的表达极显着增加。MSC-Exo处理在SE后4 d和8 w显著降低了标志物的表达(图5R-T),但在SE后24 h却没有降低(图5R-T)。SE后4天,使用免疫组织化学进一步检查了MSC-Exo对反应性星形胶质增生的假定治疗作用(图5A-L)。荧光强度分析显示,SE + Exo组中GFAP,CD81,C3和ki67的相对表达显着降低(图5M-P)与SE + PBS组相比(P <0.01),没有观察到MSC-Exo对假手术组动物的不利影响(图5M-P和R-T)。数据显示,在SE小鼠模型脑室内注射MSC-Exo可以减少海马反应性星形胶质细胞增生。
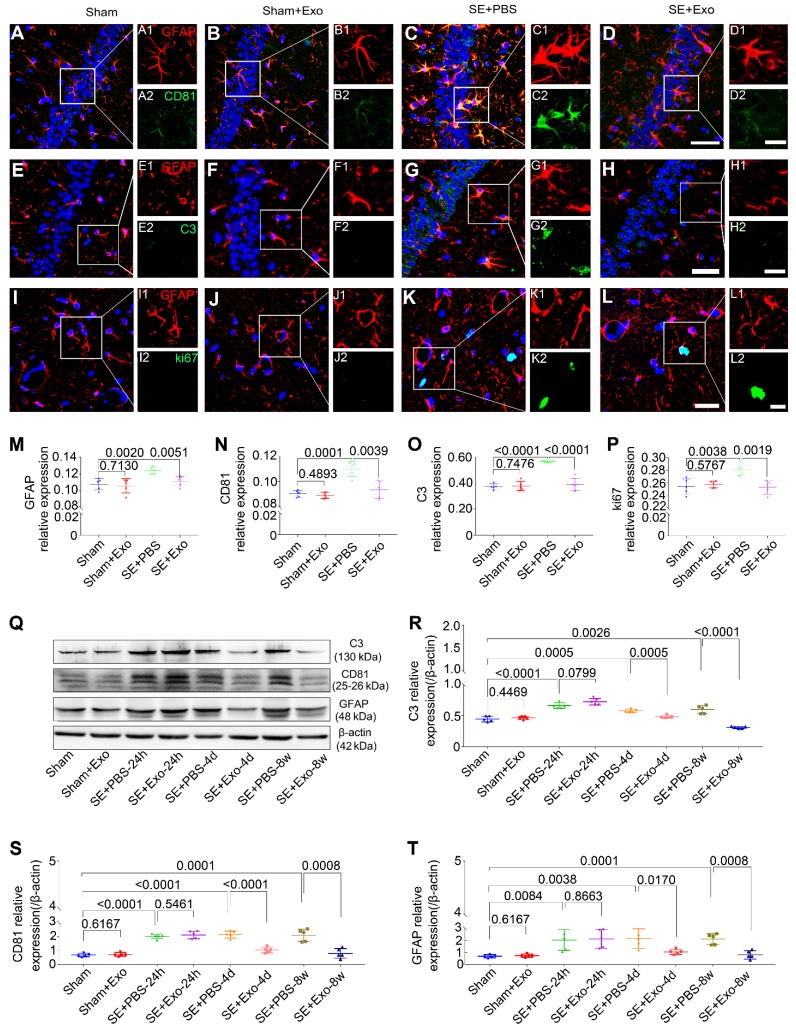
图5.侧脑室注射骨髓间充质干细胞可减轻硒诱导的小鼠海马星形胶质细胞活化。
七、骨髓MSC-Exo减轻硒(SE)诱导的小鼠海马炎症反应
为明确MSC-Exo在SE模型中的抗炎作用,SE后4天收集了双侧海马组织,并进行了免疫组化、ELISA和qPCR检测。结果显示,除了星形胶质细胞外,小胶质细胞还可以分泌炎性细胞因子如TNFα,IL-1β和IL-6(图6A-L)。双重免疫染色结果显示,GFAP与TNFα和IL-1β共表达(图6A-D),毛果芸香碱注射后TNFα和IL-1β的荧光强度显着增加(图6E-F ),而MSC-Exo处理与SE + PBS组相比降低了它们的表达水平(图6E-F)。在海马促炎细胞因子TNFα(图6G)和IL-1β(图6H)的浓度下显着增加,但IL-6显示增加相比于假手术组(图5I)。与SE+PBS组相比,MSC-Exo处理显着降低了促炎细胞因子TNFα(图6G)和IL-1β(图6H)的产生。qPCR检测在海马中的TNFα,IL-1β和IL-6(图6J-L)基因表达,结果与假手术组比,毛果芸香碱治疗可极显著提高海马TNFα和IL-1β基因的表达(图6J,K),而MSC-Exo给药与假手术组相比显着降低TNFα和IL-1βRNA的水平。 SE +PBS组(图6J,K)。在qPCR测定的IL-6表达中,假手术和Sham + Exo组之间无差异,这与ELISA结果一致(图6I,L)。这些数据表明,MSC-Exo可以减轻SE诱导的小鼠海马炎症反应。
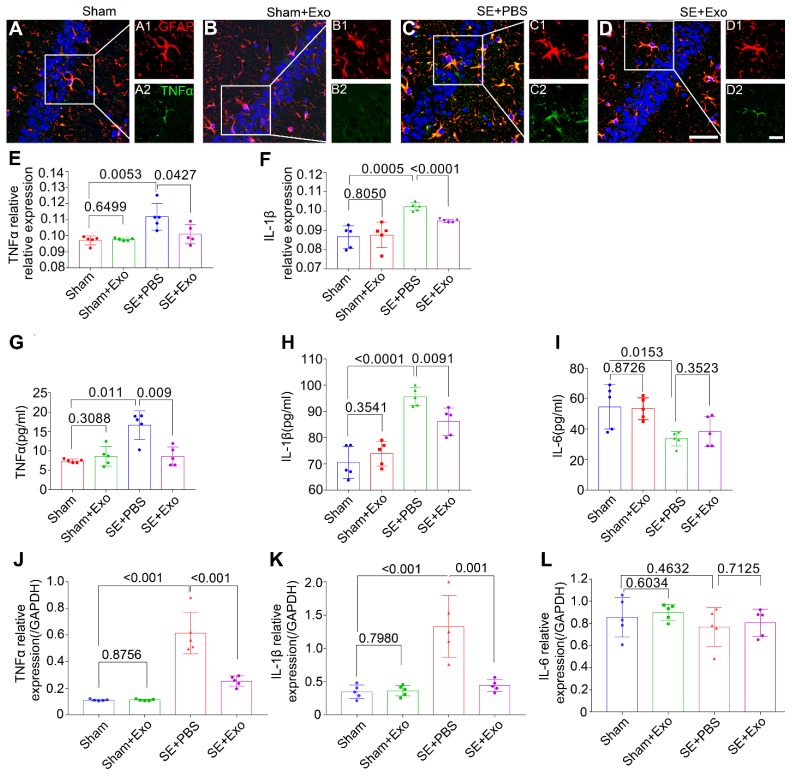
图6.骨髓MSC-Exo注射减轻了硒诱导的海马炎症反应。
八、MSC-Exo处理可通过Nrf2-NF-κB信号传导通路恢复SE诱导的海马星形胶质细胞活化
为了研究Nrf2-NF-κB信号通路是否参与星形胶质细胞激活的抑制,免疫印迹和免疫组化用来检测硒诱导后4 d的海马组织。毛果芸香碱处理可显着增加海马中GFAP,Nrf2,p-P65/P-65和HO-1的表达,但会降低Keap1的表达(图7D-E),促进了SE小鼠中Nrf2(图7B)和P-65(图7C)的核易位。MSC-Exo处理(SE + Exo组)与PBS(SE + PBS组)的比较显示,MSC-Exo可以逆转氧化(图7B,E和F)和炎症表型(图7C,G和H)。无显着差异Sham+ Exo和假手术组表明,单独进行MSC-Exo处理不会改变与这些表型相关的标志物的表达(图7D-H)。
为探索体内抑制星形胶质细胞活化的Nrf2-NF-κB信号通路的机制,使用了Nrf2抑制剂ML385。蛋白质测定法显示,用ML385处理的小鼠的Keap1,HO-1,Nrf2和p-P65/P-65表达显着降低(图7D-H)。尽管这些标记在SE诱导后被极显著上调(图7D-F和H),但ML385 + SE + PBS和ML385 + SE + Exo组之间未观察到显着差异(图7D-F和H)。此外,与Sham或Vehicle组相比,Nrf2抑制导致GFAP表达增加(图7G),而用MSC-Exo处理的ML385 + SE + Exo组则不存在表达差异(图7G)。结果表明,MSC-Exo处理可以通过Nrf2-NF-κB信号通路恢复LPS和SE诱导的小鼠海马星形胶质细胞活化。
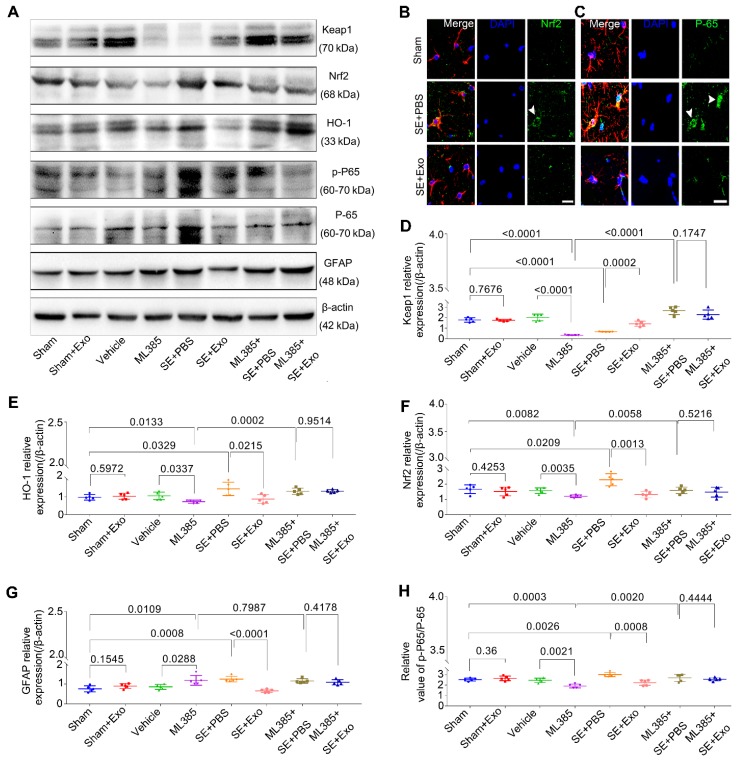
图7.ML385 (Nrf2抑制剂)注射逆转骨髓MSC-Exo对海马星形胶质细胞活化的抑制作用体内。
九、MSC-Exo治疗可恢复SE诱导的学习和记忆障碍
莫里斯水迷宫实验进行了SE诱导的行为效应分析。重复测量的方差分析显示各组之间的第一次学习时间无差异。在隐藏平台任务中,与假手术组相比,SE小鼠的逃避潜伏期显着减少 (图8A)。给予MSC-Exo可逆转这种趋势(图8A)。24h后,通过记录在目标象限中花费的时间并计算平台穿越次数来测试每组中的检索差异。与假手术组相比,SE小鼠在目标象限(PT)和平台交叉点中的总游泳距离明显降低(图8B和C)。 SE+Exo组的学习和记忆障碍的显著减少表现为与目标象限(图8B)和平台交叉点(图8C)相比,SE+PBS组花费的时间百分比增加了,两组之间的游泳速度没有差异(图8D)。

图8.骨髓MSC-Exo治疗改善了硒诱导的小鼠学习和记忆障碍。
结 论:
骨髓MSC-Exo改善炎症诱导的星形胶质细胞改变,并且Nrf2-NF-κB信号通路参与调节小鼠星形胶质细胞的活化。这些数据表明,骨髓MSC-Exo作为纳米治疗剂在治疗海马星形胶质细胞改变的神经系统疾病方面具有很大的潜力。






