CircRNA调控组蛋白修饰在胃癌中的研究
胃癌是最常见的恶性肿瘤之一,迫切需要更有效的生物标志物和靶标以进行更好的诊断和治疗胃癌。circRNA可作为癌症的潜在诊断生物标志物,并代表新的治疗目标。今日这篇文章和大家一起探索circRNA在胃癌中的功能和潜在机制。
技术路线:

结 果:
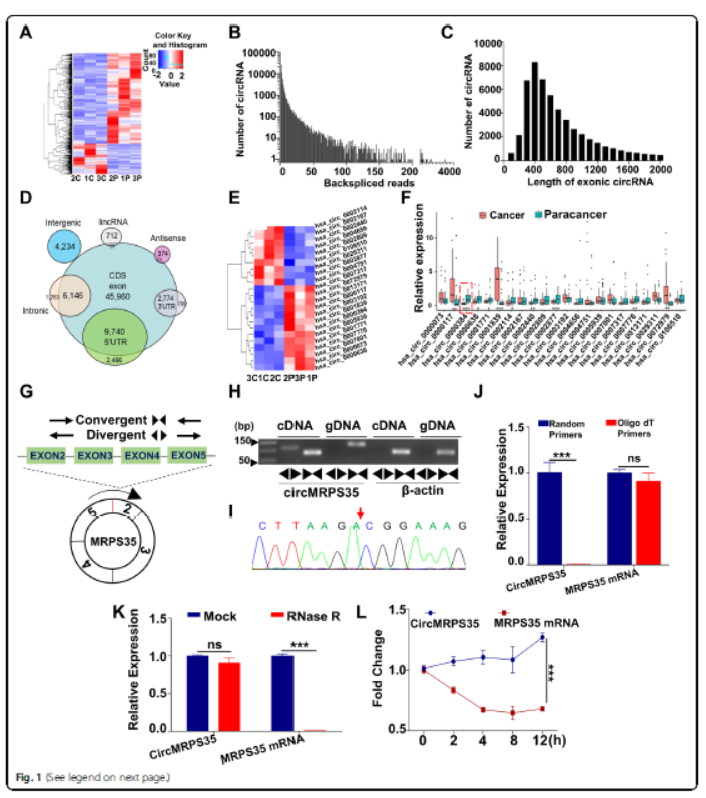
1.人胃癌组织中环状RNA (circMRPS35)的鉴定与验证
RNA测序分析癌组织和邻近的正常组织中circRNA表达,13个circRNA在胃癌中明显下调,有9个上调。在30对胃癌和邻近正常组织中验证表达,发现源自MRPS35基因的circ_0000384差异最显著。发散和聚合引物PCR扩增以及Sanger测序证实circRNA的环状结构,circMRPS35具有更高的RNA酶抵抗力,转录抑制剂Dactinomycin D处理后circMRPS35比MRPS35 mRNA稳定。以上表明,circMRPS35是在胃癌组织中低表达的稳定circRNA。
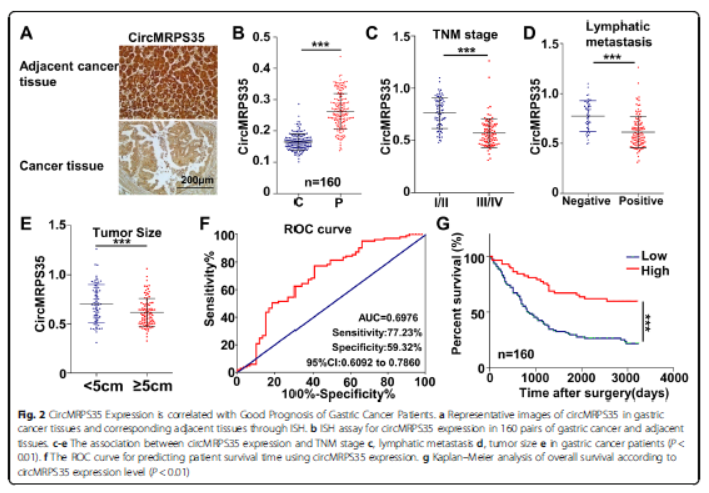
2.CircMRPS35表达与胃癌的良好预后相关
circMRPS35在胃癌组织的表达显著减少,circMRPS35的表达水平与晚期肿瘤结转移(TNM)分期、淋巴转移和肿瘤大小呈负相关,ROC曲线分析表明circMRPS35可用于预测患者的预后。
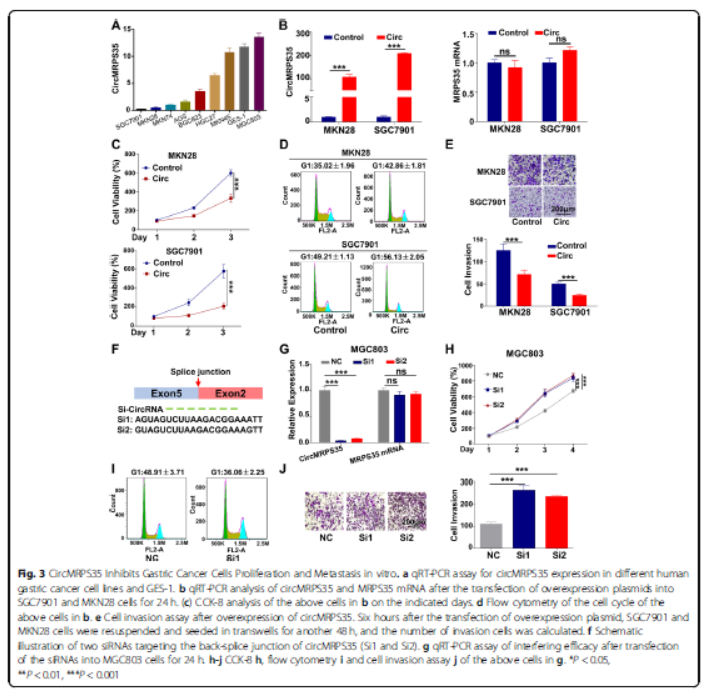
3.体外CircMRPS35抑制胃癌细胞的增殖和转移
为评估circMRPS35的功能,分析circMRPS35在各种人类胃癌细胞系和GES-1细胞的表达。发现circMRPS35水平在SGC7901和MKN28细胞中较低。质粒pCDH-CMVCircMRPS35转染后,明显增加,在SGC7901和MKN28细胞中过表达CircMRPS35,抑制细胞生长并诱导细胞周期停滞在G1期,抑制细胞侵袭。siRNA抑制circMRPS35表达,明显促进细胞增殖、细胞周期加速和侵袭。这些结果验证circMRPS35可以调节体外培养胃癌细胞的行为。
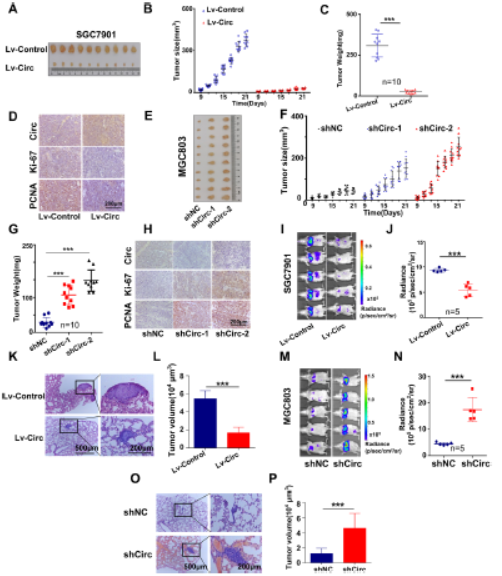
4.体内CircMRPS35抑制癌细胞的生长和转移
在体内,circMRPS35降低异种移植小鼠模型中的肿瘤生长和重量,circMRPS35过表达的肿瘤中Ki-67和PCNA降低,裸鼠肺中的转移灶降低。shRNA慢病毒抑制CircMRPS35则增加了肿瘤的生长、肿瘤的重量以及Ki-67和PCNA的表达,增加裸鼠肺部转移灶的数量。
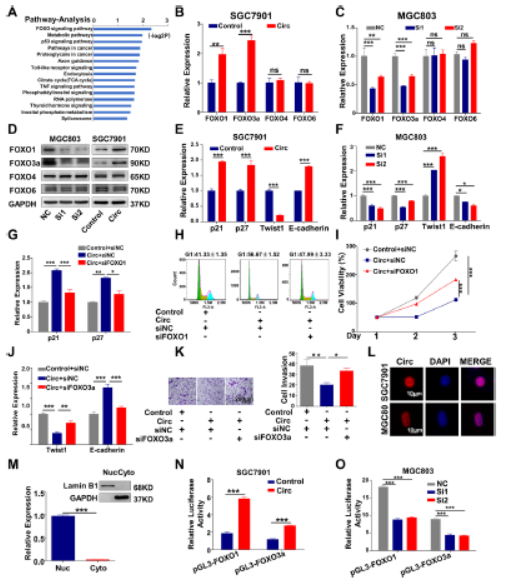
5.CircMRPS35通过FOXO1和FOXO3a的转录激活抑制胃癌进展
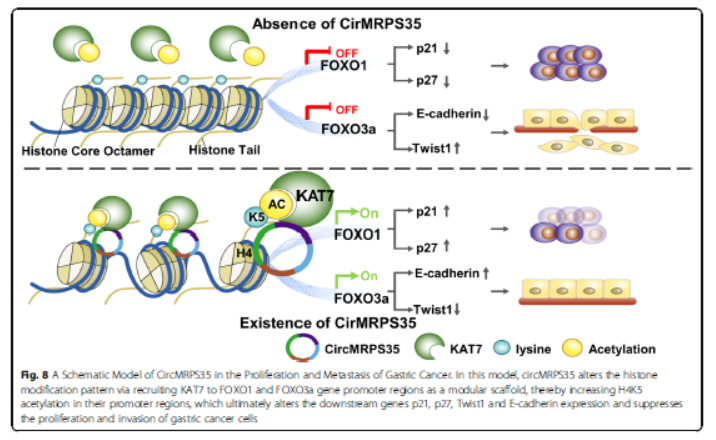
circMRPS35敲低后进行RNA序列,GO和KEGG分析表明FOXO信号是circMRPS35参与癌症调节最相关的信号。FOXO家族是进化保守的,包括FOXO1,FOXO3a,FOXO4和FOXO6四个成员。circMRPS35增加FOXO1和FOXO3a的mRNA和蛋白质水平,CircMRPS35敲低对FOXO1和FOXO3a的磷酸化没有影响。circMRPS35改变FOXO1和FOXO3a的靶基因(p21,p27,Twist1,E-cadherin)的表达,FOXO1的减少显著减弱circMRPS35的促进p21和p27表达,挽救细胞周期停滞并抑制细胞增殖。荧光原位杂交表明circMRPS35主要位于细胞核内,circMRPS35增强FOXO1和FOXO3a的启动子活性。总而言之,circMRPS35通过转录激活FOXO1和FOXO3a抑制胃癌细胞的行为。
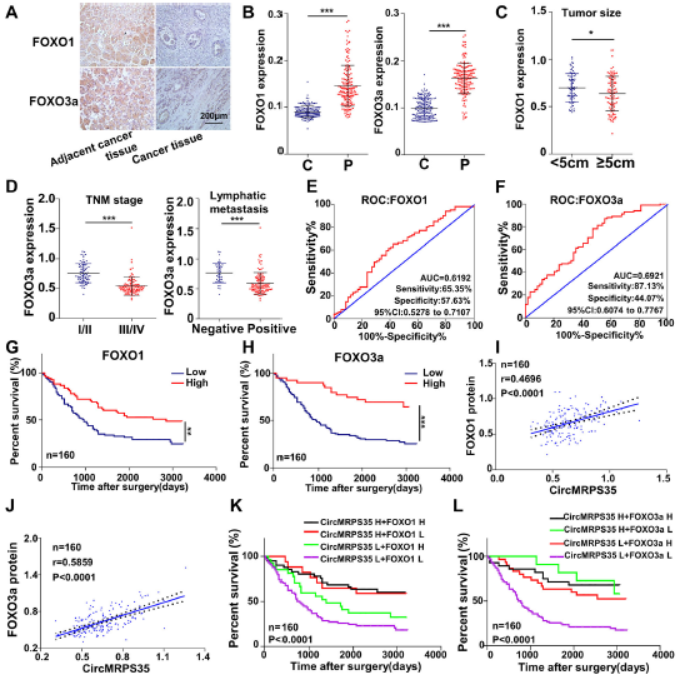
6.CircMRPS35的表达与胃癌组织中的FOXO3a和FOXO1对应
胃癌组织中FOXO1或FOXO3a表达均显著下降,FOXO1的表达与呈肿瘤大小负相关,FOXO3a表达与晚期TNM阶段、淋巴结转移呈负相关。ROC曲线表明FOXO1和FOXO3a表达可用于预测患者的预后。FOXO1或FOXO3a的低表达与胃癌患者的不良生存密切相关,FOXO1和FOXO3a表达与circMRPS35呈正相关。这些表明circMRPS35介导的FOXO1和FOXO3a信号在胃癌中起关键作用。
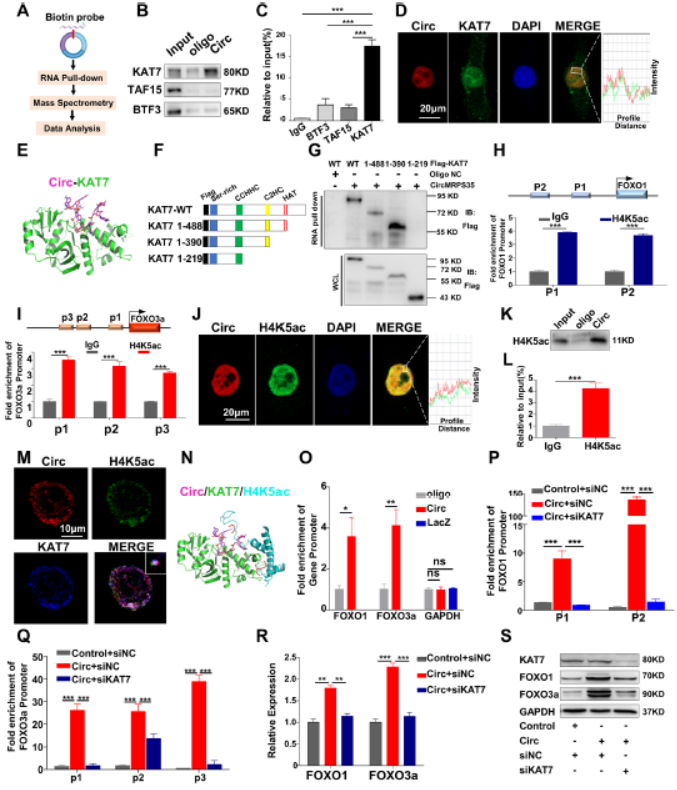
7.CircMRPS35招募KAT7到FOXO1和FOXO3a基因的启动子
进一步研究circMRPS35激活FOXO1和FOXO3a转录的机制,细胞裂解物与生物素化circMRPS35探针孵育,RNA下拉测定和质谱分析参与转录调控的蛋白质KAT7。在MGC803细胞核中circMRPS35 与KAT7共定位,circMRPS35片段形成多个氢键与KAT7残基相互作用,KAT7(256-315aa)C2H2域对与circMRPS35的相互作用至关重要。FOXO1和FOXO3a启动子区域中H4K5ac,H4K12ac和H3K14ac的表达富集,ChIP证明只有H4K5ac结合到FOXO3a和FOXO1的启动子区域,RNA下拉和RIP证明H4K5ac与circMRPS35特异性相互作用,circMRPS35与KAT7和H4K5ac表明circMRPS35与H4K5ac和KAT7相互作用形成三聚体。在circMRPS35 /KAT7/H4K5ac的复合物中,H4K5ac残基77-84停靠KAT7形成的口袋中,H4K5ac具有α-螺旋基序的残基54–77与KAT7的563-576位残基相互作用,circMRPS35直接与FOXO1和FOXO3a启动子区域结合。以上表明circMRPS35将KAT7募集到FOXO1和FOXO3a的启动子。KAT7的敲低减弱circMRPS35增加的FOXO1和FOXO3a基因启动子处H4K5ac水平,敲低KAT7大大降低circMRPS35诱导的FOXO1和FOXO3amRNA和蛋白质表达。以上表明,circMRPS35通过招募KAT7增加了FOXO1和FOXO3a启动子区域中的H4K5的乙酰化水平。