凋亡与铁死亡的碰撞
铁死亡是铁依赖的非凋亡形式的细胞死亡方式,涉及各种人类疾病。p53是一种肿瘤抑制因子,可被凋亡刺激蛋白刺激,诱导细胞凋亡和铁死亡以应对DNA损伤反应。凋亡和铁死亡的碰撞有此开始,各位看官别走开,这里很精彩。

思 路:

结 果:
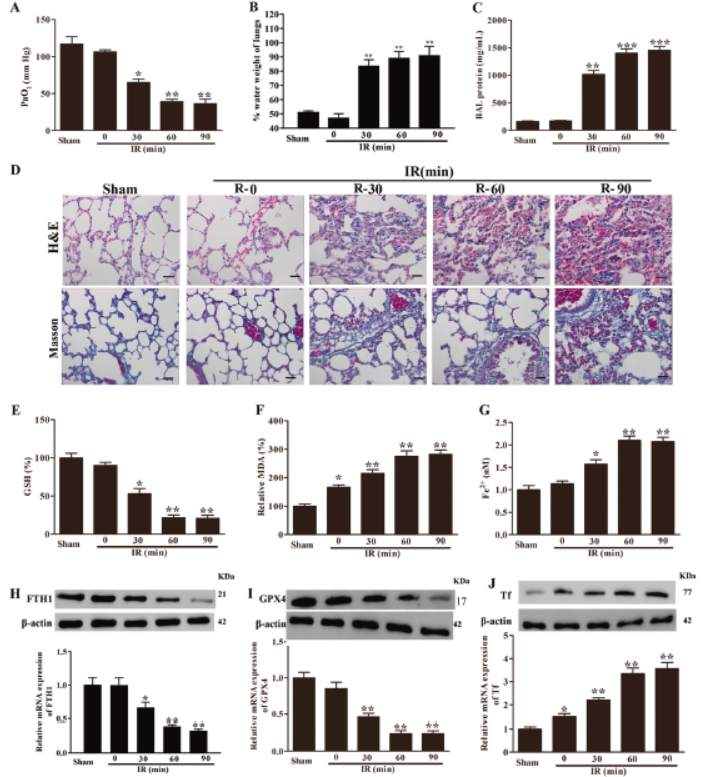
1.体内肠缺血/再灌注(I / R)诱导的急性肺损伤(ALI)促进铁死亡
I / R诱导小鼠ALI,动脉血PaO2降低,肺含水量和BALF蛋白含量升高。肺部HE染色显示,I / R持续时间延长,水肿、肺不张、坏死、肺泡和间质发炎、出血和透明膜形成加剧,更多的胶原蛋白沉积,GSH百分比显著降低,MDA和Fe2+百分比显著升高。同时,铁死亡标志物FTH1和GPX4的表达减少,TF增加。
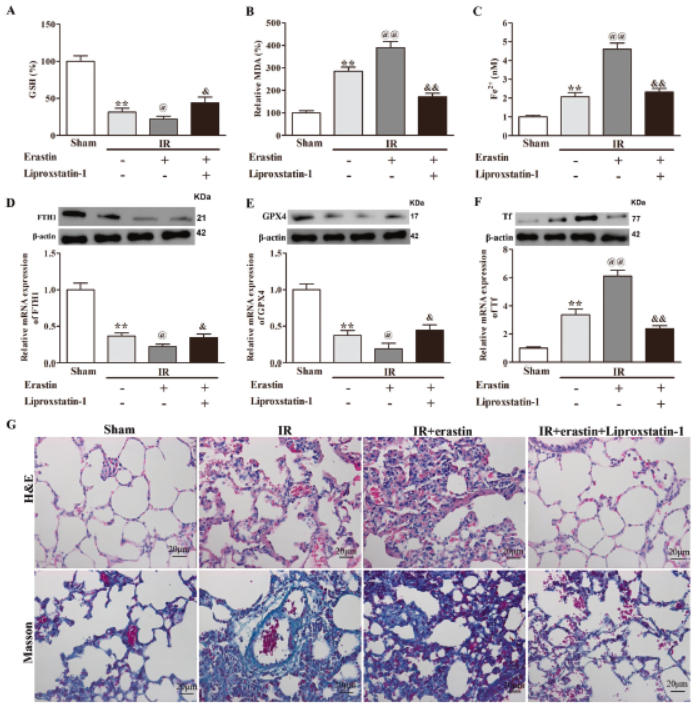
2.体内Erastin诱导的铁死亡促进肠道I / R诱导ALI
Erastin处理I / R小鼠显著增加MDA、Fe2+含量和TF的蛋白质/ mRNA水平,降低GSH百分比、FTH1和GPX4的蛋白质/ mRNA水平。但这些作用铁死亡抑制剂liproxstatin-1逆转。肺组织病理分析显示liproxstatin-1逆转Erastin的加重病理功能。
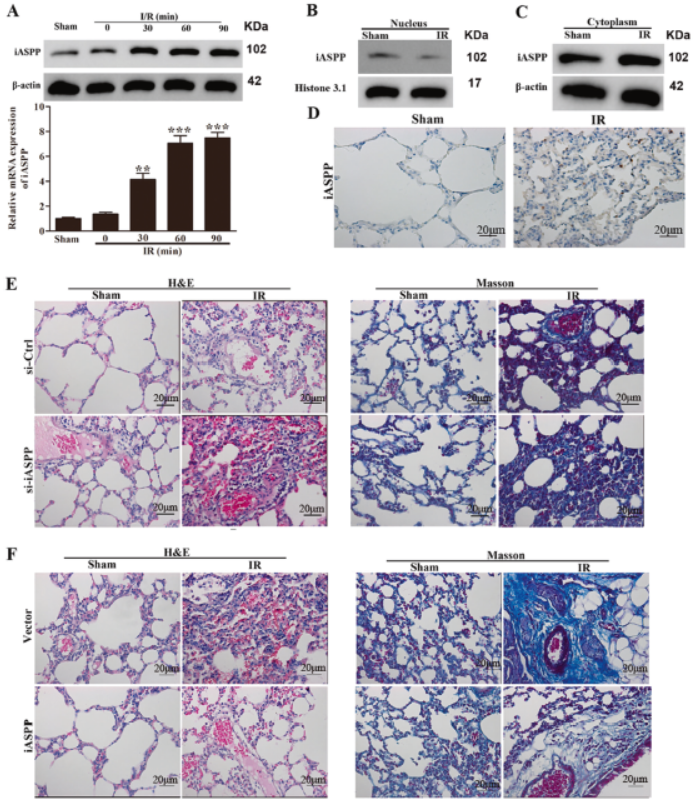
3. p53促凋亡蛋白抑制剂(iASPP)敲低可促进肠I / R诱导ALI
iASPP在肺组织中的表达随I / R持续时间增加。I / R60分钟后,细胞核中iASPP蛋白增加减少,细胞质中的含量增加。敲低iASPP可加重肺部病理,而过表达则逆转这种效应。这些表明,iASPP缺乏增加肺组织损伤的敏感性。
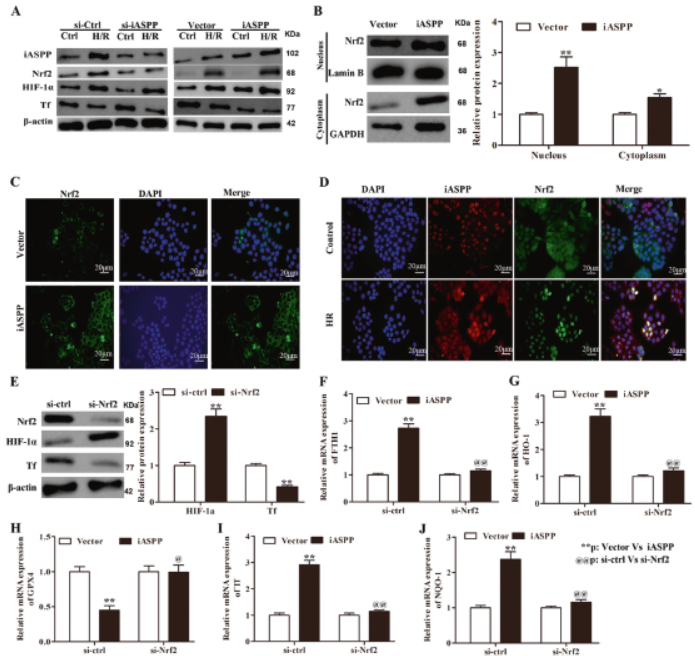
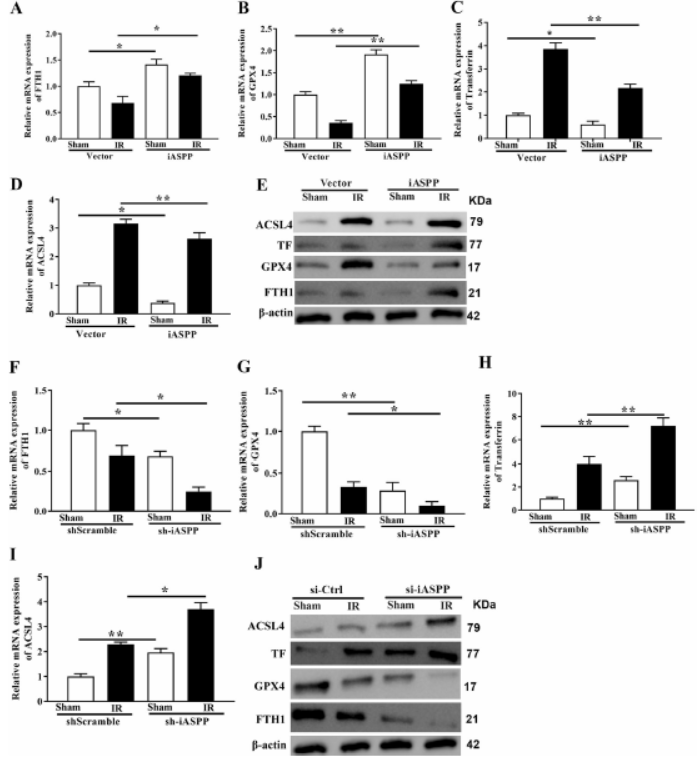
4. iASPP过表达抑制铁死亡,而iASPP敲低促进铁死亡
评估I / R后iASPP腺病毒转染小鼠的铁死亡水平,发现FTH1和GPX4表达升高,TF和ACSL4明显降低,表明铁死亡增加。敲低iASPP有相反效果,表明iASPP的表达对体内ALI诱导的铁死亡程度至关重要。
5. iASPP介导的肠I / R诱导ALI依赖于体内的Nrf2信号传导
接下来,研究Nrf2缺乏是否会改变I / R对ALI的影响。iASPP过表达对Nrf2 mRNA表达无影响,但导致Nrf2蛋白水平升高,iASPP抑制降低Nrf2蛋白但不降低mRNA表达。这些数据表明iASPP诱导Nrf2积累,这种作用不在转录水平发生。I / R 60分钟后WT小鼠肺中iASPP和Nrf2蛋白增加,敲低 Nrf2降低iASPP水平。组织学检查发现Nrf2-/-I / R小鼠病理加重,iASPP过表达减弱病理结果。肺组织免疫组化染色显示I / R小鼠中较高的Nrf2和iASPP水平。这些表明iASPP是维持Nrf2稳定性的关键,iASPP介导肠I / R诱导的ALI依赖于Nrf2信号传导。

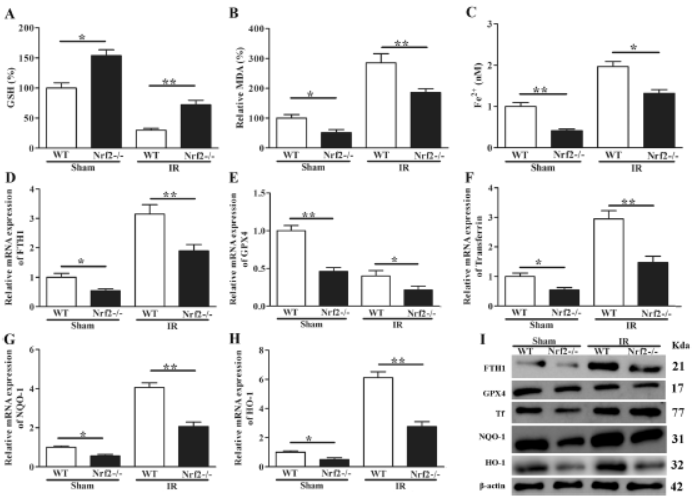
6. Nrf2-/-小鼠中肠I / R诱导的ALI增强铁死亡
Nrf2-/-小鼠中GSH百分比、,MDA和Fe2 +增加,检测铁死亡相关标志物FTH1和GPX4 、TF、NQO-1、HO-1发现Nrf2-/-小鼠铁死亡增加。
7. Nrf2缺乏会上调HIF-1α和TF,促进I / R诱导的ALI
肺组织病理评估显示I / R和Nrf2-/-小鼠中出现验证病理变化,在Nrf2-/-小鼠的BALF中IL-1β、IL-6和TNF-α水平升高,这些效应在Nrf2-/-IR中显著增强。I / R小鼠中HIF-1α和TF的mRNA /蛋白表达升高,敲低Nrf2后表达更高。这些证明Nrf2表达对于体内I / R诱导的ALI至关重要。

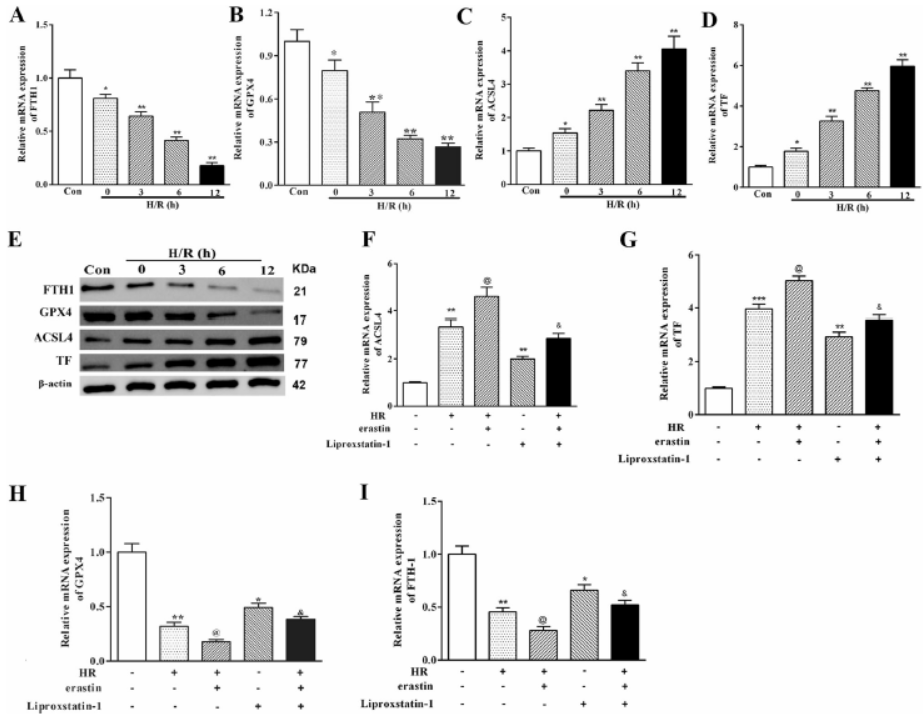
8. MLE-2细胞中低氧诱导的ALI促进铁死亡
MLE-2细胞中低氧诱导导致GPX4和FTH1表达下降,而ACSL4和TF明显增加,加入Estinin后效果更强,而加入liproxstatin-1逆转Estinin效应至单独低氧处理组。
9. iASPP通过Nrf2 /HIF-1α/ TF途径方式缓解ALI和铁死亡
低氧处理MLE-2细胞中iASPP、Nrf2和HIF-1α的蛋白质水平增加,在敲低iASPP后降低,iASPP过表达细胞核中Nrf2水平增加。·si-Nrf2处理的MLE-2细胞HIF-1α的水平较高,而Nrf2和TF含量较低。细胞过表达iASPP后FTH1、HO-1、TF和NQO-1增加,GPX4减少,,但这些作用可被si-Nrf2逆转。这些表明iASPP通过Nrf2 /HIF-1α/ TF途径缓解了ALI和铁死亡。