CircSHKBP1——一种很有前途的胃癌诊断和预后的循环生物标志物
CircRNAs在多种癌症的发生发展中起着重要的调控作用。然而,circRNAs在胃癌(GC)中的生物学功能及其分子机制尚不清楚。circRNAs是一类由反分裂产生的ncRNA,其环结构使其更加稳定。研究表明,circRNAs在外泌体中稳定富集。外泌体是大多数细胞分泌的纳米级胞外囊泡,含有丰富的RNA和蛋白质,可以调节细胞的生物学过程,作为鉴定多种疾病的循环生物标志物,已证实血清外泌体circRNA能将癌症患者与健康对照者区分开来,外泌体circRNA可以作为液体活检的生物标志物。在这项研究中,作者发现circSHKBP1在GC患者的肿瘤和血清外泌体中都高表达,且与晚期病理分期和较差的生存率有关。CircSHKBP1通过海绵化miR-582-3p和诱导HSP90(热休克蛋白90)促进体内外GC进展,为GC的发病机制提供了新的研究视角。
技术路线:
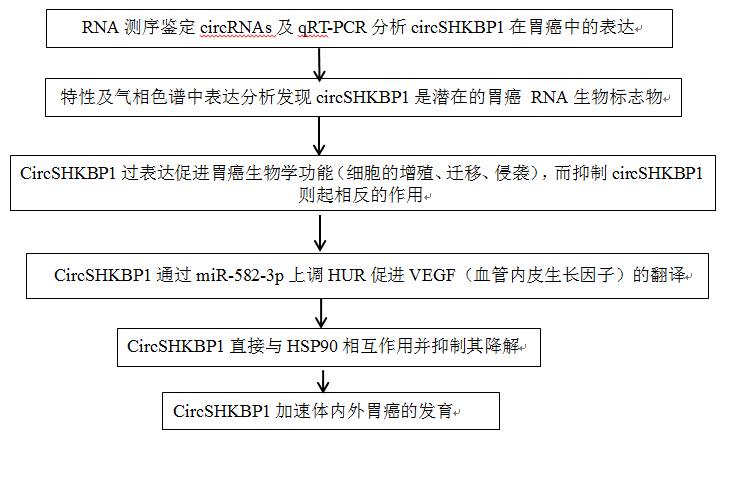
1.CircSHKBP1证实可以作为GC RNA的生物标志物
通过qRT-PCR分析,circSHKBP1是GC中表达最差的cir-cRNA,来自血清外泌体的circSHKBP1在GC患者中表达更为丰富。另外分析胃切除术(R0切除)前后血清中circSHKBP1的表达发现,发现肿瘤切除后,circSHKBP1急剧下降,这表明GC组织是外泌体circSHKBP1的起源,证实circSHKBP1是一种来源于GC组织的上调的circRNA,可以通过外泌体有效地传递到循环中。此外,circSHKBP1的高表达与胃癌的晚期TNM分期和预后差有关,是一种潜在的GC RNA生物标志物。

2.CircSHKBP1调控GC的生物学功能
circSHKBP1在4种人胃癌细胞系(BGC823、HGC27、AGS和MGC803)和正常胃上皮细胞系GES1中的表达发现,其中在BGC823和HGC27过表达。CircSHKBP1促进GC细胞的生长和转移,而沉默circSHKBP1的表达则抑制GC细胞的发育。更重要的是,随着circSHKBP1在GC细胞中的异位表达,更多的circSHKBP1被装载到外泌体中,从而干扰GC细胞的生物学功能。
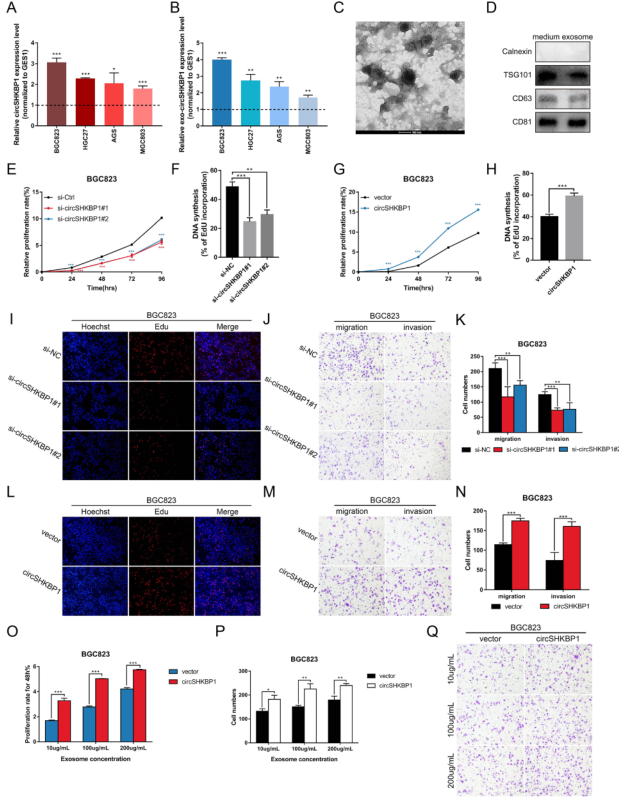
图2 CircSHKBP1在体外促进GC细胞增殖、迁移和侵袭
3.CircSHKBP1在GC中的作用机制
FISH分析和qRT-PCR分析表明,circSHKBP1优先定位于GC细胞质内。miR-582-3p被预测与circhKBP1结合,且经过试验研究发现circSHKBP1降低miR-582-3p的表达。CCK8和Transwell分析表明miR-582-3p模拟物抑制了GC细胞的增殖、迁移和侵袭,而circSHKBP1的过度表达消除了这种对GC细胞发育的抑制作用。

图3 CircSHKBP1可用作miR-582-3p的海绵。
4.CirchKBP1通过上调HUR促进VEGF分泌并诱导血管生成
通过生物信息学分析网站(TargetScan、TargetMiner和miRDB),发现了54个miR-582-3p候选靶蛋白,其中HUR和EIF2S1被作为VEGF信号通路的一部分。检测GC组织中HUR mRNA的水平发现HUR的表达与miR-582-3p呈负相关,而与circSHKBP1呈正相关。不同浓度的贝伐单抗(一种抗VEGF的抗体)处理circhKBp1过度表达的GC细胞,贝伐单抗以浓度依赖的方式处理GC细胞增殖和迁移能力减弱,试管形成试验进一步证实贝伐单抗可抑制CirchKBP1促进VEGF分泌并诱导血管生成的过程。
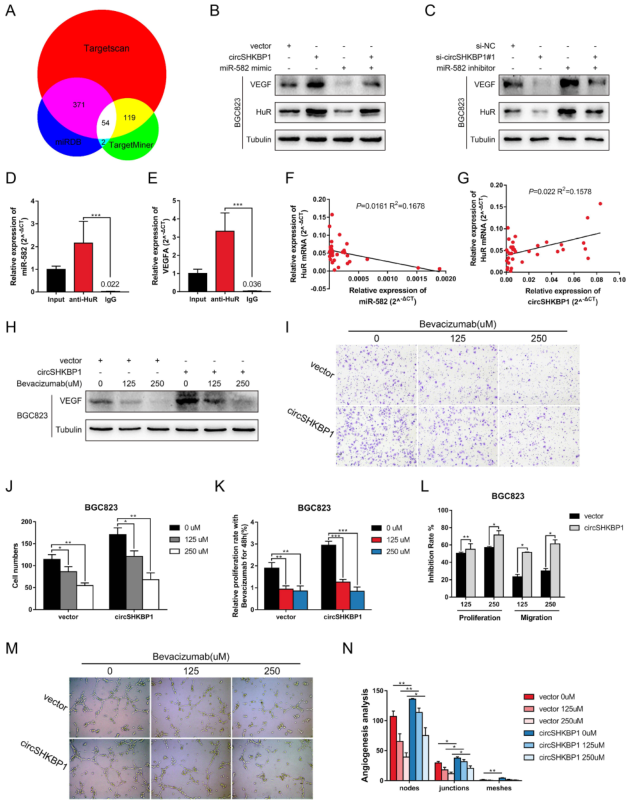
图4 CircSHKBP1通过上调HUR促进VEGF翻译
5.CircSHKBP1直接与HSP90相互作用并抑制其降解
RIP分析显示circhHKBP1同差异表达的蛋白质HSP90存在直接相互作用的关系。western blot法检测发现HSP90的降解被抑制,通过泛素连接酶STUB1抑制HSP90的泛素化。而后通过CCK8法、Transwell法评估发现circSHKBP1促进GC的发育。
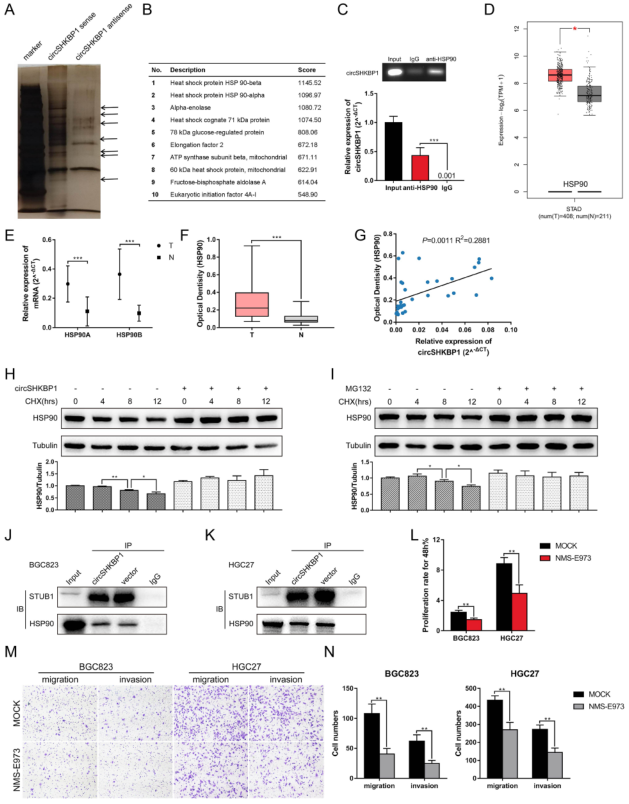
图5 CircSHKBP1与HSP90直接相互作用并抑制其降解
6.CircSHKBP1对体内GC生长起促进作用
通过慢病毒转染BGC823细胞,构建了具有稳定沉默的circSHKBP1的LV3-sh1和BGC823-LV3-sh2细胞株以及稳定过表达circSHKBP1的LV5circSHKBP1细胞系。体内试验发现circSHKBP1基因敲除可以限制肿瘤的生长,此外,贝伐单抗显著抑制肿瘤生长。western blot分析发现与LV3-NC组相比,LV3-sh1和LV3-sh2组的HUR和VEGF水平降低;与LV5-NC组相比,LV5-CirchKBP1组的HUR和VEGF增加,而VEGF被贝伐单抗抑制,肿瘤组织中HUR和VEGF的IHC结果相似。qRT-PCR分析circSHKBP1表达发现外泌体circSHKBP1的表达与癌组织circhkbp1的表达呈线性关系,证实了circSHKBP1可以通过外泌体传递到远端,且在循环中可被检测到。肿瘤中miR-582-3p的表达水平与circSHKBP1呈负相关。此外,肿瘤中CD31的IF显示贝伐单抗有效地抑制了circshKB1诱导的血管生成。
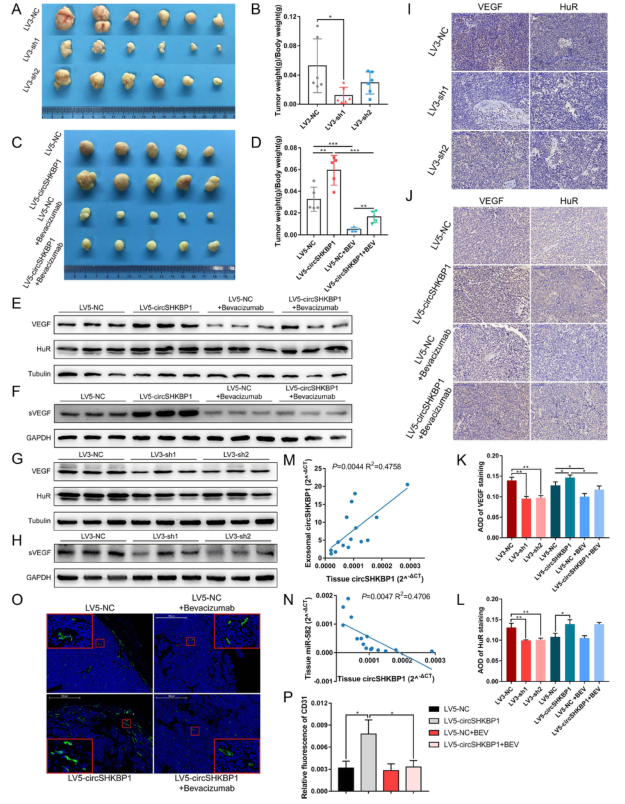
图6 CircSHKBP1促进体内GC生长
7.CircSHKBP1在体内GC转移起促进作用
研究circSHKBP1在体内的转移潜能发现,circSHKBP1基因敲除显著减少了肺转移灶的数量和大小。此外,circSHKBP1基因敲除导致GC肺转移病灶中HUR和VEGF染色明显降低,circSHKBP1的过度表达加重了肺转移病灶,HUR和VEGF染色增加,且贝伐单抗也能抑制circSHKBP1的转移潜能。
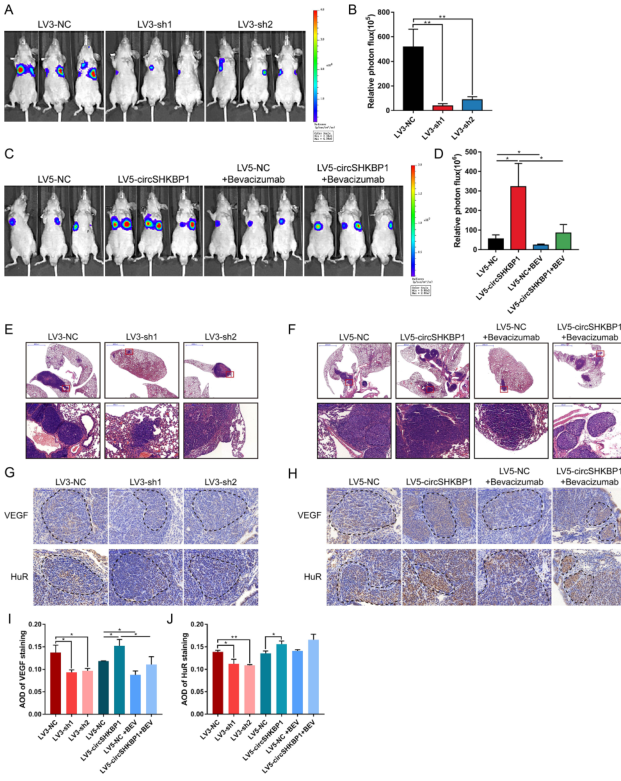
图7 CircSHKBP1促进体内GC转移
参考文献:
Xie Mengyan,Yu Tao,Jing Xinming et al. Exosomal circSHKBP1 promotes gastric cancer progression via regulating the miR-582-3p/HUR/VEGF axis and suppressing HSP90 degradation.[J].Mol. Cancer, 2020, 19: 112.






