lncRNA调节自噬促进缺血性心肌损伤
长非编码RNA(long non-coding RNAs,lncRNAs)在多种生物过程中都作为调节因子发挥作用,但针对lncRNAs在急性心肌梗死(AMI)中的作用机制尚未明确阐明。文章“LncRNA 2810403D21Rik/Mirf promotes ischemic myocardial injury by regulating autophagy through targeting Mir26a”则填补了这一领域的空缺,阐述了lncRNA2810403D21Rik/AK007586/Mirf(心肌梗死调节因子)是如何通过调节Mir26a(MicroRNA 26a)抑制细胞大自噬/自噬。

摘 要:
Mir26a被抑制在体外和体内都会导致心脏损伤,而过度表达Mir26a通过靶向Usp15(泛素特异性肽酶15)激活自噬而减轻缺血应激诱导的细胞死亡。更重要的是,2810403D21Rik/Mirf作为Mir26a的竞争性内源性RNA(Cerna);2810403D21Rik/Mirf的强制表达下调Mir26a以抑制自噬。相反,2810403D21Rik/Mirf缺失导致Mir26a上调以促进自噬并减轻心脏损伤,这反过来又改善了MI小鼠的心功能。这项研究鉴定了一个lncRNA 2810403D21Rik/Mirf,它通过对Mir26a的ceRNA活性起到抗自噬分子的作用。
技术路线:
一、 Mir26a在MI中的心脏保护作用:自噬作用
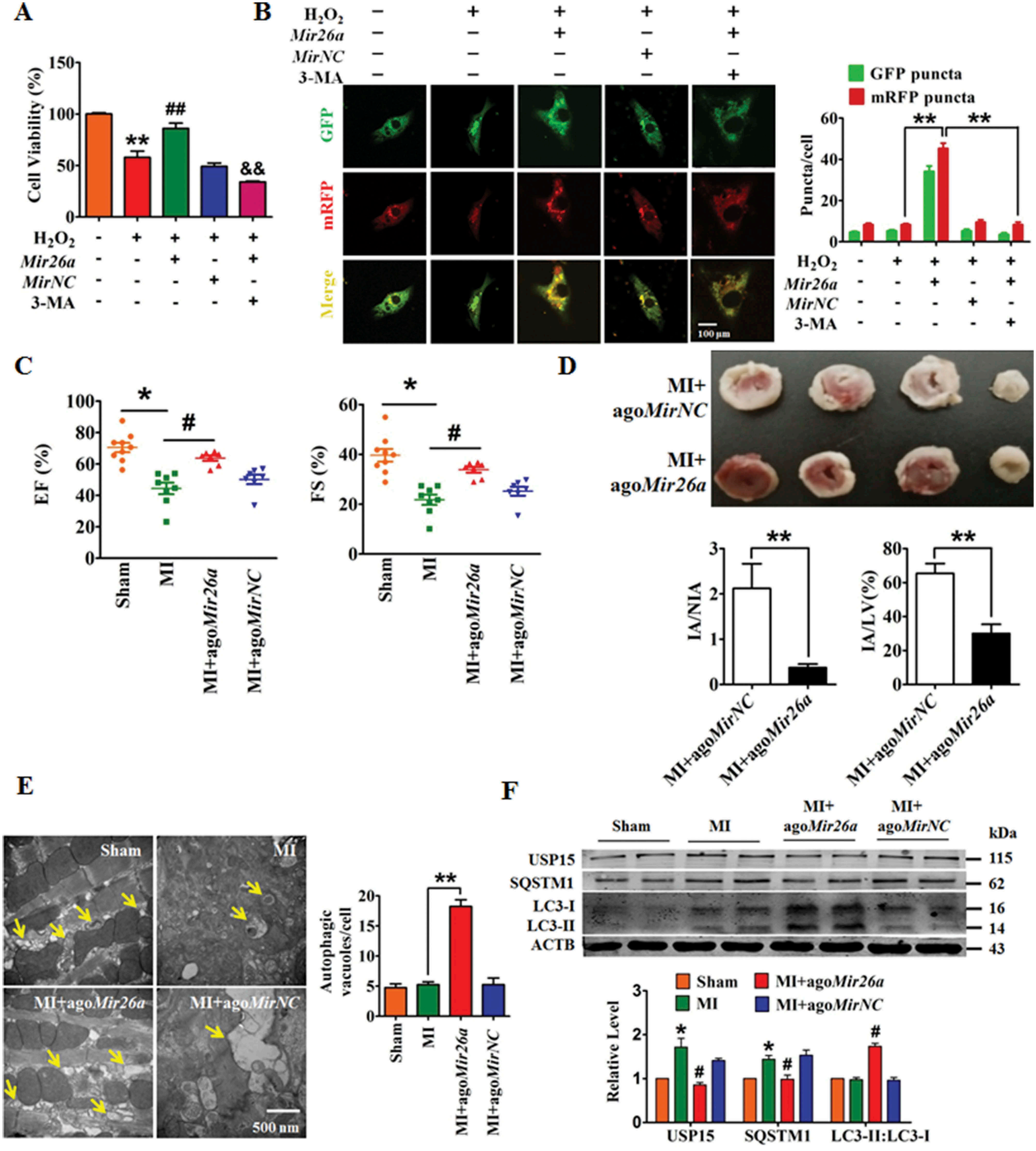
Mir26a在MI小鼠(图一A)和 H2O2处理的新生小鼠心肌细胞(NMCMs)(图一B)中减少。AMO-26a是Mir26a抑制剂,用AMO-26a转染NMCMs 24 h,然后再转染tandem-LC3构建体(GFP-MRFP-LC3)24 h,可观察到NMCM中自噬体(黄斑点)和自噬溶酶体 (红斑点)的数量减少(图一C)。Mir26a的敲低使SQSTM1/p62蛋白水平升高,LC3-II表达降低(图一D)。Mir26a海绵转基因小鼠(Mir26a KD)小鼠中Mir26a表达下调(图一E)。内源性Mir26a的沉默降低了左心室射血分数和左心室短轴缩短率(分别为EF和FS;图1F),左心室功能受损。抑制Mir26a阻碍自噬小体的形成,导致Mir26a KD小鼠心脏自噬的下调(图1G)。

将Mir26a 模拟物转染到NMCMs中,Mir26a过表达可减轻H2O2对NMCM细胞活力的抑制作用(图二A),同时可以增强促进了自噬体的形成和自噬体-溶酶体的融合(图二B),而自噬拮抗剂3-甲基腺嘌呤3-MA可以抑制这两种效应。
尾静脉注射胆固醇偶联Mir26a模拟物(AgoMir26a)到小鼠体内进行过表达,然后建立MI小鼠模型。Mir26a过表达改善了MI模型小鼠的心脏功能并缩小了梗死面积(图二C & D),增强MI小鼠的自噬活性(图二E),使MI小鼠自噬相关蛋白的异常表达正常化(图二F)。
二、心肌保护作用的信号转导机制Mir26a:Usp15的抑制
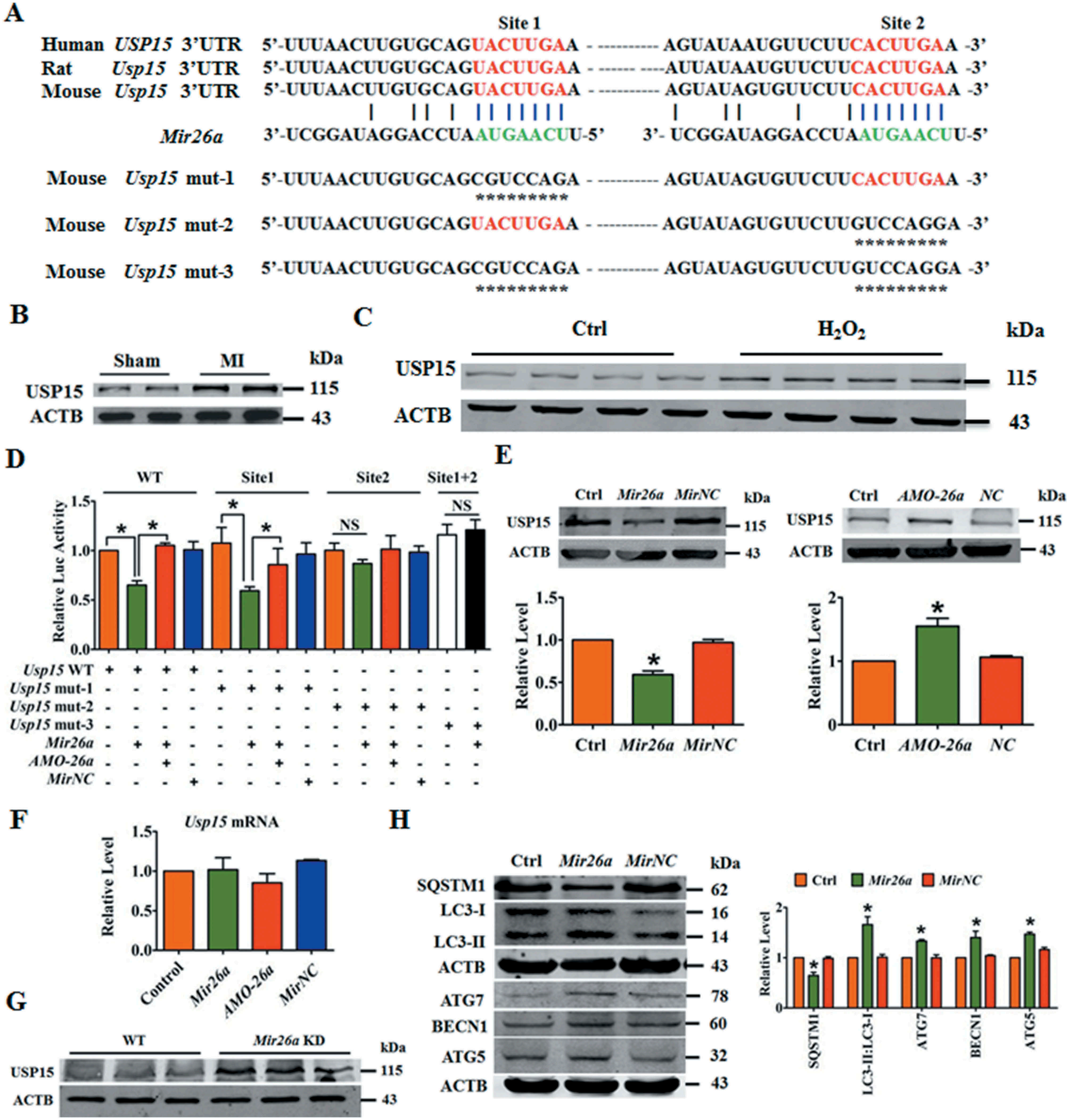
利用TargetScan miRNA数据库计算分析发现,编码Usp15的基因包含了Mir26a的种子序列,序列比对显示小鼠,大鼠和人Mir26a和Usp15基因之间的互补性,种子区中匹配的碱基对用红色和绿色标出(图三A)。
MI小鼠心脏梗死边缘区和暴露于H2O2的心肌细胞中Usp15表达呈上调(图三B,C)。构建携带野生型(WT)Mir26a结合位点或Mir26a结合位点突变版本的荧光素酶表达载体。共转染过表达Mir26a可抑制携带WT Usp15结合位点的荧光素酶载体或结合位点1突变(mut-1)的荧光素酶活性,但不抑制携带位点2突变(mut-2)或同时携带位点1和2(mut-3)的荧光素酶活性(图三D)。Mir26a降低USP15蛋白水平,AMO-26a增加USP15蛋白水平,但两者都不影响Usp15的转录(图三E & F)。Mir26aKD小鼠中USP15表达上调(图三G)。NMCMs中Mir26a的强制表达抑制了SQSTM1的表达,并促进LC3-I向LC3-II的转化(图三H)。
三、LncRNA2810403D21Rik/Mirf能够与Mir26a结合并调节其活性
使用Miranda数据库在具有Mir26a结合位点的小鼠中鉴定lncRNA,根据它们在MI小鼠中的表达谱过滤候选lncRNA,选择在MI小鼠中显著上调的lncRNA AK007586进行进一步分析,并命名为2810403D21Rik/Mirf(图四A)。
经H2O2处理后,NMCM中2810403D21Rik/Mirf的表达显著增加(图四B)。原位杂交显示2810403D21Rik/Mirf主要位于NMCM的细胞质中(图四C)。2810403D21Rik/Mirf过表达会抑制NMCM中Mir26a的表达(图四D),而ShRNA沉默2810403D21Rik/Mirf则导致Mir26a上调(图四E)。
构建包含2810403D21Rik/Mirf序列片段的Mir26a传感器荧光素酶载体,此序列包括并入荧光素酶基因的3‘-UTR中的Mir26a结合位点(图四F)。2810403D21Rik/Mirf的过表达增加了荧光素酶的活性,使其沉默则具有相反的效果(图四G)。Mir26a显著抑制传感器载体的荧光素酶活性,这种抑制可被WT 2810403D21Rik/Mirf的共表达缓解,而mut-2810403D21Rik/Mirf不能(图四H)。过表达Mir26a抑制WT 2810403D21Rik/Mirf荧光素酶载体的荧光素酶活性,但不抑制mut-2810403D21Rik/Mirf荧光素酶载体的荧光素酶活性(图四I)。
构建生物素标记的2810403D21Rik/Mirf特异性探针,并进行RNA亲和分离实验,miRNA、miRNA靶RNA和AGO2形成RNA诱导沉默复合物(RISC)介导miRNA诱导的基因沉默。RNA亲和分离实验显示2810403D21Rik/Mirf与AGO2相互作用(图四J),qRT-PCR显示2810403D21Rik/Mirf与Mir26a结合(图四K)。将生物素化的Mir26a转染心肌细胞用于基于生物素的亲和分离实验,发现2810403D21Rik/Mirf被Mir26a拉下(图四L & M)。综上所述,这些结果表明2810403D21Rik/Mirf直接与Mir26a和AGO2相互作用形成RISC,并调节Mir26a的表达和活性。

四、lncRNA2810403D21Rik/Mirf作为经由Mir26a-Usp15轴的自噬调节因子
用2810403D21Rik/Mirf转染NMCMs。2810403D21Rik/Mirf过表达降低NMCMs的活性,加重H2O2诱导的NMCMs心肌损伤,而Mir26a可部分缓解这种影响(图5A,B)。2810403D21Rik/Mirf的强制表达减少了NMCM中自噬小体和自溶酶体的数量(图5C)。2810403D21Rik/Mirf过表达增加了SQSTM1的表达,并抑制了LC3-II,ATG7,BECN1和ATG5的表达(图5D)。强制表达Mir26a减轻2810403D21Rik/Mirf对自噬的抑制(图5C,D)。这些结果表明,2810403D21Rik/Mirf限制了Mir26a/Usp15轴的功能,从而抑制自噬并通过减轻固有的心脏保护活动引起心肌损伤。

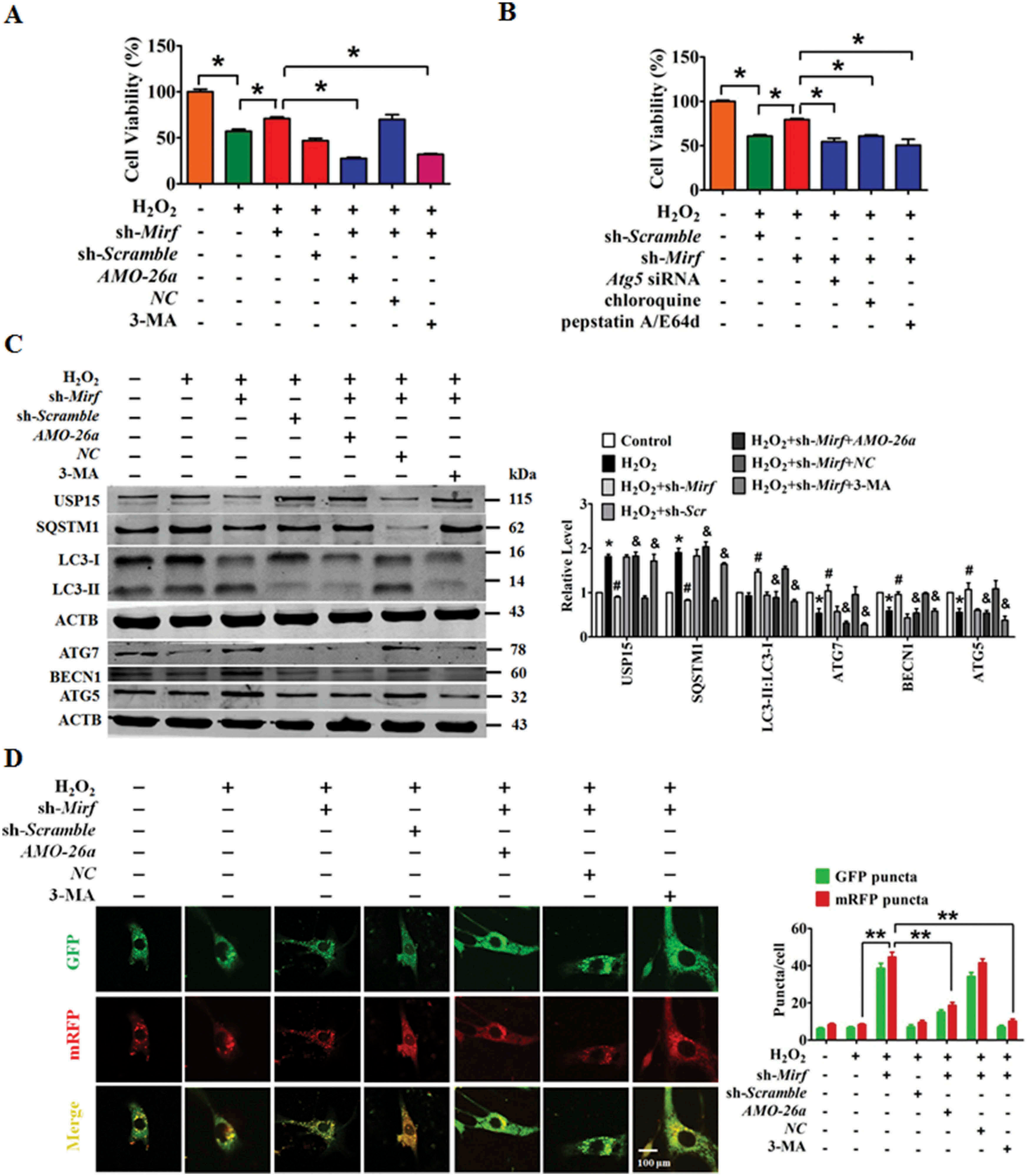
沉默2810403D21Rik/Mirf可减轻H2O2诱导的心肌损伤,这一作用可被AMO-26a敲除Mir26a或3-MA抑制NMCM中的自噬而逆转(图六A)。使用si-ATG5、氯喹或Pepstatin A/E64d阻断自噬可恢复2810403D21Rik/Mirf沉默在H2O2处理的NMCM中的促存活效应(图六B)。western blot显示可恢复H2O2诱导的自噬相关蛋白的异常表达,这些调节变化通过添加AMO-26a或3-MA而减弱(图六C)。2810403D21Rik/Mirf沉默减轻了H2O2诱导的NMCM中自噬的抑制,通过添加Mir26a抑制剂或3-MA有效地恢复了抑制(图6D)。这些数据表明2810403D21Rik/Mirf沉默通过激活Mir26a和自噬保护H2O2诱导的心肌细胞损伤。
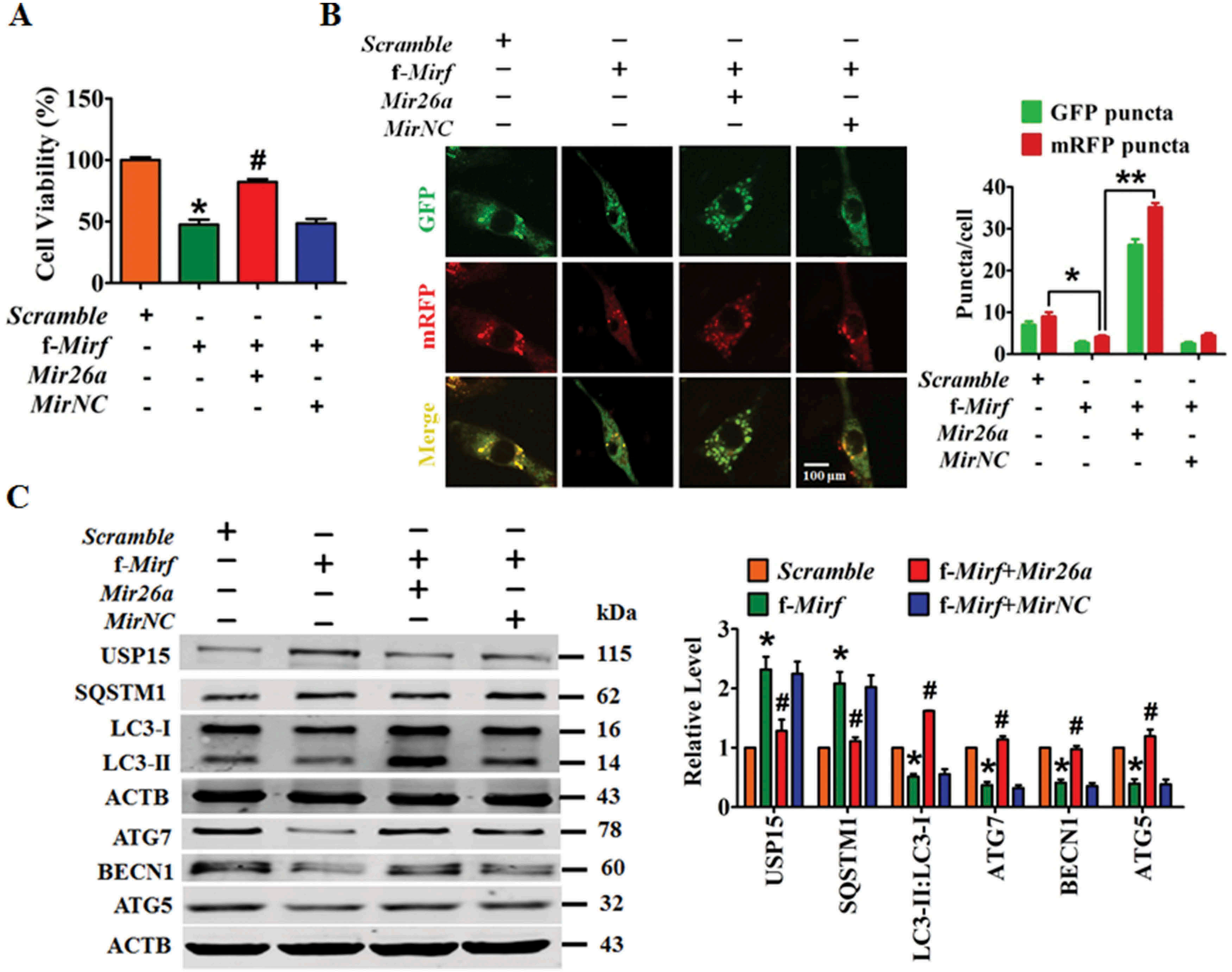
f-2810403D21Rik/Mirf(含有Mir26a结合位点的2810403D21Rik/Mirf序列的25nt片段)的引入可抑制NMCM的活力,这种作用被Mir26a消除(图七A)。f-2810403D21Rik/Mirf在NMCM中具有抗自噬作用,可以通过引入Mir26a来消除(图七B)。f-2810403D21Rik/Mirf的强制表达通过调节Mir26a干扰自噬相关蛋白的表达,这些效应几乎被Mir26a完全逆转(图七C)。这些结果表明f-2810403D21Rik/Mirf可以模拟2810403D21Rik/Mirf对自噬和细胞损伤的作用,表明Mir26a结合位点是2810403D21Rik/Mirf的功能域。
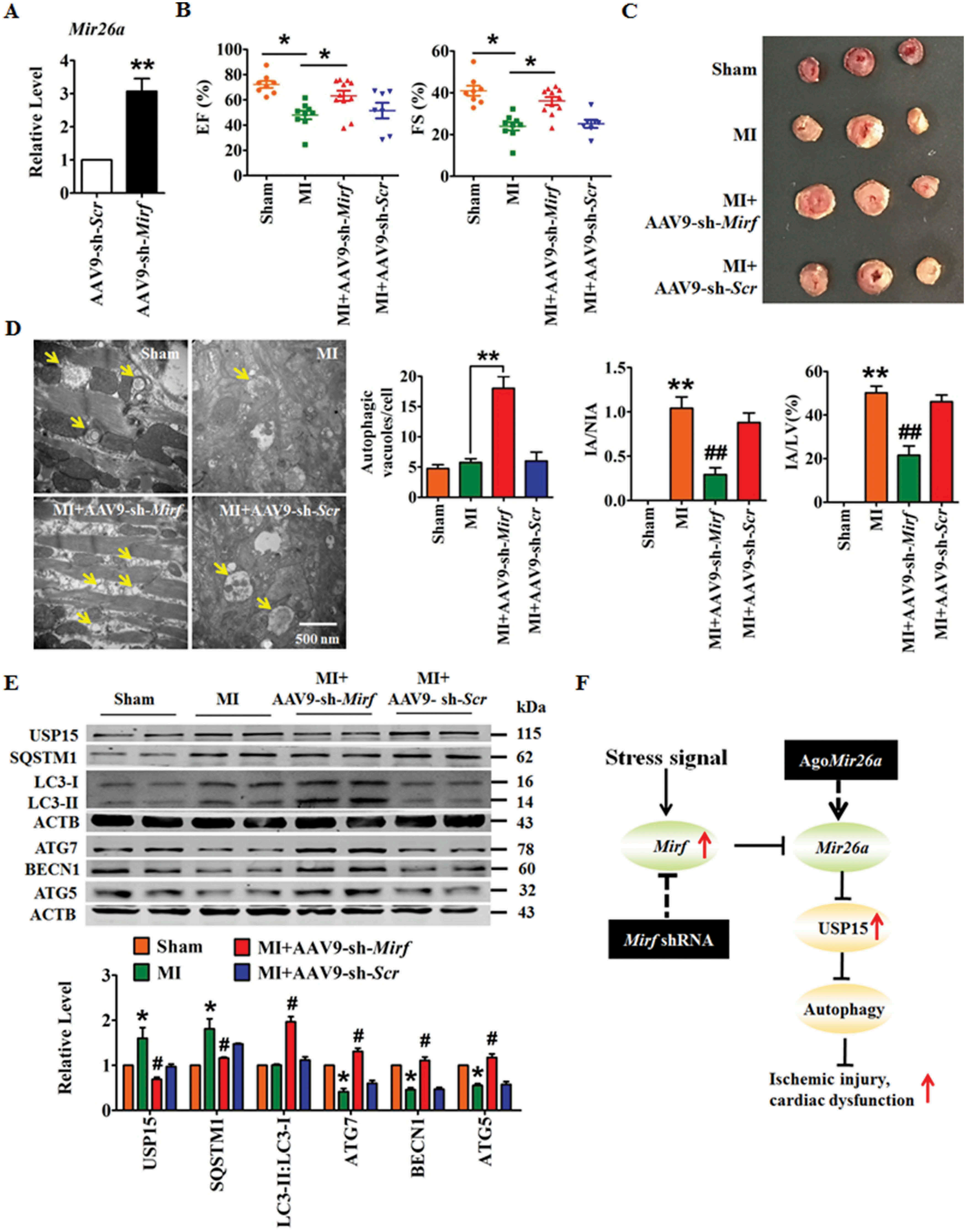
五、沉默2810403D21Rik/Mirf减轻心肌损伤并保护心肌梗死小鼠的心功能
将携带2810403D21Rik/Mirf特异性shRNA的腺病毒相关病毒(AAV)-9注射到小鼠体内,以评估2810403D21Rik/Mirf抑制对心脏损害的影响。抑制2810403D21Rik/Mirf后WT小鼠心脏中Mir26a的表达上调(图八A)。
敲除2810403D21Rik/Mirf在WT小鼠中诱导Mir26a上调(图8A)。2810403D21Rik/Mirf缺失改善了MI后小鼠的心脏功能并缩小了梗死范围(图8B,C)。2810403D21Rik/Mirf的敲除增加了自噬小泡(箭头)的数量,并促进了MI心脏的自噬(图8D)。western blot显示2810403D21Rik/Mirf在MI小鼠中的抑制恢复了SQSTM1和USP15的上调,挽救了ATG7,BECN1和ATG5的下调,并促进了LC3-I向LC3-II的转变(图8E)。这些结果表明,沉默2810403D21Rik/Mirf可能调节自噬,并对缺血性损伤提供保护作用。