CircTLK1通过miR-136-5p促进肾癌的增殖和转移
越来越多的证据表明,circRNAs是潜在的生物标志物,是肿瘤发生发展的关键调控因子。然而,circRNAs在肾癌中的确切作用尚不清楚。因此,小编在这里介绍了发表于“molecular cancer”的文章“CircTLK1 promotes the proliferation and metastasis of renal cell carcinoma by sponging miR-136-5p”。

在本研究中,我们通过对RCC细胞株的circRNA高通量测序,将circRNA-TLK1(circTLK1)鉴定为一个新的候选基因。通过qRT-PCR检测肾细胞癌组织和细胞中mRNA、circRNA和miRNA的表达水平。我们进行了功能缺失实验来检测circTLK1在体外和体内RCC细胞表型中的生物学作用。最后采用RNA-FISH、RNA下拉、双荧光素酶报告、western blot和免疫组化等方法研究了circTLK1功能的分子机制。
结 果:
1.circTLK1在肾癌组织中高表达,其表达与预后不良显著相关
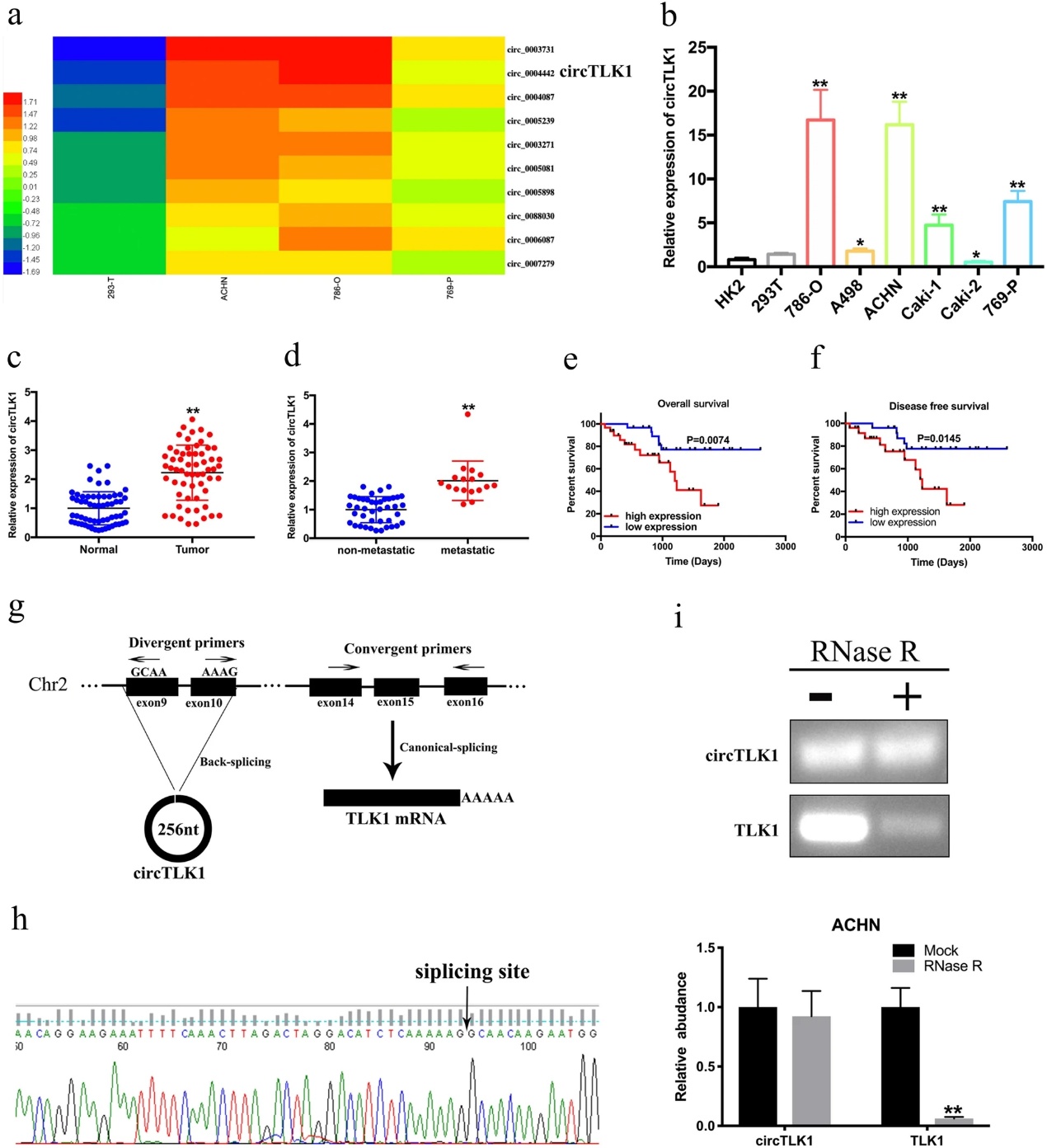
为了探讨circRNA在肾细胞癌中的表达,我们进行RNA测序。结果发现正常肾上皮细胞和肾细胞癌细胞之间存在7335个circRNA的差异表达,其中上调1919条,下调5416条(图1a)。circTLK1(hsa_circ_0004442)是所有候选基因中上调幅度最大的一个。因此,我们研究了circTLK1在肾癌细胞和正常肾上皮细胞中的表达。数据显示,在ACHN、786-O和769-P细胞中,circTLK1的表达明显高于在HK2和293T细胞中的表达(图1b)。CircTLK1不仅在肾癌组织中高表达(图1c),而且在肾癌术后转移患者中高表达(图1d)。此外,与低circTLK1表达相比,肾癌患者高circTLK1表达与较低的总生存率(图1e)和较低的无病生存率(图1f)呈负相关,提示circTLK1可能是一种预后肿瘤标志物。circTLK1来源于TLK1的第9外显子和第10外显子,形成247nt的循环转录本(图1g)。进一步的序列分析显示circTLK1长247nt,包含两个外显子。此外,我们发现TLK1的外显子发生了头到尾剪接(图1h)。检测circTLK1的稳定性,结果显示RNase R不能消化circTLK1,但经RNase R处理后TLK1的mRNA表达显著下降(图1i)。
2.circTLK1基因敲除抑制肾癌细胞增殖
为了鉴定circTLK1在肾癌中的病理功能,我们合成了一种特异性靶向于circTLK1的shRNA质粒载体,发现该载体稳定抑制三种肾癌细胞系中circTLK1的表达(图2a)。在shRNAs中,shRNA-2的敲除效率最高。然而,抑制circTLK1并没有改变TLK1的mRNA(图2b)和蛋白质(图2c)的表达。然后我们研究了circTLK1对肾癌细胞增殖的影响。CCK-8检测显示circTLK1敲除减慢了RCC细胞的生长(图2d)。菌落形成分析表明,在circTLK1沉默后,菌落数量明显减少(图2e,f)。

3.circTLK1基因敲除抑制RCC细胞的迁移和侵袭
我们进行transwell实验,观察circTLK1对RCC细胞迁移和侵袭的影响。我们的结果表明, circTLK1下调降低了RCC细胞的迁移能力(图3a-c)。此外,circTLK1敲除抑制RCC细胞侵袭(图4d)。基于circTLK1在肾癌细胞迁移和侵袭中的作用,我们推测circTLK1可能介导肾癌细胞的上皮-间质转化(EMT)过程。如图3e所示,间充质标记物N-cadherin和vimentin在circTLK1沉默的细胞中的表达显著降低,而上皮标记物E-cadherin在circTLK1抑制细胞中的表达增加。

4.circTLK1起到miR-136-5p海绵的作用
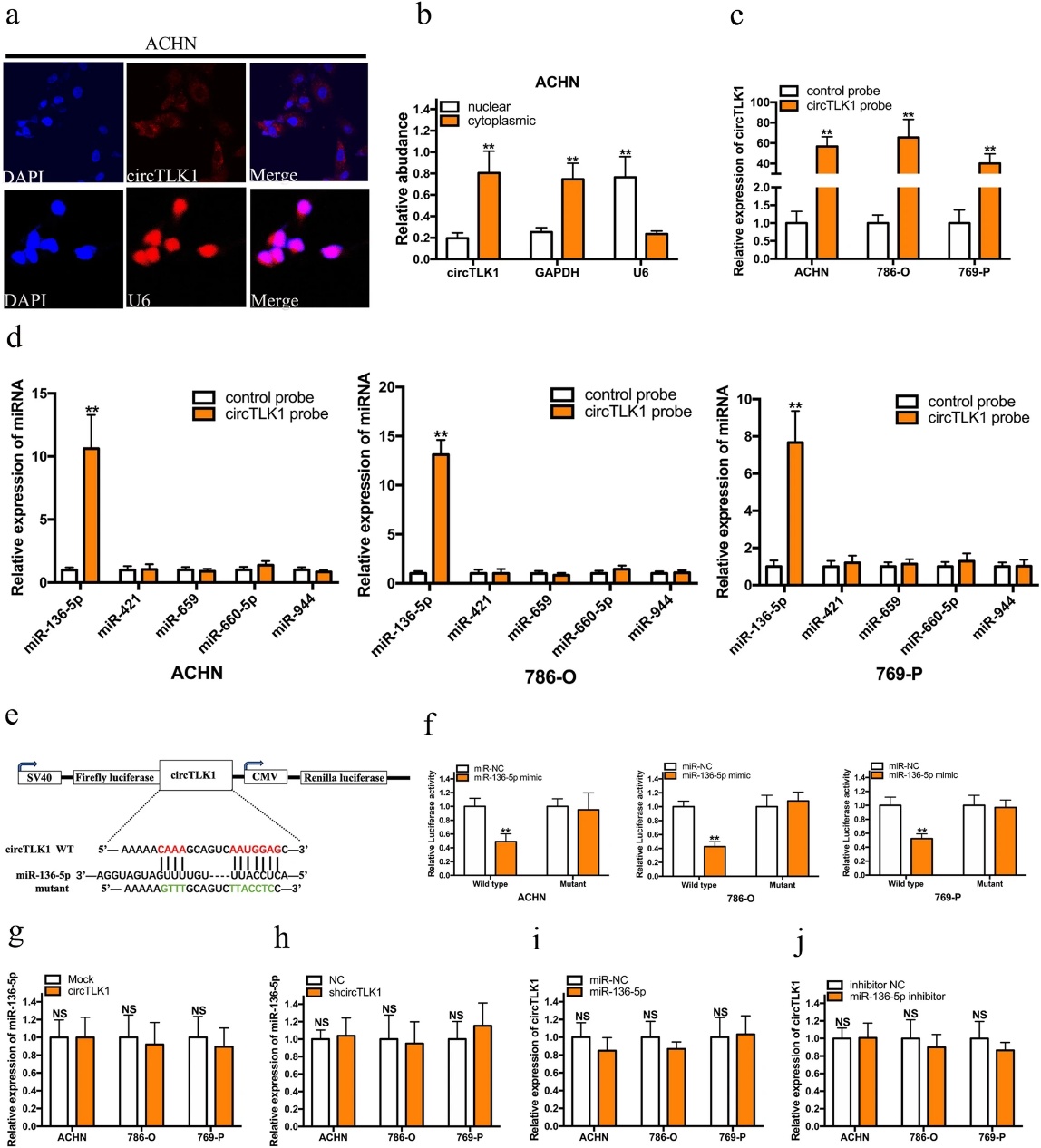
为了阐明circTLK1的分子机制,我们进行了FISH和核质分离分析来检测circTL1K的亚细胞定位。如图4a,b所示,我们发现circTLK1主要位于细胞质中,这表明circTLK1可能作为ceRNA来捕获miRNAs,导致特定的靶向转录物的释放。为了研究这个假设,我们利用circRNA相互作用数据库预测circTLK1的潜在靶点,我们选择了5种可能结合的miRNA,包括miR-136-5p、miR-421、miR-659、miR660-5p和miR-944。然后,进行RNA pull down分析评估circTLK1是否能直接捕获这些候选miRNAs。当circTLK1过表达时,生物素化的circTLK1探针显著降低了RCC细胞中的circTLK1(图4c)。我们的结果显示miR-136-5p是肾癌细胞中仅有的被生物素化circTLK1探针大量拉下的miRNA(图4d)。此外,我们构建了野生型(WT)和突变型(Mut)circTLK1荧光素酶报告子,以检测miR-136-5p在circTLK1活性调节中的作用。转染后,我们观察到miR-136-5p的过表达显著抑制WT-circTLK1荧光素酶报告活性,但不抑制Mut-circTLK1荧光素酶报告活性(图4e,f)。然而,circTLK1的过表达或敲除对肾癌细胞miR-136-5p的表达没有影响(图4g,h)。此外,miR-136-5p的过表达或敲除并不调节RCC细胞中circTLK1的表达(图4i,j)。这些实验都表明circTLK1作为miR-136-5p的海绵。
5.miR-136-5p通过靶向CBX4促进肾癌进展
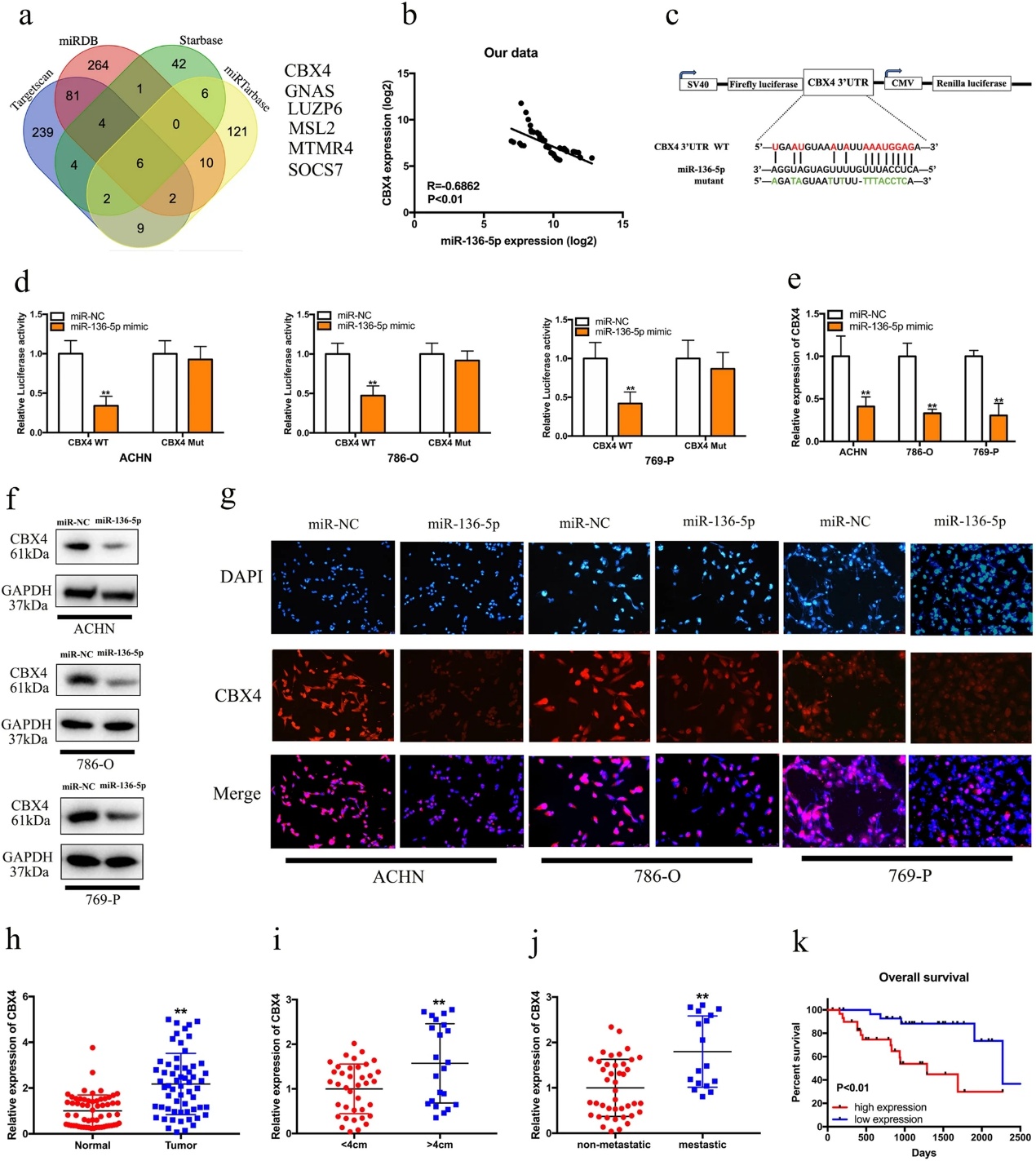
为了确定miR-136-5p的潜在基因,我们利用TargetScan、miRDB、Starbase和miRTarBase数据库进行了生物信息学分析,选择CBX4、GNAS、LUZP6、MSL2、MTMR4和SOCS7作为miR136-5p的潜在靶点(图5a)。进一步的综合转录分析表明miR-136-5p表达与CBX4表达呈负相关(图5b)。为了研究CBX4是否可能是miR-136-5p的靶点,使用含有miR-136-5p结合序列的CBX4的3'UTR的WT或Mut序列合成荧光素酶报告质粒(图5c)。荧光素酶报告分析结果表明,miR136-5p模拟物和CBX4-WT质粒的共转染显著降低了荧光素酶的活性。然而,miR-136-5p模拟物和CBX4 Mut质粒的共转染并没有改变荧光素酶的活性(图5d)。此外,miR-136-5p的强制表达抑制了C B x 4的mRNA和蛋白表达(5e-g)。接下来,我们检测了CBX4在肾癌进展中的作用。如图5h所示,与正常组织相比,RCC组织中CBX4表达上调。我们发现CBX4的表达与肿瘤大小和术后转移呈正相关(图5i,j)。此外,肾细胞癌患者中CBX4的高表达与较低的总生存率相关(图5k)。
6.CBX4基因敲除抑制RCC细胞增殖、迁移和侵袭
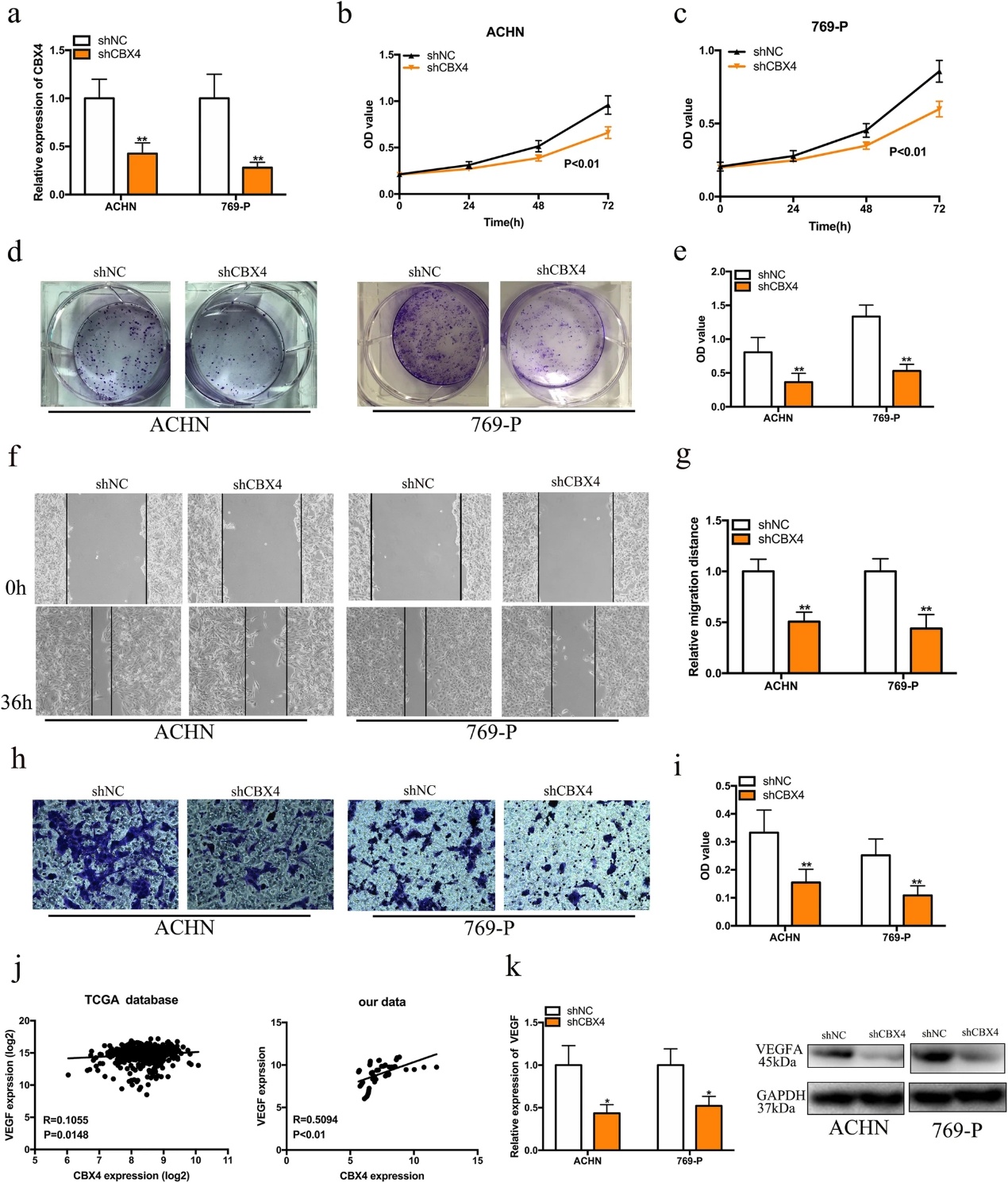
我们研究了CBX4在肾癌细胞表型中的作用。使用shRNA靶向circTLK1,我们有效地抑制了其在ACHN和769-P细胞中的表达(图6a)。通过CCK-8分析,我们发现沉默CBX4显著抑制ACHN和769-P细胞的增殖(图6b,c)。结肠形成实验还表明,CBX4的敲除大大削弱了RCC细胞的增殖能力(图6d,e)。进一步的实验表明,沉默CBX4显著抑制ACHN和769-P细胞的迁移和侵袭(图6f-i)。此外,我们发现CBX4的mRNA水平与TCGA数据库和我们的数据集(图6j)中的VEGF mRNA水平正相关。CBX4基因敲除抑制VEGFA的mRNA和蛋白质水平(图6k)。
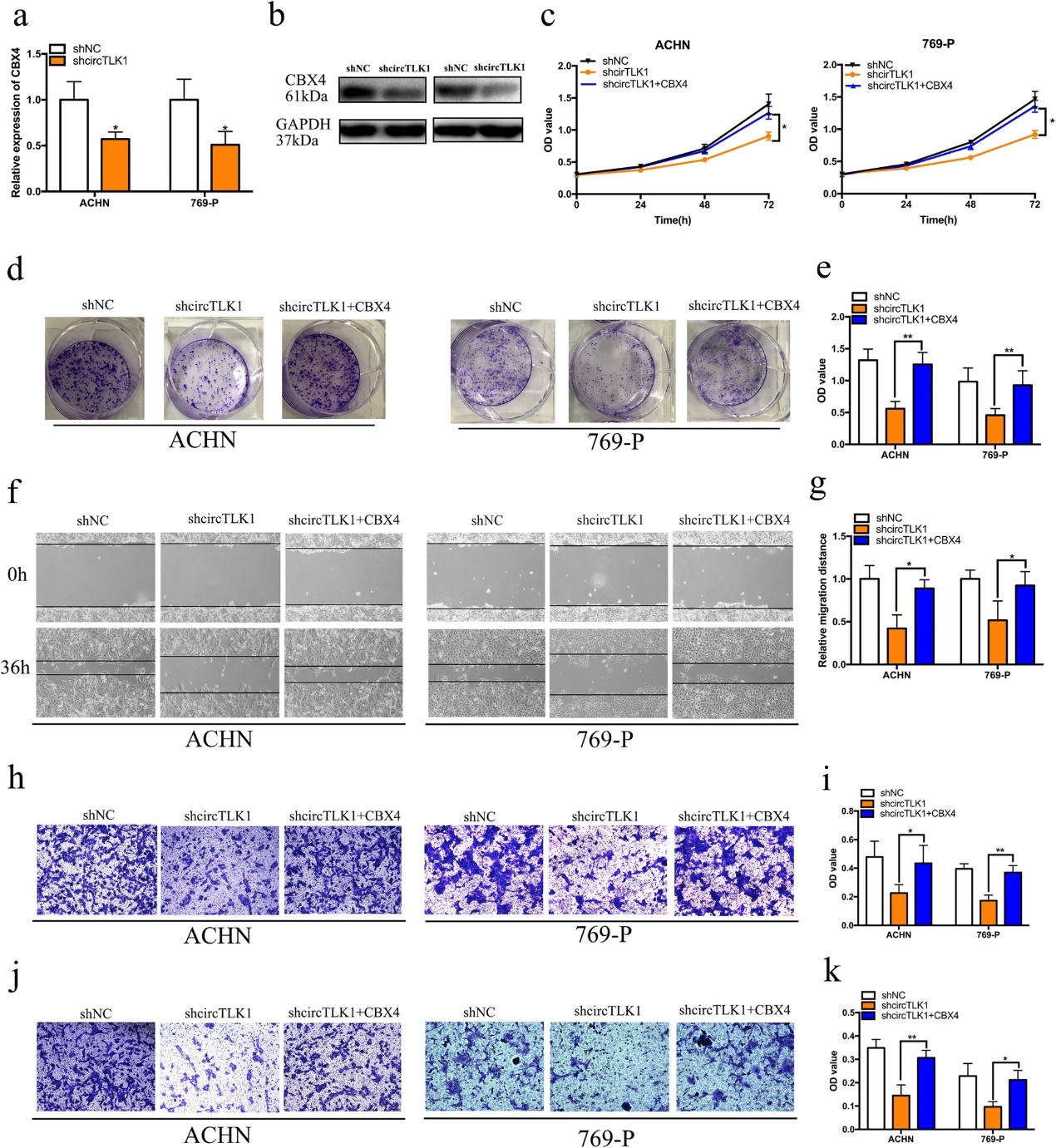
7.CBX4过表达逆转circTLK1抑制细胞增殖和转移的作用
为了探讨circTLK1是否通过调节CBX4的表达而发挥其生物学功能,我们进行了挽救实验。我们发现敲除circTLK1明显抑制CBX4的mRNA和蛋白表达(图7a,b)。CCK-8分析显示CBX4过表达显著逆转了circTLK1抑制诱导的ACHN和769-P细胞生长曲线抑制(图7c)。菌落形成分析表明,强制表达CBX4逆转了circTLK1沉默诱导的细胞增殖抑制(图7d,e)。此外,CBX4上调显著逆转了circTLK1沉默诱导的RCC细胞迁移(图7f-i)和侵袭(图7j,k)抑制。
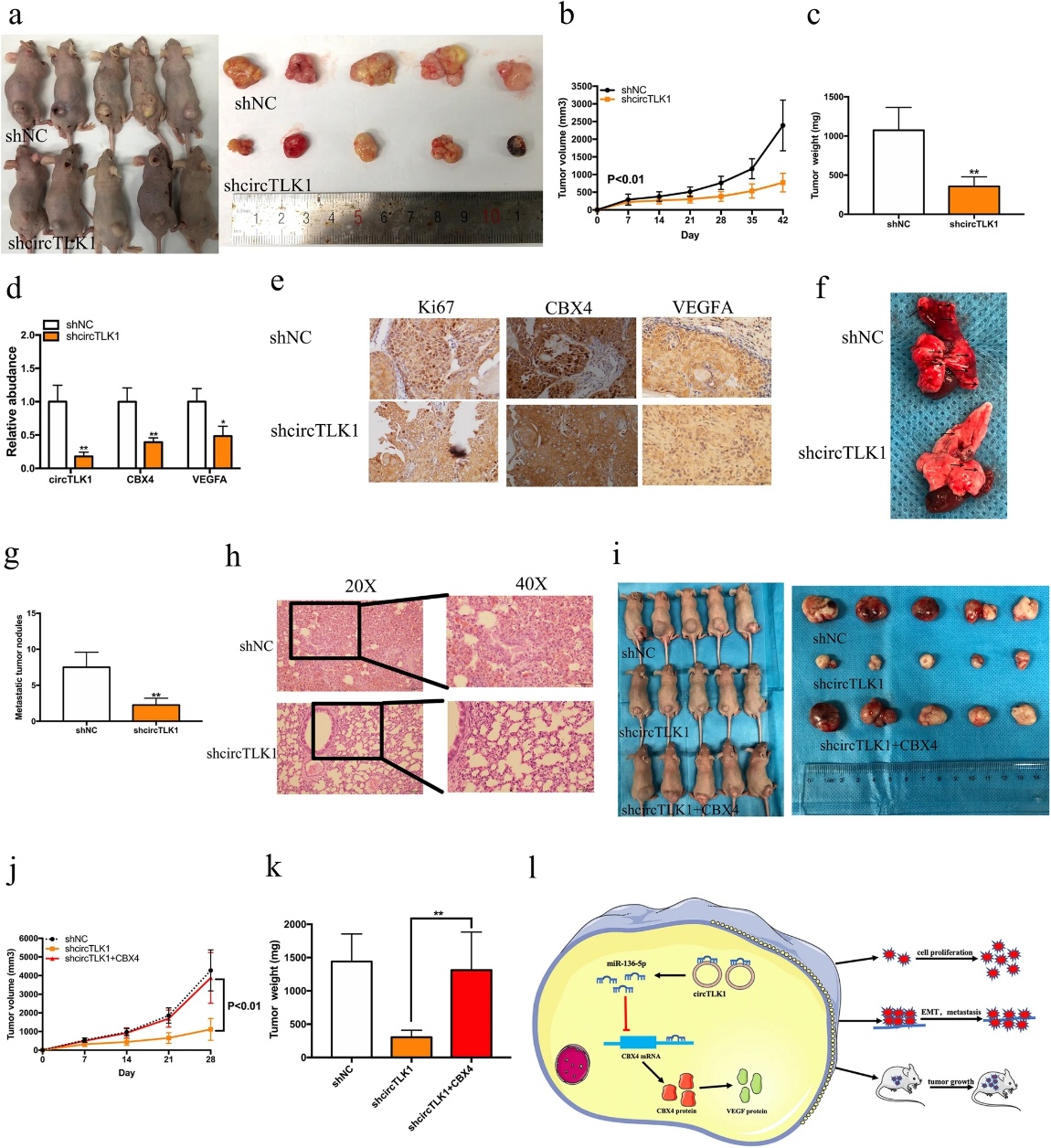
8.circTLK1基因敲除抑制RCC细胞在体内的生长和转移
为探讨circTLK1在RCC体内生长和肺转移中的作用,将转染shcircTLK1或shNC的稳定769-P细胞注入裸鼠体内,建立裸鼠移植瘤和肺转移模型。在异种移植瘤模型中,来自转染shcircTLK1的细胞的肿瘤比来自转染shNC的细胞的肿瘤小(图8a)。circTLK1基因敲除显著抑制肿瘤体积和重量(图8b-c)。此外,敲除circTLK1抑制CBX4和VEGFA在体内的mRNA表达(图8d)。IHC分析表明,circTLK1的表达降低抑制了Ki67、CBX4和VEGFA的表达(图8e)。在裸鼠肺转移模型中,抑制circTLK1导致肺转移显著减少(图8f-g)。此外,HE染色显示shcircTLK1组的肺肿瘤灶比shNC组少(图8h)。异种移植瘤模型显示CBX4的过表达逆转了circTLK1的沉默导致的细胞生长抑制(图8i-k)。总之,circTLK1通过海绵化miR513a-5p调节CBX4的表达促进肾癌的生长和转移(图8l)。
结 论:
circTLK1通过吸收miR-136-5p来增加CBX4的表达,在RCC进程中发挥关键作用。circTLK1可能作为RCC的诊断生物标志物和治疗靶点。






